
Uchebnik
.pdf
21 |
10% кислота |
|
видимый |
яркий (осадок) |
антоцианы, |
|||||||||||||||||||||
|
щавелевая в 50% |
|
свет |
|
|
|
|
|
|
|
|
|
антоцианидины |
|||||||||||||
|
водном ацетоне |
|
|
|
|
|
|
|
|
|
|
|
|
флавоны, флавонолы |
||||||||||||
22 |
HCl или H2SO4 |
|
видимый |
желтый |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
свет |
желто-коричневый |
изофлавоны |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
до красно- |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
коричневого |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
23 |
0.5 г. Н3ВО3 + 0.5 г. |
видимый |
ярко-желтый |
5-ОН и 5-ОСН3 |
|
лимонной кислоты в |
свет |
|
флавоны и |
|
20 мл безводного |
|
|
флавонолы |
|
ацетона, 100-1050С |
УФ |
желто-зеленый |
дигидрохалконы, |
|
(р.Вильсона) |
|
|
хиноны |
|
|
УФ |
желтый |
полифенолы с рядо- |
|
|
|
|
выми ОН-группами |
24 |
5% спиртовый р-р п- |
УФ |
красный, |
лейкоантоцианидины |
|
толуолсульфокислоты |
|
оранжевый |
|
10% раствором кислоты щавелевой в смеси ацетон-вода (1:1) отличают антоцианы и антоцианидины по образованию ярко окрашенных растворов и осадков.
Бифлавоноиды отличают по изменению желто-коричневого до краснокоричневого окрашивания от действия 70% раствора церия сульфата в кислоте серной концентрированной.
Помимо указанных выше общих основных химических свойств, обусловленных структурными элементами всех флавоноидных молекул, каждая группа флавоноидов имеет специфические физические и химические свойства, в большей или меньшей степени характерные для различных соединений внутри группы.
Для оценки реакционной способности молекул флавоноидов проведены расчеты длин связей, углов между ними и величин зарядов на атомах углерода.
Молекулярные диаграммы молекул некоторых флавоноидов помогают объяснить, например, аномальное поведение 3- и 5-ОН групп в процессах комплексообразования и титрования, диссоциации связей О-Н и поведения их в реакциях алкилирования, ацилирования и др., например:
451

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,008 |
|
|
0,003 |
|
|
|
|
|
0,084 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,013 |
|
0,025 |
|
|
|
|||||||||||||||||||||||
-0,052 |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
0,228 |
|
|
|
|
|
-0,018 |
|
|
|
|
|
|
0,011 |
0,035 |
|
|
-0,013 |
|
|
0,279 |
|
|
|
|
|
|
|
|
|
|
|
-0,061 |
|
|
|
|
|
|
|
0,059 |
||||||||||||||||||||||||||||||
0,022 |
|
|
0,008 |
|
|
|
|
|
|
|
|
|
|
|
|
0,025 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,130 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
-0,045 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,031 |
|
|
0,027 |
|
|
0,216 |
|
|
|
|
-0,093 |
|
|
|
|
|
|
|
|
|
|
0,025 |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
-0,015 |
|
|
|
|
|
|
0,239 |
|
|
-0,063 |
0,017 |
|
|
0,008 |
|
|
-0,080 |
|
|
|
|
|
|
|
0,026 |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
0,046 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,406 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O 0,295 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
флавон, молекулярная форма |
|
|
флавон, протонированная форма |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,016 |
|
|
0,006 |
|
|
|
|
-0,015 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,009 |
0,028 |
|
|
|
||||||||||||||||||||||||||
-0,056 |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
0,225 |
|
|
|
|
|
-0,008 |
|
|
|
|
0,000 |
0,080 |
|
|
0,024 |
|
|
0,284 |
|
|
|
|
|
|
|
|
|
|
|
-0,054 |
0,052 |
|||||||||||||||||||||||||||||||||||||||
0,023 |
|
|
0,016 |
|
|
|
|
|
|
|
|
|
|
|
|
-0,077 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,055 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
- 0,055 |
|
|
|
|
|
|
|
-0,027 |
|
|
|
|
|
|
|
|
|
|
|
0,033 |
|
|
-0,078 |
|
|
0,174 |
|
|
|
|
-0,054 |
|
|
|
|
|
|
|
|
|
0,024 |
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
-0,021 |
|
|
|
0,235 |
|
|
0,014 |
|
|
|
|
|
0,007 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,001 |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
0,044 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,026 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,134 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,125 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,412 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O 0,283 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
3-оксифлавон, молекулярная форма |
|
3-оксифлавон, протонированная форма |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
-0,090 |
|
|
|
|
|
|
|
|
|
|
|
-0,008 |
|
|
0,003 |
|
|
|
|
-0,047 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,013 |
0,025 |
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
0,030 |
|
0,015 |
|
|
|
|
|
0,231 |
|
|
|
|
|
-0,018 |
0,010 |
0,091 |
|
0,030 |
|
|
|
0,279 |
|
|
|
|
|
|
|
|
|
-0,059 |
|
|
|
|
|
|
0,058 |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
0,027 |
|
|
|
|
|
|
|
0,128 |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
-0,103 |
|
|
|
|
|
|
|
-0,066 |
|
|
|
|
|
|
|
-0,035 |
|
-0,123 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
-0,082 |
|
|
|
|
|
|
0,240 |
|
|
|
|
|
|
|
|
|
|
|
0,007 |
|
|
|
|
|
0,206 |
|
-0,098 0,024 |
0,024 |
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
0,016 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
0,066 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,059 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
0,149 |
OH |
|
|
|
|
|
O -0,429 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,141 |
OH |
|
|
|
|
|
|
O 0,283 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
5-оксифлавон, молекулярная форма |
|
5-оксифлавон, протонированная форма |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
0,130 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,009 |
0,002 |
|
0,161 |
-0,089 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,011 |
0,024 |
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
0,119 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
HO |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,277 |
|
|
|
|
|
|
|
|
|
|
-0,058 0,053 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,228 |
|
|
|
|
|
-0,017 |
0,009 |
0,098 |
|
|
|
|
0,035 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
0,045 |
0,035 |
|
|
|
|
|
|
0,022 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,122 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
-0,074 |
|
|
|
|
|
|
|
|
|
|
-0,062 |
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,021 |
-0,105 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,097 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
-0,074 |
0,052 |
|
|
|
|
|
0,239 |
|
0,017 |
0,008 |
|
|
|
|
0,038 |
|
|
|
|
|
|
|
0,210 |
|
|
|
|
|
|
|
|
0,024 |
0,024 |
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,042 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O 0,292 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
7-оксифлавон, молекулярная форма |
|
7-оксифлавон, протонированная форма |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Окисление флавонов и флавонолов легко осуществляют персульфатом калия, при этом новая ОН-группа вступает, обычно, в пара-положение к уже имеющимся ОН-группам. Эта реакция может быть с одной стороны, способом получения полиоксипроизводных из более простых оксифлавонов и оксифлавонолов, а с другой - указывает на свободное п-положение, относительно ОН-групп. Продукт реакции проверяют указанной выше «госсипетиновой пробой».
452

Алкилирование. Реакции алкилирования изучаются более 30 лет, получена серия от монодо пентаалкилпроизводных на основе кверцетина и других флавоноидов. Например, реакция с аллилбромидом приводит к получению изомерных производных по кольцу А:
Дезалкилирование метоксипроизводных проводят по реакции с хлоридом или бромидом алюминия при 1000С в растворе нитробензола. Селективное деметилирование 5-ОСН3 проводят НBr в уксусной кислоте при комнатной температуре. Освободившуюся 5-ОН группу можно окислить по реакции с персульфатом калия в пиридине либо до хинона, либо ввести дополнительную ОН-группу. При действии азотной кислоты окисление проходит чаще до хинона, например:
При восстановлении флавонов и изофлавонов натрием в спиртовом растворе, а также при каталитическом гидрировании на никеле-скелетном с хорошими выходами получают соответствующие флаваноны и изофлаваноны, что подтверждает генетическую связь между этими группами соединений. Обратный переход возможен по реакции бромирования флаванов и изофлаванов с последующей обработкой бромпроизводных щелочью:
O |
|
+ H2 |
|
O |
|
|
|
|
|
+ Br2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
+ Na /ROH |
|
|
|
|
|
|
OH- |
|
|
|
||
|
|
|
|
|
O |
|
+ H2 |
/ Ni |
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||
Применяя различные восстановители, можно получить различные производные флавоноидов. Так, при каталитическом гидрировании на платине или палладии получают хроманы, флаваны и изофлаваны; при взаимодействии с магнием в концентрированной соляной кислоте – антоцианидины, при восстановлении Zn-пылью в растворе соляной кислоты образуются флаваноны:
453

Реакции ацилирования проводят соответствующими ангидридами или галогенангидридами кислот при нагревании.
Реакции силилирования проводят в абсолютной среде по реакции с алкилсиланами при комнатной температуре.
Реакции конденсации флавоноидных молекул осуществляют в среде сухих или абсолютированных растворителей с участием ОН-групп с образованием С-О-С связей или по орто-, пара-положениям относительно ОНгрупп с образованием связей С-С. Обе реакции проходят при нагревании в присутствии катализаторов.
Восстановительное ацетилирование рамнезина, кверцетина, текто-
хризина и 7-окси-4’-метоксифлавона проходит с образованием аморфных продуктов, которые после обработки их спиртовым раствором НСl, дают небольшие количества соответствующих антоцианидинов и флавилий хлоридов, а сырые продукты восстановления содержат на одну ацетильную группу больше, что может соответствовать структурам:
По реакции с R'NH2 (C1-2) получены продукты взаимодействия по С=О и ОН-группам:
Нуклеофильный обмен кислорода С=О группы затруднен и
С=О группы затруднен и проходит при нагревании в течение 10 часов (особенно по реакции с ArNH2).
проходит при нагревании в течение 10 часов (особенно по реакции с ArNH2).
В обычных условиях проходит реакция с реактивом Гриньяра, но продукты реакции выделены в форме ангидропириллиевых солей:
454

Из 7-оксифлавона по реакции Манниха получены 7-окси-8-диалкил- аминофлавоны.
Для кверцетина и мирицетина осуществлены реакции электрофильного замещения в кольцах А и В и показана возможность селективного образования изомерных продуктов моно-, ди-, три- и тетразамещения. В избытке реактивов или при нагревании до температуры 1000С и выше, образуются только тетразамещенные мирицетина и пентазамещенные кверцетина, при этом квантово-химическими расчетами показана более высокая реакционная способность кверцетина по сравнению с мирицетином во всех реакциях электрофильного замещения, нуклеофильного обмена с участием группы С=О,
вреакциях ацилирования и димеризации.
Вреакциях бромирования предпочтительным местом реакции является Н-8 для мирицетина и Н-6 – для кверцетина; в реакциях сульфирования кверцетина реакция проходит в последовательности 5’ > 6 > 8-положения и основным продуктом была 5’-моносульфокислота, затем два изомера 6,5’- и 8,5’-дисульфокислоты.
Ниже приведена схема химической модификации структур природных кверцетина и мирицетина:
455

HO HO |
O |
HO |
|
|
|
|
|
|
|
|
|
H2N |
OH |
|
|
|
|
|
|
|
|
|
|
|
OCOR1 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
HO |
|
O |
|
OH |
|
|
|
|
HO |
|
O |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OCOR1 |
||||||||
HO |
|
|
|
|
|
|
|
|
|
H2N |
|
|
|
|
I. (CH3CO)2O |
|
|
|
|||||||||
O |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
OH |
|
|
|
OH |
R |
|
II. R1COCl |
|
OCOR1 R |
|||||||||||
|
|
|
H2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
HO |
|
|
|
|
|
|
|
|
OH |
O |
|
|
|
|
|
|
|
R1OCO |
O |
|
|
||||||
|
|
HO |
|
|
O |
|
|
|
|
|
OH |
|
Sn /HCl |
OH |
|
|
|
|
|
|
|
R=C6H5, BrC6H4 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2N |
|
H SO |
|
|
|
|
HO3S |
OH |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
OH |
|
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
OH |
|
|
O |
|
OH |
|
2 |
4 |
|
HO |
|
O |
|
|
|||||||
|
|
|
|
OH |
O |
|
|
|
O2N |
|
|
|
|
|
|
|
|
|
|
OH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO3S |
|
|
|
|||||||
|
|
|
|
|
|
H2C=O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
OH |
|
|
|
|
|
OH |
R |
|
|
|
|
|
|
|
|
||||||||
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
R |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
OH |
|
O 6-NO ; 8-NO ; 5'-NO ; |
|
|
|
|
|
OH |
O |
|||||||
HO |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
Br2 |
|
|
|
|
2 |
2 |
2 |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
OH |
|
|
|
|
|
|
6,8-NO |
; 6,5'-NO ; 8,5'-NO ; |
|
6-SO3H; 8-SO3H; 5'-SO3H; |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Br |
|
|
|
|
|
|
|
|
|
|
HO-NO2 |
2 |
|
2 |
|
|
2 |
|
|||||||||
OH |
|
|
|
|
|
|
|
|
|
6,8,2'-NO2; 6,8,2',6'-NO2 |
|
|
|
6,5'-SO3H; 8,5'-SO3H; |
|
|
|||||||||||
|
|
R |
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
6,8,2',5',6'-SO3H; 6,8,2',6'-SO3H |
||||||||
|
OH |
O |
|
|
|
|
|
|
|
HO |
|
O |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||
6-Br-кверцетин; 6,8; 6,5'; 6,8,2',5',6'; |
|
|
|
|
OH |
|
|
|
|
|
|
|
R |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
8-Br-мирицетин; 6,8; 6,5'; 6,8,2',6' |
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
O |
|
OH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
+ |
R1 |
|
|
|
|
|
|
|
|
OH |
R |
|
|
диазосоли R |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
OH |
|
O |
|
|
|
|
|
|
|
|
|
OH |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
HOOC NH2 |
|
|
|
|
R=H - кверцетин |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
O |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
R=OH - мирицетин |
|
|
|
|
|
|
|
|
|
|
|||||
|
+ NaSH |
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
70% + 6,8-R 20-25% |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
R1HO |
|
|
O |
|
|
|
OH |
|
+ Mg / |
|
|
|
|
OH |
|
|
|
|
O |
N |
COOH |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
абс.эфир |
|
|
|
|
|
|
|
|
|
CH |
|||
|
|
HOOC |
HC N |
|
|
|
|
OH |
|
|
R= |
|
|
|
|
N |
|
|
H |
(CH2)2 |
|||||||
|
|
|
|
|
|
OH |
|
|
|
N |
|
|
N |
|
|||||||||||||
|
|
|
|
H |
OH |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
||||
|
|
|
|
R1=H, CH3, CH(CH3)2, CH2C6H5 |
|
|
|
-N=N |
N |
N |
|
|
|
|
|||||||||||||
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
- |
N=N |
|
|
|
|
|
|
|
-N=N |
|
SO Na |
||
|
|
HS |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO2NH2 |
|
|
3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
O |
|
|
OH |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
-N=N |
|
NO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
HS |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
-N=N |
|
|
|
|
SO |
S |
|
|
2 |
||||||
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
R |
|
|
|
HO |
|
O |
|
|
|
|
|
|
|
|
2 |
|
|
|
|||||||
|
OH |
O |
|
|
|
|
|
|
OH |
|
|
|
|
|
HN |
|
|
|
|
||||||||
|
|
|
O |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|||||||
|
|
R |
|
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH R |
-N=N |
|
|
|
|
SO2 |
N |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
HO |
|
|
|
|
|
|
|
|
OH O |
|
|
|
|
|
|
|
|
HN |
|
|
|
|
|||
|
|
|
|
O |
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
||||
|
|
HO |
|
|
|
R=H, OH |
|
|
|
|
|
-N=N |
|
|
|
|
|
|
|
|
|
||||||
(CH2)2-N(C2H5)2
Идентификация ароматических ядер и характера замещения в них возможна через идентификацию продуктов щелочного расщепления (NaOH или КОН, 50% при нагревании), при этом образуется 2 или 3 продукта расщепления ароматического характера.
Так, из флавона образуется о-оксидибензоилметан, который затем распадается на салициловую кислоту и ацетофенон и частично на о- оксиацетофенон и бензойную кислоту по схеме:
Из кверцетина при щелочном плаве получают флороглюцин (кольцо А) и протокатеховую кислоту (кольцо В), устанавливая, тем самым, число и расположение ОН-групп:
456
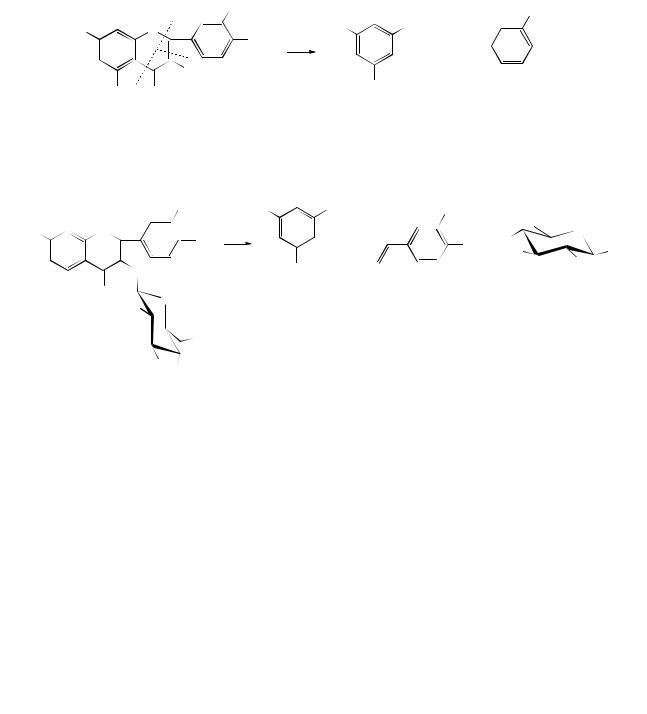
При щелочной деструкции гликозидов образуется третий продукт - углеводный фрагмент, который идентифицируют в подкисленном гидролизате, например:
При наличии в структурах простых эфирных связей (ОСН3, О-углевод) реакции деметилирования и щелочной гидролиз проводят в мягких условиях.
Щелочной гидролиз используется для установления порядка связи в биозидах и дает возможность отличить 1 2 порядок связи от 1 3, 1 6. 1 2 связь расщепляется быстро, 1 3 и 1 6 значительно медленнее.
Гидролиз стереоспецифическими ферментами применяется для определения конфигурации гликозидной связи. Для гидролиза -гликозидной связи используется мальтаза дрожжей, -гликозидной – эмульсин из сладкого миндаля. -гликозидаза миндаля специфична в отношении -связей, но мало специфична в отношении порядка связи. Ламинариназа достаточно специфична в отношении -1 3 связей, глюкоамилаза - -D- 1 4, 1 3 и 1 6 глюкозидных связей. Рамнодиастаза отщепляет сахар при 1 6 порядке связи.
Инвертаза - -фруктозидаза, отщепляет фруктозу, присоединенную - гликозидной связью. При любом порядке связи между углеводами, размер окисного цикла определяют при гидролизе 0.1% НСl.
Окисление хромовым ангидридом используется для определения конформации аномерного центра ( -гликозидная связь).
Эти же задачи решаются поляриметрическим анализом при сравнении молекулярного вращения гликозида с соответствующими метил- и фенилгликозидами.
Реакции гидролиза О-гликозидов осуществляют действием разбавленных минеральных и органических кислот с образованием свободного сахара и агликона. Обычно для этой цели используют 5% водный или водно-спиртовый раствор соляной или серной кислоты при 1000С. Для гидролиза С-гликозидной связи требуются более жесткие условия (смесь концентрированных соляной и уксусной кислот). Продолжительность гидролиза во времени различна и
457

зависит от строения, в частности от размера окисного цикла, конфигурации аномерного центра, строения сахара. Скорость гидролиза О-гликозидной связи фуранозных форм в 100-200 раз быстрее, чем пиранозных. Для определения размера окисного цикла проводят гидролиз 0.1% кислотой хлороводородной на кипящей водяной бане, при этом О-гликозидная связь фуранозидов гидролизуется в течение нескольких минут, например, при гидролизе тригликозида изорамнетина, отщепление биозы наблюдалось на пятой минуте, на двадцатой - отщепляется моносахарид, что позволило предположить пиранозную форму концевой глюкозы и фуранозную форму глюкозы, связанной с агликоном:
Гидролиз 7-О-β-D-глюкозида рутина:
458

-гликозидные связи гидролизуются быстрее -гликозидных, маннозиды гидролизуются быстрее глюкозидов в три раза, галактозиды – в пять раз. Скорость гидролиза рамнозидов и арабинозидов еще выше.
Для выяснения места присоединения углеводного фрагмента проводится метилирование гликозидов диазометаном, йодистым метилом, диметилсульфатом в основной среде (К2СО3) с последующим кислотным гидролизом и идентификацией продуктов гидролиза.
Изофлавоноиды, также как и флавоновые соединения отличаются структурным многообразием и могут быть разделены на несколько групп, знание структурных особенностей которых используют для их разделения и идентификации:
Указанные переходы, связанные с раскрытием кольца С и с процессами конденсации проходят в растениях с участием соответствующих ферментных систем.
Основные структурные элементы изофлавоноидов повторяют соответствующие свойства флавоноидов, отмеченные выше - это восстановление связи С2=С3 до соответствующих изофлаванонов, реакции с участием С=О группы, раскрытие кольца С, ароматические свойства колец А и В, но все реакции идут сложнее из-за пространственного экранирования С=О и кольца В.
В одинаковых условиях все изофлавоноиды хуже растворимы по сравнению с флавоноидами, но на этом свойстве их трудно отделять друг от друга, особенно при одинаковом замещении колец А и В.
459

Неофлавоноиды являются производными 4-фенилхромана, не содержат карбонильной группы и двойной С2=С3 связи, поэтому для них в большей степени характерны свойства многоатомных фенолов.
Большую группу флавоноидов составляют пренилированные формы, представление о разнообразии которых можно получить на примере рубрафлавонов:
|
HO |
|
|
HO |
|
HO |
O |
OH |
HO |
O |
OH |
|
|
|
|
||
|
O |
|
|
O |
|
рубрафлавон А |
|
рубрафлавон В |
|
||
HO |
O |
OH |
O |
O |
OH |
|
|
|
|
||
|
O |
OH |
|
O |
OH |
|
|
|
|
||
рубрафлавон С |
|
рубрафлавон D |
|
||
Пренилированных флавоноидов описано уже более 500, причем среди них преобладают флавоны и флавонолы с изопреноидным заместителем чаще в кольце А, например:
Все они практически не растворимы в воде и низкопроцентных органических растворителях.
По химическим свойствам они повторяют общие свойства флавонов и флавонолов, но отличаются меньшей реакционной способностью по всем структурным элементам.
Специфическими являются реакции присоединения по С=С связи углеродного заместителя, в том числе окислительно-восстановительные превращения, которые идут легче по сравнению с реакциями по С2=С3.
Редкие представители флавоноидных алкалоидов вступают в реакции с участием ОН и С=О-групп, для них характерны: фотореакция с дифенилацетиленом, замещенным гидразином, каталитическое восстановление и галогенирование.
Флаванонолы и дигидрофлавонолы содержат 2 асимметрических атома углерода (С2 и С3), и представлены в растениях 4-мя изомерами и двумя рацематами.
460
