
Uchebnik
.pdf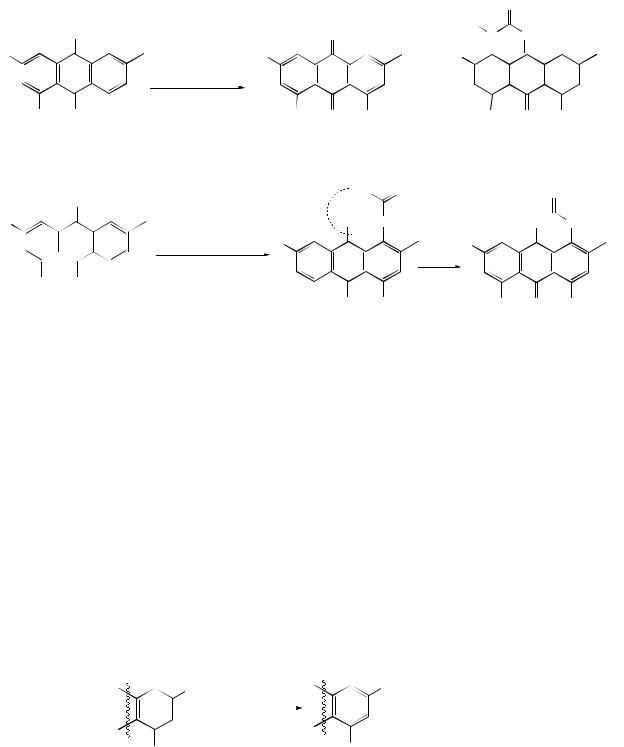
фенилгидразоны (C=N-NHC6H5). Поскольку антрахиноновая часть молекулы и связь С=N у таких соединений одинаковы, можно сделать вывод о значении природы нуклеофилов.
Взаимодействие с мочевинами и тиомочевинами возможно с участием ОН-групп и с обменом атома галогена в α- и β-положениях:
В литературе не найдено сведений о биологической активности уреидо-, тиоуреидопроизводных или пиримидоноантронов, однако сопоставление активности с исходными молекулами оксиантрахинонов позволяет сделать вывод о том, что с остатками мочевиновых и тиомочевиновых молекул связана высокая бактерицидная активность, а замыкание гетерокольца приводит к возрастанию противоопухолевой активности.
Алкилирование (арилирование) оксиантрахинонов спиртом (фенолом) проводят в присутствии водоотнимающих средств и катализаторов, но этим методом пользуются редко, т.к. выходы продуктов реакции часто невысокие. Большее значение имеет метод алкилирования диметилсульфатом, диазометаном, метиловыми эфирами ароматических сульфокислот. Галоидные алкилы, алкены, арены, наиболее часто употребляемые алкилирующие средства, вводят в реакцию в присутствии щелочных агентов или непосредственно с фенолятами в водных, водно-спиртовых средах или в органических растворителях, иногда реакции проводят под давлением:
R |
|
|
R |
+ |
R'Hal |
|
OR' |
|
|||
OH |
|
|
|
|
R'= C1-C11 (н-, изо-), алкены C1-C5 |
||
Привлекает внимание и реакция Маршалка – конденсация лейкосоединений с альдегидами и восстановление оксиалкильной группы в алкильную, причем отмечено, что при нагревании в изопропиловом спирте
521
лейкохинизарин реагирует как с алифатическими, так и с ароматическими альдегидами, а в присутствии HCl – с ароматическими. Такой же эффект добавки отмечен при взаимодействии 1,4,5-триоксиантрахинона с альдегидами.
Реакция алкинилирования возможна при взаимодействии с ацетиленом по карбонильным группам с образованием моно- и дихинолов (цис- , трансформ) или, в условиях реакции Фаворского-Шостаковского с
образованием виниловых эфиров.
Вряду антрахинона реакция винилирования была осуществлена на примере окси- и аминопроизводных при 180-2000С и давлении 25-44 атм.
Описанные условия были перенесены на реакцию хризофанола и других природных оксиантрахинонов с ацетиленом, фенилацетиленом и пропаргиловым спиртом.
Втрадиционных условиях алкинилирование не проходит, однако периокси-группировка облегчает реакции винилирования, добавление
порошкообразного КОН сокращает продолжительность реакции до 8-10 часов, оптимальный температурный режим – 20-900С.
При взаимодействии с RBr различного строения, реакции проходят не селективно, с образованием моно- и диэфиров, с количественным преобладанием последних. Чем меньше длина углеродной цепи радикала, тем выше скорость реакции: при наличии разветвления в углеродной цепи, реакция начинается более энергично на первых 2-3 часах от начала нагревания, а выход конечного продукта ниже, чем с тем же радикалом нормального строения. При проведении реакций в диоксановом растворе отмечено увеличение выхода диалкоксипроизводных, добавление H3BO3 увеличивало выход моноэфиров:
|
O |
|
|
|
|
|
O |
|
O |
O |
|
R |
|
|
I. R'OH R |
|
|
R |
R |
||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
+ |
+ |
|
|
|
II. R'Hal |
|
|
||||||
|
|
|
|
|
|
|
|||||
OH |
O |
OH |
OH O |
OR' |
OR' O OH |
OR' O OR' |
|||||
R=H, |
OH, OCH3 |
R'= C1-C11 (н-, изо-), CH2-C=CH, CH2-CH=CH2, C=CH, CH=CH2 |
|||||||||
|
|
Br2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
R |
|
|
|
|
R'OH / Cu |
R |
|
|
|
||
|
|
|
Br |
|
|
|
|
OR' |
|
||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
O |
OH |
OH |
O |
OH |
|
|||||
R=H, OH, OCH3 |
R'= C1-C11 (н-, изо-), CH2-C=CH, |
|
|||||||||
|
|
|
|
|
|
|
|
CH2-CH=CH2, C=CH, CH=CH2 |
|
||
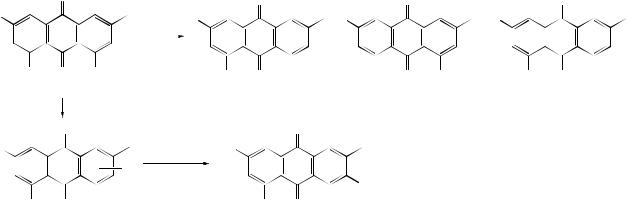
С-алкинилирование возможно по С=О группам (с реактивами Гриньяра), в боковую цепь - обменом галогена в присутствии AlCl3.
Разработаны методы препаративного получения моно- и диаддуктов и показано, что соотношение продуктов реакции зависит от природы растворителя и температурного режима.
522
Проведены реакции фосфорилирования в условиях реакции Абрамова
ипоказано, что оксимы, семикарбазоны, тиосемикарбазоны, фенилгидразоны и гидразоны О,О-диэтокси(тио)фосфорных кислот и оксифосфонаты образуются по карбонильной группе в β-положении.
При изучении биологической активности О- и С-алкил(алкен, алкенил)ированных производных показано, что противоопухолевая активность эфиров не увеличивается по сравнению с оксиантрахиноном, но проявляется специфичность действия в отношении некоторых опухолей, обезболивающий
эффект и поведенческие реакции. В ряду эфиров с С-С, С=С, С С- связью при одинаковой разовой и курсовой дозе увеличивается активность и токсичность. Увеличение массы (хризофанол димер хризофанола димер с С С-связью) приводит к увеличению противоопухолевой активности в отношении карциносарком; антиокислительная активность эфиров снижается.
524
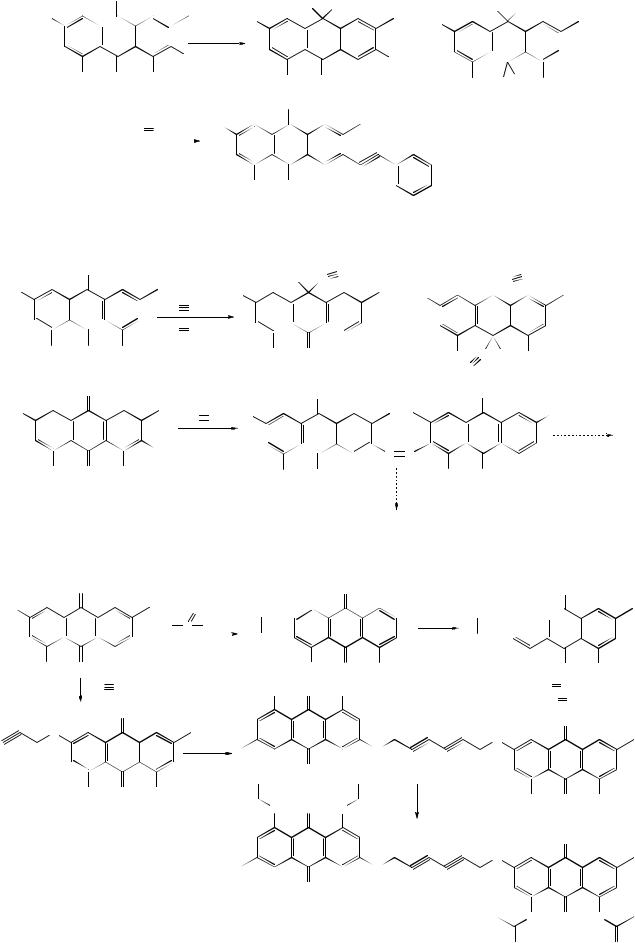
Ацилирование аминокислотами или их ангидридами изучено как с использованием ОН- и NH2-групп, так и α– и β-бромидов оксиантрахинонов; подобраны условия селективных процессов:

 Ацилирование оксиантрахинонов уменьшает активность ОН-групп,
Ацилирование оксиантрахинонов уменьшает активность ОН-групп,
повышает устойчивость ароматической системы к окислению, защищает ОНгруппы от дальнейших превращений, снижая количество побочных продуктов и увеличивая их растворимость.
Окси- и аминоантрахиноны, имеющие (или нет) другие заместители, взаимодействуют с алифатическим или ароматическими альдегидами, кетонами, кислотами. Важное значение имеет восстановительное ацилирование (СН3СО)2О или бензоилирование под действием С6Н5СОСl в диоксановом растворе в присутствии Zn-пыли; целевые продукты обладают радиопротекторными свойствами.
Найдены оптимальные условия взаимодействия эмодина, хризофанола, аналогов и некоторых их производных с галогенангидридами, алкил- и диалкилфосфорными кислотами, с солями диалкилдитиофосфоновых кислот, изоцианатами, с диметил- и триметилфосфитами, уретанами и др. Показана возможность селективного фосфорилирования по 4-, 5- или 4,5-ОН-группам, 9- или 10-CO-группам. Получены димерные структуры с фосфорсодержащими фрагментами, изоцианаты, алкилдитиофосфонаты, бисфосфиты и др. фосфорсодержащие производные.
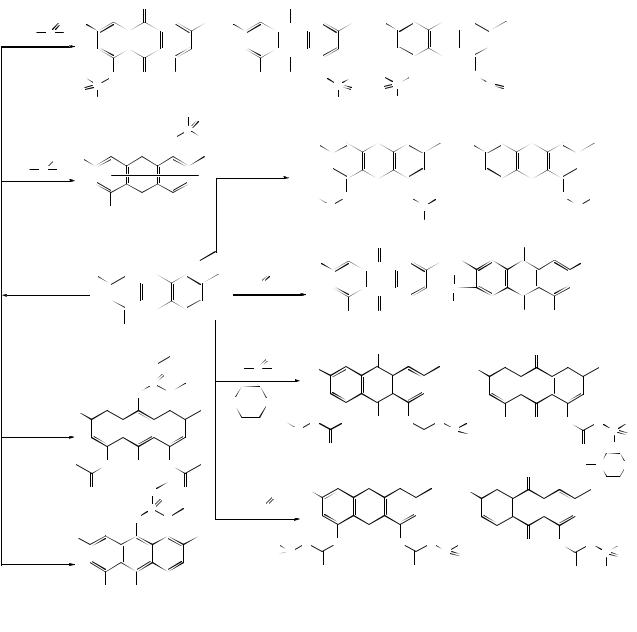
Конденсацией галогензамещенных оксиантрахинонов в присутствии цинковой пыли или натрия, а также хризофанола, эмодина, фисциона с соответствующими бромидами получены асфоделин, кассианин, гиперицин, сиамеанин и др. димерные структуры:
525
*При окислении эмодина К3Fe(CN)6 в соотношении 1:4 получен 5,7’- бисэмодинил и скирин. 1,3,8-Триоксиантрахинон или эмодиновая кислота в присутствии третичного бутанола и гидрохинона в течение трех недель в атмосфере азота димеризуются по типу протогиперицина, гиперицина или с образованием структуры диантрона или диантронола.
*Появлению дополнительных С-С связей способствует процесс
фотодегидрирования. Так антронол-9 при УФ-свете в атмосфере азота превращается в 10,10’-димер антрона-9.
526
* При наличии подвижного водорода ОН-, NH2-групп или галогена возможна димеризация с отщеплением H2O или ННal.
К реакциям окисления относятся процессы гидроксилирования, например, при взаимодействии ализарина (1,2-диоксиантрахинона) с MnO2 в концентрированной H2SO4 или мышьяковой кислоте получают пурпурин, (1,2,4-триоксиантрахинон); взаимодействием с SO3 (70-80%) можно получить три-, тетра-, гексаоксиантрахиноны; действием H3BO3 в 80% олеуме из 1,8- диоксиантрахинона получен 1,4,8-триоксиантрахинон, из ализарина – 1,2,5,8- тетраоксиантрахинон; в концентрированной H2SO4 при температурах 200-3000 в присутствии H3BO3 , озоно-кислородной смесью в H2SO4, концентрированной H2SO4 при облучении h , сульфитами и нитратами в щелочной среде происходит дополнительное гидроксилирование структур в орто- и параположения к донорным заместителям.
При окислении эмодина персульфатом калия в концентрированной H2SO4 при комнатной температуре с 20% выходом образуется антрагаллол.
Иногда в процессе окисления в качестве промежуточных соединений образуются дихиноны.
Так, при окислении ализарина тетраацетатом свинца получен 1,2,9,10антрадихинон, ранее известный только в растворах.
* Образование диантронов и расщепление до бензойной кислоты отмечено при щелочном плавлении в безводной среде, при нагревании с трет.- бутоксидом калия, при окислении смесью 5% NaOH и 10% KМnO4 и др. Отмечено, что все замещенные антрахинона расщепляются по четырем направлениям с преимущественным выходом двух продуктов, причем α- замещенные антрахиноны расщепляются при более низких температурах по сравнению с аналогичными β-замещенными:
Реакции окисления можно использовать для доказательства структуры антрахинонов и как метод синтеза новых соединений. Так, при электрохимическом окислении хризофанола получен алое-эмодин, 4,5- диокси-9,10-антрахинон-2-альдегид и реин (CH3 CH2OH С(О)Н COOH).
Показано, что не только природа окислителя, но и условия реакции определяют направление процесса. Так, трет-бутоксид, в зависимости от условий, может способствовать реакции гидроксилирования, конденсации или расщепления. Такие результаты реакции окисления, как увеличение числа ОН-
527
групп и молекулярной массы, могут привести к созданию новых биологически активных препаратов.
Восстановление оксиантрахинонов может быть химическим, электро-
химическим, направленным на восстановление непредельных связей ароматической системы, С=О групп и заместителей.
Известно, что антроны обладают антипсориатической активностью; возможность перехода антрахинон антронол имеет значение в процессах дыхания, деления клеток, окислительного фосфорилирования, образования комплексов с ДНК и РНК и т.д.
Показана возможность получения формы антронола при каталитическом восстановлении оксиантрахинонов водородом на катализаторе. Восстановление фисциона до формы антронола возможно цинковой пылью в растворе CH3COOH. Обе таутомерные формы антрона-антронола образуются для эмодина, фисциона и хризофанола при восстановлении их SnCI2 в смеси ледяной CH3COOH и HCl и при каталитическом восстановлении производных антрахинона в присутствии металлов VIII группы. Причем отмечено, что восстановление в антроны α-замещенных протекает более региоспецифично, чем β-замещенных.
Подобраны условия каталитического восстановления хризофанола на четырех катализаторах в растворителях до форм антрона и антронола. Выявленные закономерности использованы при разработке способа получения антидерматического препарата.
Синтезы антрациклинов на основе природных оксиантрахинонов, например, дауномицина и его аналогов, а также гликозидов, синтез доксорубицина, даунорубицина и их агликонов описан на основе алое-эмодина; синтез предшественника аклавинона – на основе хризазина.
На основе хризофанола, франгула- и алое-эмодина, фисциона и их метоксипроизводных, разработана 4-5-стадийная схема получения антрациклинонов без заместителей в насыщенном кольце.
Используя оксиантрахиноновые молекулы можно сократить стадийность описанных реакций в синтезе антракциклинонов, которые, как и антрациклины, обладают противоопухолевой активностью.
Ниже приведена схема некоторых осуществленных реакции и виды активности полученных соединений.
528

529
Вопросы для самоконтроля студентов
1Укажите основные реакционные центры в молекулах антрахинонов.
2Опишите кислотно-основные свойства антрахиноновых молекул.
3Объясните особенности реакций галогенирования антрахинонов.
4Сравните условия и механизмы реакций сульфирования и сульфитирования антрахинонов.
5Найдите сходства и отличия в основных типах реакций аминирования оксиантрахинонов.
6Опишите реакции С- и N-алкилирования и их значение для медицины.
7Сравните возможности реакций азосочетания в промышленном синтезе антрахиноновых азокрасителей.
8Составьте схему основных типов реакций нуклеофильного обмена антрахиноновых молекул.
9На примерах объясните важность реакции димеризации антрахинонов.
10Составьте схему внутримолекулярных перегруппировок антрахинонов.
Идентификация производных антрахинона
Идентификация производных антрахинона возможна методами хрома-
тографии при сопоставлении со стандартными образцами и с литературными данными при условии аналогичности процесса хроматографирования.
Для определения количества и положения окси-групп получают ацетаты, лейкоацетаты, метиловые и метилсилиловые эфиры. Только β-оксигруппы легко метилируются диазометаном, хелатные α-оксигруппы обычно не взаимодействуют с ним, но они поддаются метилированию йодистым метилом с окисью серебра в хлороформе или диметилсульфатом с карбонатом калия в ацетоне. Одну окси-группу в 1,8-диоксиантрахиноне возможно прометилировать используя диазометан. Все окси-группы этерифицируют по реакции с уксусным ангидридом, а для избирательного ацетилирования β-оксигрупп используют уксусный ангидрид в присутствии боруксусного ангидрида с последующим гидролизом хелатных борных эфиров. Восстановительное ацетилирование используется при необходимости сравнения электронных спектров лейкоацетатов со спектрами исходных молекул.
Силилирование оксиантрахинонов проводят гексаметилдисилозаном и триметилхлорсиланом в сухом пиридине. При восстановительном силилировании добавляют еще цинковую пыль и используют в качестве растворителя вместо пиридина бензол или хлористый метилен.
Большинство выделенных хинонов можно идентифицировать без разрушения молекулы. Если лежащую в основе молекулы нового вещества полициклическую систему невозможно узнать, исходя из УФ-спектра лейкоацетата или другим путем, используют перегонку с цинковой пылью или сплавление с цинковой пылью для того, чтобы получить исходный углеводород.
530



