
- •Таврический национальный университет
- •Лекция № 1. Водород
- •Соединения водорода
- •Литература: [1] с. 330 - 338, [2] с. 411 - 415, [3] с. 262 - 270 Лекция № 2. Элементы VII-a-подгрупы (галогены)
- •Cоединения галогенов
- •Лекция № 3. Элементы via-подгруппы
- •3.1. Кислород
- •Соединения кислорода
- •2Hso4- - 2e- h2s2o8
- •Соединения серы
- •3.3. Подгруппа селена
- •Соединения селена и теллура
- •Литература: [1] с. 359 - 383, [2] с. 425 - 435, [3] с. 297 - 328 Лекция № 4. Элементы va-подгруппы
- •Соединения азота
- •4.2. Фосфор
- •Соединения фосфора
- •4.3. Элементы подгруппы мышьяка
- •Соединения мышьяка, сурьмы и висмута
- •Литература: [1] с. 383 - 417, [2] с. 435 - 453, [3] с. 328 - 371 Лекция № 5. Элементы iva-подгруппы
- •5.1. Углерод
- •Соединения углерода
- •5.2. Кремний
- •Соединения кремния
- •5.3. Германий, олово, свинец
- •Соединения германия
- •Соединения олова
- •Соединения свинца
- •Литература: [1] с. 417 - 435, 491 - 513, [2] с. 453 - 472, [3] с. 371 - 409 Лекция № 6. Элементы iiia-подгруппы
- •Соединения бора
- •6.2. Алюминий
- •Соединения алюминия
- •6.3. Подгруппа галлия
- •Соединения элементов подгруппы галлия
- •Литература: [1] с. 608 - 619, [2] с. 472 - 481, [3] с. 412 - 446 Лекция № 7. Элементы iia-подгруппы
- •7.1. Бериллий
- •Соединения бериллия
- •7.2. Магний
- •Соединения магния
- •7.3. Щелочноземельные металлы
- •Соединения щелочноземельных металлов
- •Литература: [1] с. 587 - 599, [2] с. 481 - 486, [3] с. 447 - 460
- •7.4. Элементы ia-подгруппы (щелочные металлы)
- •Соединения щелочных металлов
- •Литература: [1] с. 543 - 551, [2] с. 486 - 489, [3] с. 461 - 470 Лекция № 8. Общая характеристика d-элементов. Элементы iiiв - vb подгрупп (подгруппы скандия,титана и ванадия)
- •8.1. Общая характеристика d-элементов
- •8.2. Элементы iiiв подгруппы (подгруппа скандия)
- •Соединения элементов подгруппы скандия
- •8.3. Элементы ivв подгруппы (подгруппа титана)
- •Соединения титана, циркония и гафния
- •8.4. Элементы vв подгруппы (подгруппа ванадия)
- •Соединения ванадия, ниобия и тантала
- •Литература: [1] с. 619 - 633, [2] с. 489 - 523, [3] с. 478 - 481, 499 - 520 Лекция № 9. Элементы viв- и viiв-подгрупп
- •9.1 Элементы viв-подгруппы (подгруппа хрома)
- •Соединения хрома, молибдена и вольфрама
- •9.2. Элементы viiв-подгруппы (подгруппа марганца)
- •Соединения маргнаца, технеция и рения
- •Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548 Лекция № 10. Элементы viiib-подгруппы
- •10.1. Элементы триады железа
- •Соединения железа
- •Соединения кобальта
- •Соединения никеля
- •Литература: [1] с. 650 - 679, [2] с. 540 - 550, [3] с. 548 - 584
- •10.2. Платиновые металлы
- •Соединения рутения и осмия
- •Соединения родия и иридия
- •Соединения палладия и платины
- •Лекция № 11. Элементы ib- и iib-подгрупп
- •11.1 Элементы ib-подгруппы (подгруппы меди)
- •Соединения меди
- •Соединения серебра
- •Соединения золота
- •11.2. Элементы iib-подгруппы (подгруппа цинка)
- •Соединения цинка и кадмия
- •Соединения ртути
- •Литература: [1] с. 551 - 563, 599 - 608, [2] с. 550 - 554, [3] с. 585 - 602 Лекция № 12. Химия f-элементов
- •12.1. Лантаниды
- •Соединения лантанидов
- •12.2. Актиниды
- •Соединения актинидов
- •Лекция № 13. Инертные газы
- •13.1. Гелий. Неон. Аргон
- •13.2. Элементы подгруппы криптона
- •Соединения криптона, ксенона и радона
- •Список рекомендуемой литературы
- •Оглавление
Соединения никеля
Соединения со степенью окисления 0. Никель образует карбонил состава Ni(CO)4. В обычных условиях это бесцветная жидкость (т.кип. 43 С), разлагающаяся при 180 С. Легкость образования тетракарбонила используется для разделения никеля и кобальта. Карбонил никеля используется в органическом синтезе в качестве катализатора, а так же для получения металла высокой степени чистоты.
Это соединение диамагнитно, следовательно атомам металла можно приписать электронную конфигурацию 3d10:
|
|
|
d10 |
|
|
|
4s |
|
|
4p |
|
|
|
|
|
|
|
|
|
|
|
|
|
на -связи на -связи с СО
Металл за счет четырех вакантных sp3-орбиталей присоединяет 4 молекулы СО. Устойчивость связи повышается за счет -дативного взаимодействия, в котором принимают участие электронные пары металла и вакантные -разрыхляющие орбитали молекул СО.
Соединения со степенью окисления +2. Для соединений никеля наиболее характерна степень окисления +2. Никель образует основной оксид и гидроксид никеля(II) зеленого цвета, нерастворимые в воде. Оксид NiO получают термическим разложением гидроксида, карбоната или нитрата никеля. Гидроксид образуется при действии щелочей на растворы солей никеля(II)
Сульфид никеля черного цвета, нерастворим в воде, образуется осаждением сероводородом из растворов, растворяется в кислотах.
Никель образует галогениды, разнообразные соли, а так же многочисленные координационные соединения катионного и анионного типов. Наиболее характерные координационные числа – 4 и 6. Аквакомплекс [Ni(H2O)6]2+ имеет ярко-зеленую окраску, такая же окраска характерна для шестиводных кристаллогидратов Ni(NO3)2·6H2O, NiSO4·6H2O и др. Безводные соли - Ni(NO3)2, NiSO4, NiСl2, NiF2, Ni(CN)2 – обычно желтого цвета, NiI2 – черного цвета.
Аммиачный комплекс никеля [Ni(NH3)6]2+ синего цвета. За счет образования аммиакатов гидроксид никеля легко растворяется в присутствии аммиака. На образовании устойчивых аммиакатов основаны гидрометаллургические методы извлечения никеля из руд.
Ni(OH)2 + 6NH3 = [Ni(NH3)6](ОН)2
Из анионных координационных соединений наиболее известен желтый плоскоквадратный [Ni(CN)4]2-, который образуется в избытке основного цианида:
NiSO4 + 2KCN = Ni(CN)2 + K2SO4;
Ni(CN)2 + 2KCN = K2[Ni(CN)4]
Довольно легко образуются никеллаты типа М4+1[NiHal6], М4+1[Ni(SCN)6]. В водных растворах эти соединения распадаются.
Литература: [1] с. 650 - 679, [2] с. 540 - 550, [3] с. 548 - 584
10.2. Платиновые металлы
Рутений и осмий самостоятельных минералов практически не образуют, обычно сопутствуют платине и палладию в полиметаллических рудах. Родий и иридий чаще всего встречаются в виде сплавов с осмием и платиной. Палладий и платина, как и другие платиновые металлы, относятся к числу редких элементов. Платина встречается в самородном виде, палладий обычно сопутствует платине. Важным источником платины являются сульфидные медно-никелевые руды. Наиболее важные минералы: RuS2 - лаурит, PdO - палладит, (Pt,Pd,Ni)S –браггит, PtS – куперит.
Рутений, родий, иридий и платина - серебристо-белые металлы, осмий - металл голубовато-белого цвета, палладий имеет серый оттенок. Осмий самый тяжелый из металлов, очень твердый и поддается растиранию.
|
Свойства |
Ru |
Rh |
Pd |
Os |
Ir |
Pt |
|
К, мол.% |
1·10-7 |
2·10-7 |
2·10-7 |
5·10-7 |
9·10-9 |
5·10-8 |
|
Плотность, г/см3 |
12,37 |
12,41 |
12,02 |
22,61 |
22,5 |
21,46 |
|
Т.пл., С |
2250 |
1963 |
1554 |
3030 |
2447 |
1772 |
Рутений, родий и осмий применяются в основном в виде сплавов с платиной для изготовления термопар и электрических контактов. Область применения родия и иридия определяется их большой коррозионной устойчивостью и высокой твердостью. Металлический родий и его сплавы с платиной применяются в качестве катализатора и в ювелирной промышленности. Иридий также применяется в виде сплавов с платиной или осмием (эталоны длины, кислотостойкая химическая аппаратура и пр.).
Палладий и платина широко используются в химической промышленности как катализаторы разнообразных процессов. Кроме того платина применяется для изготовления химической посуды, термопар и электрических контактов. В ювелирном деле применяются сплавы палладия с платиной или золотом.
Химические свойства. Рутений и осмий химически инертны, в обычных условиях на них не действуют даже активные неметаллы. Типичные реакции с участием рутения показаны на схеме:

Осмии похож на рутений, но более активен при взаимодействии с кислородом. В мелкоизмельченном состоянии осмий окисляется кислородом и концентрированной азотной кислотой до летучего OsO4.
В компактном состоянии рутений и в меньшей степени осмий устойчивы по отношению к кислотам и их смесям, но разрушаются при сплавлении со щелочами в присутствии окислителей:
t
Ru + 3KClO + 2NaOH = Na2RuO4 + 3KCl + H2O
Родий и особенно иридий отличаются высокой химической инертностью. Родий окисляется кислородом при температуре 600 С, а иридий - выше 1000 С.

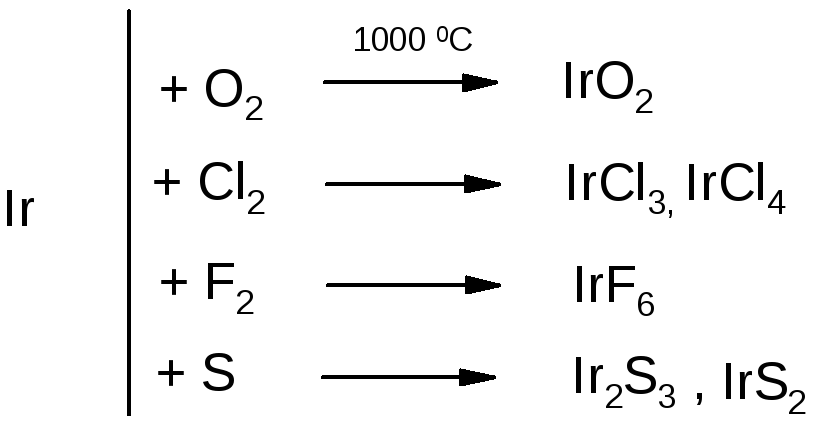
Компактные родий и иридий практически не растворяются ни в одной из кислот или их смесей. Для перевода этих металлов в растворимые соединения их хлорируют в мелкодисперсном состоянии при температуре красного каления и в присутствии NaCl. Например:
Ir + 2Cl2 + 2NaCl = Na2[IrCl6]
Иридий и родий реагируют при сплавлении с щелочами в присутствии окислителей:
Rh + 3KNO3 + 2КOH = K2RhO4 + 3КNO2 + H2O
По сравнению с другими платиновыми металлами палладий и платина более реакционноспособны. Однако в реакции они вступают в мелкодисперсном состоянии и при очень высокой температуре. Образующиеся при этом соединения нестойки и при дальнейшем нагревании разлагаются. Палладий отличается способностью растворять большое количество водорода (при 90 С 1 объем Pd поглощает 900 объемов водорода). Для платины характерно поглощение кислорода. Типичные реакции с участием металлов показаны на схеме:
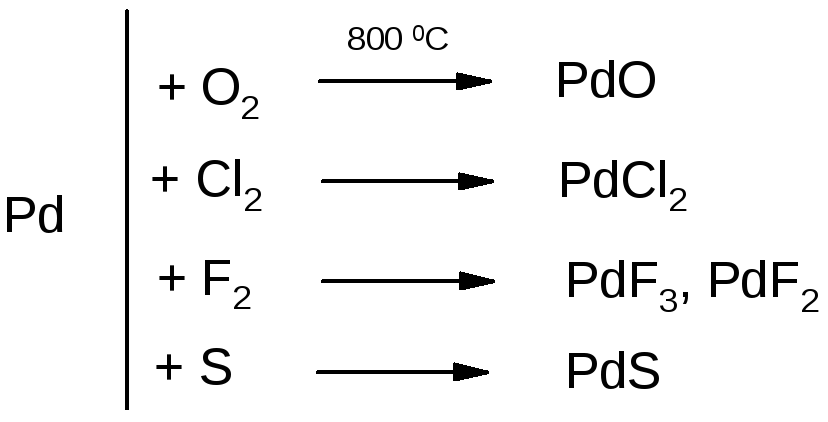

Палладий довольно легко растворяется в концентрированных азотной и горячей серной кислотах. Платина растворяется только в царской водке при нагревании.
Pd + 4HNO3 = Pd(NO3)2 + 2NO2 + 2H2O;
t
Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
При сплавлении с щелочами, цианидами и сульфидами щелочных металлов в присутствии окислителей палладий и платина переходят в соответствующие анионные комплексы. Например:
Pt + 4КСN + 2H2О = К2[Pt(CN)6] + 2KOH + H2
