
- •Таврический национальный университет
- •Лекция № 1. Водород
- •Соединения водорода
- •Литература: [1] с. 330 - 338, [2] с. 411 - 415, [3] с. 262 - 270 Лекция № 2. Элементы VII-a-подгрупы (галогены)
- •Cоединения галогенов
- •Лекция № 3. Элементы via-подгруппы
- •3.1. Кислород
- •Соединения кислорода
- •2Hso4- - 2e- h2s2o8
- •Соединения серы
- •3.3. Подгруппа селена
- •Соединения селена и теллура
- •Литература: [1] с. 359 - 383, [2] с. 425 - 435, [3] с. 297 - 328 Лекция № 4. Элементы va-подгруппы
- •Соединения азота
- •4.2. Фосфор
- •Соединения фосфора
- •4.3. Элементы подгруппы мышьяка
- •Соединения мышьяка, сурьмы и висмута
- •Литература: [1] с. 383 - 417, [2] с. 435 - 453, [3] с. 328 - 371 Лекция № 5. Элементы iva-подгруппы
- •5.1. Углерод
- •Соединения углерода
- •5.2. Кремний
- •Соединения кремния
- •5.3. Германий, олово, свинец
- •Соединения германия
- •Соединения олова
- •Соединения свинца
- •Литература: [1] с. 417 - 435, 491 - 513, [2] с. 453 - 472, [3] с. 371 - 409 Лекция № 6. Элементы iiia-подгруппы
- •Соединения бора
- •6.2. Алюминий
- •Соединения алюминия
- •6.3. Подгруппа галлия
- •Соединения элементов подгруппы галлия
- •Литература: [1] с. 608 - 619, [2] с. 472 - 481, [3] с. 412 - 446 Лекция № 7. Элементы iia-подгруппы
- •7.1. Бериллий
- •Соединения бериллия
- •7.2. Магний
- •Соединения магния
- •7.3. Щелочноземельные металлы
- •Соединения щелочноземельных металлов
- •Литература: [1] с. 587 - 599, [2] с. 481 - 486, [3] с. 447 - 460
- •7.4. Элементы ia-подгруппы (щелочные металлы)
- •Соединения щелочных металлов
- •Литература: [1] с. 543 - 551, [2] с. 486 - 489, [3] с. 461 - 470 Лекция № 8. Общая характеристика d-элементов. Элементы iiiв - vb подгрупп (подгруппы скандия,титана и ванадия)
- •8.1. Общая характеристика d-элементов
- •8.2. Элементы iiiв подгруппы (подгруппа скандия)
- •Соединения элементов подгруппы скандия
- •8.3. Элементы ivв подгруппы (подгруппа титана)
- •Соединения титана, циркония и гафния
- •8.4. Элементы vв подгруппы (подгруппа ванадия)
- •Соединения ванадия, ниобия и тантала
- •Литература: [1] с. 619 - 633, [2] с. 489 - 523, [3] с. 478 - 481, 499 - 520 Лекция № 9. Элементы viв- и viiв-подгрупп
- •9.1 Элементы viв-подгруппы (подгруппа хрома)
- •Соединения хрома, молибдена и вольфрама
- •9.2. Элементы viiв-подгруппы (подгруппа марганца)
- •Соединения маргнаца, технеция и рения
- •Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548 Лекция № 10. Элементы viiib-подгруппы
- •10.1. Элементы триады железа
- •Соединения железа
- •Соединения кобальта
- •Соединения никеля
- •Литература: [1] с. 650 - 679, [2] с. 540 - 550, [3] с. 548 - 584
- •10.2. Платиновые металлы
- •Соединения рутения и осмия
- •Соединения родия и иридия
- •Соединения палладия и платины
- •Лекция № 11. Элементы ib- и iib-подгрупп
- •11.1 Элементы ib-подгруппы (подгруппы меди)
- •Соединения меди
- •Соединения серебра
- •Соединения золота
- •11.2. Элементы iib-подгруппы (подгруппа цинка)
- •Соединения цинка и кадмия
- •Соединения ртути
- •Литература: [1] с. 551 - 563, 599 - 608, [2] с. 550 - 554, [3] с. 585 - 602 Лекция № 12. Химия f-элементов
- •12.1. Лантаниды
- •Соединения лантанидов
- •12.2. Актиниды
- •Соединения актинидов
- •Лекция № 13. Инертные газы
- •13.1. Гелий. Неон. Аргон
- •13.2. Элементы подгруппы криптона
- •Соединения криптона, ксенона и радона
- •Список рекомендуемой литературы
- •Оглавление
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
Таврический национальный университет
им. В.И. ВЕРНАДСКОГО
Э.А. ГЮННЕР, В.Ф. ШУЛЬГИН, Н.С. ПЕВЗНЕР
ЛЕКЦИИ ПО ХИМИИ
ЭЛЕМЕНТОВ
учебное пособие
для студентов химических специальностей
Симферополь - 2010
Учебное пособие издается по решению научно-методического совета
Таврического национального университета им. В.И. Вернадского от _ _ 2010г.
Рекомендовано методической комиссией химического факультета Таврического
национального университета им. В.И. Вернадского
Рецензент: профессор, доктор химических наук, А.М. Федоренко
Э.А. Гюннер, В.Ф. Шульгин, Н.С. Певзнер. Лекции по химии элементов / Учебное пособие для студентов химических специальностей. Симферополь: Таврический национальный университет им. В.И. Вернадского, 2010. - 94 с.; ил.
© Э.А. Гюннер, В.Ф. Шульгин, Н.С. Певзнер, 2010
Лекция № 1. Водород
Водород расположен в первом периоде периодической системы химических элементов (элемент № 1). Атом водорода содержит на внешнем энергетическом уровне один электрон (1s1) и является электронным аналогом щелочных металлов. В то же время, до завершения валентного уровня атому водорода недостает одного электрона, что роднит его с галогенами. По этой причине водород часто помещают как в первую, так и в седьмую группу периодической системы.
Водород представлен в природе тремя изотопами: протий 1H, дейтерий 2H (D), тритий 3H (T). Протий и дейтерий стабильные изотопы (содержание дейтерия в природном водороде составляет 0,015%). Тритий радиоактивен (период полураспада 12,26 года), образуется в верхних слоях атмосферы под действием космических лучей и содержится в природном водороде в исчезающе малом количестве. Водород, наряду с гелием, самый распространенный элемент Вселенной, он составляет до половины массы звезд и основную массу межзвездной материи. Содержание водорода в земной коре (кларк) составляет 3 мол.%. Водород - элемент-органоген и входит в состав органических соединений.
Простое вещество водород - H2 - бесцветный газ, не имеющий вкуса и запаха, не обладающий физиологическим действием, т.пл. -259,2 С (14 К), т.кип. -252,8 С (20 К). Водород - самый легкий из газов (в 14,5 раз легче воздуха), с высокой скоростью диффузии, легко проникающий через разнообразные перегородки. Плохо растворим в воде, но хорошо растворим в некоторых металлах (Ni, Pt, Pd).
Получение водорода. В промышленности водород получают конверсией метана или угля водяным паром, а также неполным окислением метана:
t t
CH4 + H2O = CO + 3H2; C + H2O = CO + H2;
t
2CH4 + O2 = 2CO + 4H2
Лабораторные методы получения водорода:
1. Действие кислот на металлы (обычно действуют на цинк соляной кислотой в аппарате Киппа).
Zn + 2HCl = ZnCl2 + H2
2. Действие щелочей на алюминий.
2Al + 6KOH + 6H2O = 2K3[Al(OH)6] + 3H2
3. Электролиз водных растворов щелочей на никелевых электродах.
эл.ток
2H2O = 2H2 + O2
4. Взаимодействие гидрида кальция с водой.
CaH2 + 2H2O = Ca(OH)2 + 2H2
Химические свойства. Особенности строения электронной оболочки атома водорода обуславливают его способность к присоединению одного электрона. Поэтому водород может выступать как окислитель, образуя соединения в степени окисления -1. В то же время невысокая электроотрицательность водорода (2,2 по Л. Полингу) способствует потере одного электрона и образованию соединений в степени окисления +1.
+e- -e-
H- H H+
Довольно высокая энергия диссоциации молекулы Н2 (435 кДж/моль) обуславливает инертность водорода в обычных условиях. При комнатной температуре водород реагирует только со фтором:
H2 + F2 = 2HF
При нагревании водород реагирует со многими неметаллами (Cl2, Br2, O2, N2, S, C), проявляя при этом свойства восстановителя. Взаимодействие с хлором и кислородом инициируется ультрафиолетовым облучением и протекает по радикальному механизму. При этом реакция с хлором протекает по неразветвленному цепному механизму и включает ряд стадий:
1. Инициация цепи
(фотохимическая диссоциация): Cl2 + h 2Cl·
2. Рост (развитие) цепи: Cl· + H2 HCl + ·H;
H· + Cl2 HCl + ·Cl
3. Обрыв цепи: H· + ·Cl HCl
Реакция водорода с кислородом идет по механизму цепной разветвленной реакции, включая следующие стадии:
1. Инициация цепи: H2 + O2 ·OH + HO·
2. Рост цепи: HO· + H2 H2O + H·
3. Разветвление цепи: H· + O2 ·OH + ·O·;
·O· + H2 ·OH + ·H
4. Обрыв цепи: HO· + ·H H2O
При нагревании водород реагирует со щелочными и щелочноземельными металлами, образуя соответствующие гидриды - бинарные соединения водорода в степени окисления -1.
t
2Na + H2 = 2NaH-1
гидрид натрия
При повышенных температурах водород восстанавливает металлы из их оксидов и галогенидов:
t t
CuO + H2 = Cu + H2O; CuCl2 + H2 = Cu + 2HCl
Восстановительные свойства водород способен проявлять также и по отношению к оксидам неметаллов и органическим соединениям, например,
t
N2O + H2 = N2 + H2O
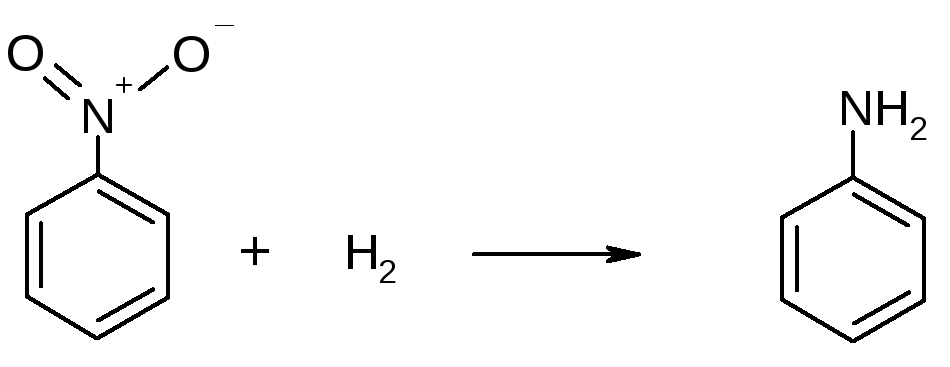
нитробензол анилин
Большое значение для синтеза органических соединений имеет реакция каталитического присоединения водорода по кратным связям углерод - углерод (гидрогенизация или гидрирование):
t
C2H4 + H2 C2H6
Pd
