- •Таврический национальный университет
- •Лекция № 1. Водород
- •Соединения водорода
- •Литература: [1] с. 330 - 338, [2] с. 411 - 415, [3] с. 262 - 270 Лекция № 2. Элементы VII-a-подгрупы (галогены)
- •Cоединения галогенов
- •Лекция № 3. Элементы via-подгруппы
- •3.1. Кислород
- •Соединения кислорода
- •2Hso4- - 2e- h2s2o8
- •Соединения серы
- •3.3. Подгруппа селена
- •Соединения селена и теллура
- •Литература: [1] с. 359 - 383, [2] с. 425 - 435, [3] с. 297 - 328 Лекция № 4. Элементы va-подгруппы
- •Соединения азота
- •4.2. Фосфор
- •Соединения фосфора
- •4.3. Элементы подгруппы мышьяка
- •Соединения мышьяка, сурьмы и висмута
- •Литература: [1] с. 383 - 417, [2] с. 435 - 453, [3] с. 328 - 371 Лекция № 5. Элементы iva-подгруппы
- •5.1. Углерод
- •Соединения углерода
- •5.2. Кремний
- •Соединения кремния
- •5.3. Германий, олово, свинец
- •Соединения германия
- •Соединения олова
- •Соединения свинца
- •Литература: [1] с. 417 - 435, 491 - 513, [2] с. 453 - 472, [3] с. 371 - 409 Лекция № 6. Элементы iiia-подгруппы
- •Соединения бора
- •6.2. Алюминий
- •Соединения алюминия
- •6.3. Подгруппа галлия
- •Соединения элементов подгруппы галлия
- •Литература: [1] с. 608 - 619, [2] с. 472 - 481, [3] с. 412 - 446 Лекция № 7. Элементы iia-подгруппы
- •7.1. Бериллий
- •Соединения бериллия
- •7.2. Магний
- •Соединения магния
- •7.3. Щелочноземельные металлы
- •Соединения щелочноземельных металлов
- •Литература: [1] с. 587 - 599, [2] с. 481 - 486, [3] с. 447 - 460
- •7.4. Элементы ia-подгруппы (щелочные металлы)
- •Соединения щелочных металлов
- •Литература: [1] с. 543 - 551, [2] с. 486 - 489, [3] с. 461 - 470 Лекция № 8. Общая характеристика d-элементов. Элементы iiiв - vb подгрупп (подгруппы скандия,титана и ванадия)
- •8.1. Общая характеристика d-элементов
- •8.2. Элементы iiiв подгруппы (подгруппа скандия)
- •Соединения элементов подгруппы скандия
- •8.3. Элементы ivв подгруппы (подгруппа титана)
- •Соединения титана, циркония и гафния
- •8.4. Элементы vв подгруппы (подгруппа ванадия)
- •Соединения ванадия, ниобия и тантала
- •Литература: [1] с. 619 - 633, [2] с. 489 - 523, [3] с. 478 - 481, 499 - 520 Лекция № 9. Элементы viв- и viiв-подгрупп
- •9.1 Элементы viв-подгруппы (подгруппа хрома)
- •Соединения хрома, молибдена и вольфрама
- •9.2. Элементы viiв-подгруппы (подгруппа марганца)
- •Соединения маргнаца, технеция и рения
- •Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548 Лекция № 10. Элементы viiib-подгруппы
- •10.1. Элементы триады железа
- •Соединения железа
- •Соединения кобальта
- •Соединения никеля
- •Литература: [1] с. 650 - 679, [2] с. 540 - 550, [3] с. 548 - 584
- •10.2. Платиновые металлы
- •Соединения рутения и осмия
- •Соединения родия и иридия
- •Соединения палладия и платины
- •Лекция № 11. Элементы ib- и iib-подгрупп
- •11.1 Элементы ib-подгруппы (подгруппы меди)
- •Соединения меди
- •Соединения серебра
- •Соединения золота
- •11.2. Элементы iib-подгруппы (подгруппа цинка)
- •Соединения цинка и кадмия
- •Соединения ртути
- •Литература: [1] с. 551 - 563, 599 - 608, [2] с. 550 - 554, [3] с. 585 - 602 Лекция № 12. Химия f-элементов
- •12.1. Лантаниды
- •Соединения лантанидов
- •12.2. Актиниды
- •Соединения актинидов
- •Лекция № 13. Инертные газы
- •13.1. Гелий. Неон. Аргон
- •13.2. Элементы подгруппы криптона
- •Соединения криптона, ксенона и радона
- •Список рекомендуемой литературы
- •Оглавление
Соединения хрома, молибдена и вольфрама
Элементы подгруппы хрома способны проявлять все степени окисления от 0 до +6. Для молибдена и вольфрама характерны соединения в степени окисления +6, для хрома наиболее устойчивы степени окисления +3 и +6.
Соединения со степенью окисления 0. Нулевая степень окисления у d-элементов проявляется в координационных соединениях с такими лигандами, как молекулы СО. Для хрома и его аналогов известны гексакарбонилы - Э(СО)6. Это бесцветные, легко возгоняющиеся твердые вещества (т.пл. 150 – 170 ºС), их молекулы диамагнитны, имеют геометрию октаэдра с атомом металла в центре.
Атому хрома в координационном соединении можно приписать электронную конфигурацию d6, причем все шесть электронов спарены.
|
|
|
3d6 |
|
|
|
4s |
|
|
4p |
|
|
|
|
|
|
|
|
|
|
|
|
|
на -связи с молекулами СО
на -связи
Координационные связи () образуются за счет перекрывания вакантных гибридных орбиталей центрального атома (d2sp3-гибридизация) с занятой молекулярной орбиталью молекулы лиганда. -Дативная связь образуется при перекрывании вакантной -разрыхляющей молекулярной орбитали оксида углерода(II) и заполненной d-орбитали центрального атома.
Схема образования и -дативной связей в карбонилах

Соединения со степенью окисления +2 и +3. В степени окисления +2 хром образует основной оксид – CrO (черного цвета), соответствующий ему гидроксид - Cr(OH)2 (желтого цвета) и соли.
Соединения хрома(II) получают восстановлением соединений со степенью окисления +3, например, атомарным водородом в кислых растворах:
Cr+3 + ·H = Cr+2 + H+
Бинарные соединения хрома(II) проявляют основные свойства. Например, гидроксид хрома взаимодействует только с кислотами, образующиеся при этом растворы солей окрашены в синий цвет:
Сr(OH)2 + 2H+ + 4H2O = [Cr(H2O)6]2+
Галогениды хрома(II) легко поглощают аммиак, образуя аммиакаты состава [Cr(NH3)6]2+.
Все соединения хрома(II) - сильные восстановители, катион хрома(II) окисляется даже водой:
2CrCl2 + 2H2O = 2Cr(OH)Cl2 + H2
Степень окисления +3 для хрома наиболее устойчива и реализуется в оксиде - Cr2O3, гидроксиде - Cr(OH)3 и солях хрома(III). Оксид хрома(III) - темно-зеленый мелкокристаллический порошок, химически очень инертен. При сплавлении проявляет свойства амфотерного оксида:
t
Cr2O3 + 3K2S2O7 = Cr2(SO4)3 + 3K2SO4;
t
Cr2O3 + 2KOH = 2KCrO2 + H2O
хромит калия
Гидроксид хрома(III) осаждается щелочами из водных растворов солей хрома(III) и представляет собой аморфное вещество серо-синего цвета, имеющее переменный состав Cr2O3nH2O. Свежеосажденный гидроксид легко растворяется в растворах кислот и щелочей:
+ H+ + OH-
[Cr(H2O)6]3+ Cr(OH)3 [Cr(OH)6]3-
Соли Cr+3 окрашены в изумрудно-зеленый цвет, выделяются из растворов в виде кристаллогидратов с большим содержанием воды: CrCl36H2O, Cr2(SO4)312H2O, K2SO4Cr2(SO4)324H2O. Сульфат хрома и хромокалиевые квасцы широко применяются при выделке кож. Безводные соли хрома(III) имеют полимерное строение и в воде нерастворимы.
Анионные комплексы для хрома(III) весьма разнообразны, координационное число центрального атома в них обычно равно 6.
Сr(OH)3 + 3КОН = К3[Cr(ОH)6]; СrСl3 + 3КCl = К3[CrCl6];
зеленый красно-розовый
Сr2(SO4)3 + 3H2SO4 = 2H3[Cr(SО4)3]
желтый
Кластерные соединения. Для d-элементов характерны соединения, в которых содержатся группировки из двух и более атомов металла, связанных друг с другом. Такие соединения называются кластерами (с англ. cluster – гроздь, рой).
Первым кластером, строение которого достоверно установлено, был ацетат хрома(II), димерная структура которого выявлена еще в 1953 году. Ацетат-анионы в структуре данного соединения выполняют бидентатно-мостиковую функцию, атомы хрома связаны четырехкратной связью друг с другом.

К двухядерным кластерам относятся соединения молибдена(II) [Мо2Cl8]4-, хрома(III) [Cr2Cl9]3- и вольфрама(III) [W2Cl9]3-. В отличие от кластерного галогенида хрома в соединениях молибдена и вольфрама осуществляется связь металл-металл:
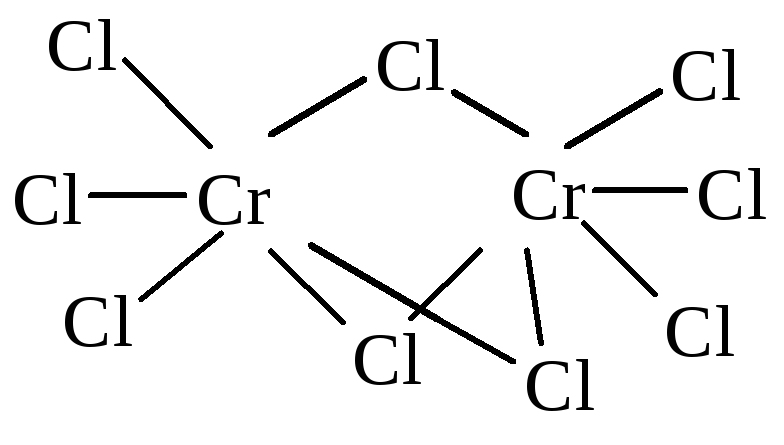

Примерами шестиядерных кластеров являются хлориды молибдена(II) и вольфрама(II) состава [Э6Cl8]Cl4. Аналогичное строение имеют бромиды вольфрама и молибдена.
Соединения со степенью окисления +6. Степень окисления +6 реализуется в галогенидах, оксогалогенидах, оксидах хрома, молибдена и вольфрама, а также в некоторых анионных комплексах. В ряду соединений Cr(VI) – Mo(VI) – W(VI) устойчивость заметно повышается.
Оксиды - кристаллические вещества: CrO3 - красного цвета, MoO3 - белый, WO3 - желтый. Оксид хрома(VI) выпадает из раствора дихромата калия при его подкислении концентрированной серной кислотой:
К2Cr2O7 + H2SO4 = 2CrO3 + K2SO4 + H2O
Оксид хрома(VI) ядовит, хорошо растворяется в воде, образуя хромовую кислоту:
CrO3 + H2O = H2CrO4
Оксиды молибдена и вольфрама получают прямым синтезом, они нерастворимы в воде, реагируют с щелочами, образуя соли:
ЭO3 + 2KOH = K2ЭO4 + H2O
Соли - молибдаты и вольфраматы бесцветны, хроматы окрашены в желтый цвет. При подкислении раствора хроматы переходят в дихроматы и далее в полихроматы. Переход обратим и при подщелачивании раствора вновь образуются хроматы:
CrO42- + 2H+ = Cr2O72- + H2O; Cr2O72- + 2OH- = 2CrO42- + H2O
Все хроматы содержат анионы, образованные тетраэдрами CrO42-, соединенными в цепь. Строение дихромат-аниона показано ниже:
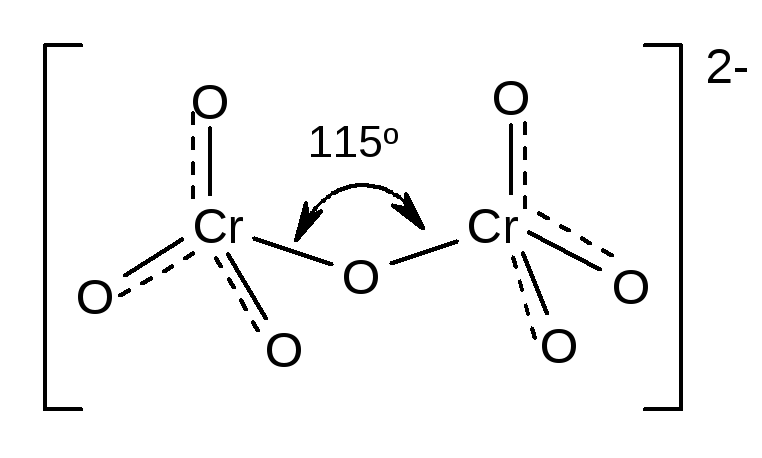
Соединения молибдена(VI) и вольфрама (VI) явно выраженными окислительными свойствами не обладают. Хроматы и дихроматы - сильные окислители, восстанавливаются до соединений хрома(III):
K2Cr2O7 + 3NaNO2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3NaNO3 + 4H2O;
K2Cr2O7 + 3NaNO2 + 4H2O = 2Cr(OH)3 + 2KOH + 3NaNO3;
2K2CrO4 + 3NaNO2 + 2KOH + 5H2O = 2K3[Cr(OH)6] + 3NaNO3
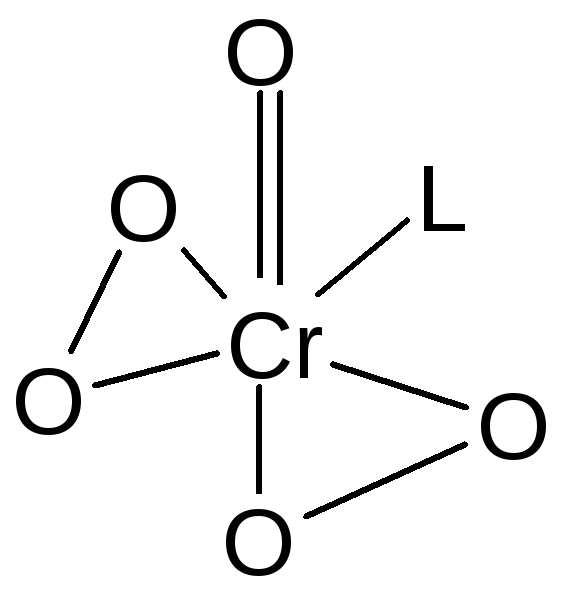
Для хрома(VI) известны пероксокомплексы, например, соединение голубого цвета CrO(O2)2L, где L – молекулы воды или эфира. Координационное соединение образуется при обработке кислого раствора дихромата калия перекисью водорода:
K2Cr2O7 + 4Н2О2 + H2SO4 + L = 2CrO2(O2)2L + K2SO4 + 5H2O
Координационный полиэдр соединения имеет геометрию пентагональной пирамиды: в основании пирамиды расположены атомы кислорода пероксид-ионов и лиганд L, в вершине – атом кислорода: