
- •Таврический национальный университет
- •Лекция № 1. Водород
- •Соединения водорода
- •Литература: [1] с. 330 - 338, [2] с. 411 - 415, [3] с. 262 - 270 Лекция № 2. Элементы VII-a-подгрупы (галогены)
- •Cоединения галогенов
- •Лекция № 3. Элементы via-подгруппы
- •3.1. Кислород
- •Соединения кислорода
- •2Hso4- - 2e- h2s2o8
- •Соединения серы
- •3.3. Подгруппа селена
- •Соединения селена и теллура
- •Литература: [1] с. 359 - 383, [2] с. 425 - 435, [3] с. 297 - 328 Лекция № 4. Элементы va-подгруппы
- •Соединения азота
- •4.2. Фосфор
- •Соединения фосфора
- •4.3. Элементы подгруппы мышьяка
- •Соединения мышьяка, сурьмы и висмута
- •Литература: [1] с. 383 - 417, [2] с. 435 - 453, [3] с. 328 - 371 Лекция № 5. Элементы iva-подгруппы
- •5.1. Углерод
- •Соединения углерода
- •5.2. Кремний
- •Соединения кремния
- •5.3. Германий, олово, свинец
- •Соединения германия
- •Соединения олова
- •Соединения свинца
- •Литература: [1] с. 417 - 435, 491 - 513, [2] с. 453 - 472, [3] с. 371 - 409 Лекция № 6. Элементы iiia-подгруппы
- •Соединения бора
- •6.2. Алюминий
- •Соединения алюминия
- •6.3. Подгруппа галлия
- •Соединения элементов подгруппы галлия
- •Литература: [1] с. 608 - 619, [2] с. 472 - 481, [3] с. 412 - 446 Лекция № 7. Элементы iia-подгруппы
- •7.1. Бериллий
- •Соединения бериллия
- •7.2. Магний
- •Соединения магния
- •7.3. Щелочноземельные металлы
- •Соединения щелочноземельных металлов
- •Литература: [1] с. 587 - 599, [2] с. 481 - 486, [3] с. 447 - 460
- •7.4. Элементы ia-подгруппы (щелочные металлы)
- •Соединения щелочных металлов
- •Литература: [1] с. 543 - 551, [2] с. 486 - 489, [3] с. 461 - 470 Лекция № 8. Общая характеристика d-элементов. Элементы iiiв - vb подгрупп (подгруппы скандия,титана и ванадия)
- •8.1. Общая характеристика d-элементов
- •8.2. Элементы iiiв подгруппы (подгруппа скандия)
- •Соединения элементов подгруппы скандия
- •8.3. Элементы ivв подгруппы (подгруппа титана)
- •Соединения титана, циркония и гафния
- •8.4. Элементы vв подгруппы (подгруппа ванадия)
- •Соединения ванадия, ниобия и тантала
- •Литература: [1] с. 619 - 633, [2] с. 489 - 523, [3] с. 478 - 481, 499 - 520 Лекция № 9. Элементы viв- и viiв-подгрупп
- •9.1 Элементы viв-подгруппы (подгруппа хрома)
- •Соединения хрома, молибдена и вольфрама
- •9.2. Элементы viiв-подгруппы (подгруппа марганца)
- •Соединения маргнаца, технеция и рения
- •Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548 Лекция № 10. Элементы viiib-подгруппы
- •10.1. Элементы триады железа
- •Соединения железа
- •Соединения кобальта
- •Соединения никеля
- •Литература: [1] с. 650 - 679, [2] с. 540 - 550, [3] с. 548 - 584
- •10.2. Платиновые металлы
- •Соединения рутения и осмия
- •Соединения родия и иридия
- •Соединения палладия и платины
- •Лекция № 11. Элементы ib- и iib-подгрупп
- •11.1 Элементы ib-подгруппы (подгруппы меди)
- •Соединения меди
- •Соединения серебра
- •Соединения золота
- •11.2. Элементы iib-подгруппы (подгруппа цинка)
- •Соединения цинка и кадмия
- •Соединения ртути
- •Литература: [1] с. 551 - 563, 599 - 608, [2] с. 550 - 554, [3] с. 585 - 602 Лекция № 12. Химия f-элементов
- •12.1. Лантаниды
- •Соединения лантанидов
- •12.2. Актиниды
- •Соединения актинидов
- •Лекция № 13. Инертные газы
- •13.1. Гелий. Неон. Аргон
- •13.2. Элементы подгруппы криптона
- •Соединения криптона, ксенона и радона
- •Список рекомендуемой литературы
- •Оглавление
Соединения железа
Соединения со степенью окисления 0. Железо способно образовывать соединения только за счет донорно-акцепторного взаимодействия. Так, нагреванием порошка железа в атмосфере оксида углерода(II) при 150 –200 ºС и давлении 1·107 - 2·107 Па образуется пентакарбонил железа – желтая летучая жидкость, нерастворимая в воде:
Fe + 5CO = [Fe(CO)5]
Молекула пентакарбонила имеет геометрию тригональной бипирамиды, что соответствует dsp3-гибридизации орбиталей центрального атома:
|
|
|
3d8 |
|
|
|
4s |
|
|
4p |
|
|
|
|
|
|
|
|
|
|
|
|
|
на -связи Fe-CO
на -связи Fe-CO
Получены карбонилы более сложного строения, например, [Fe2(CO)9]:
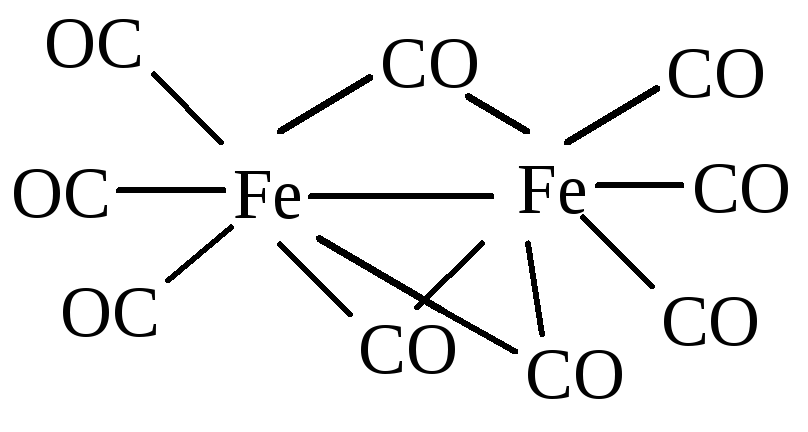
При нагревании карбонилы разрушаются, что используется для получения металла высокой степени чистоты.
Соединения со степенью окисления +2. Оксид железа(II) - черный диамагнитный порошок. В воде нерастворим, проявляет основные свойства:
FeO + 2HCl = FeCl2 + H2O
При нагревании на воздухе окисляется, сильными восстановителями (СО, Н2) восстанавливается до металлического железа:
+ CO + O2
Fe FeO Fe2O3
Гидроксид железа(II) - белое аморфное вещество, получаемое при действии щелочей на водные растворы солей железа(II). На воздухе быстро окисляется:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe(OH)2 - слабое основание с доминированием основных свойств.
Соли железа(II). Большинство солей хорошо растворимы в воде и слабо гидролизованы, окрашены в бледно-зеленый цвет, в водных растворах легко окисляются кислородом воздуха:
2Fe2+ + O2 + 4H+ = 2Fe3+ + 2H2O
Качественной реакцией на катион Fe2+ является образование синего осадка (турнбулева синь) при действии гексацианоферрата(III) калия (красной кровяной соли):
Fe2+ + K3[Fe(CN)6] = KFe[Fe(CN)6] + 2K+
Хлорид железа(II) применяется при лечении анемии. Сульфат железа(II) (железный купорос) применяется для борьбы с вредителями растений.
Координационные соединения железа(II) бывают как катионного, так и анионного типов, наиболее характерно координационное число 6. К катионным соединениям относятся аквакомплексы и аммиакаты, которые получают взаимодействием аммиака с безводными соединениями железа(II). Координационные соединения железа(II) малостойкие, так при растворении в воде аммиакаты легко разрушаются. Для железа(II) наиболее устойчив цианидный комплекс:
FeSO4 + 6KCN = K4[Fe(CN)6] + K2SO4
K4[Fe(CN)6]·3Н2О – желтая кровяная соль – широко используется в аналитической практике и для получения неорганических пигментов. При действии на гексацианоферраты(II) сильных кислот получается Н4[Fe(CN)6] – белый кристаллический порошок, хорошо растворимый в воде, в растворе является весьма сильной кислотой.
Соединения со степенью окисления +3. Оксид железа(III) - красный порошок, нерастворимый в воде, амфотерный оксид со слабым проявлением кислотных свойств.
Гидроксид железа(III) - красно-коричневое аморфное вещество, выделяющееся при действии щелочей на водные растворы солей железа(III). Проявляет свойства амфотерного гидроксида:
Fe(OH)3 + 3HCl = FeCl3 + 3H2O; Fe(OH)3 + 3KOH = K3[Fe(OH)6]
Катион Fe3+ образует соли с анионами многих кислот. В водных растворах соли железа окрашены в желто-коричневый цвет и сильно гидролизованы. По причине гидролиза нельзя получить карбонат железа(III):
2FeCl3 + 3K2CО3 + 3H2O = 2Fe(OH)3 + 3CО2 + 6KCl
Качественными реакциями на соли железа(III) являются реакция с гексацианоферратом(II) калия (желтая кровяная соль) или тиоцианатом (роданидом) калия:
Fe3+ + K4[Fe(CN)6] = KFe[Fe(CN)6] + 3K+
темно-синий (берлинская лазурь)
Fe3+ + 3SCN- = Fe(SCN)3
кроваво-красный раствор
В отличие от солей железа(II), соли железа(III) проявляют свойства слабого окислителя и окисляют анионы некоторых кислот-восстановителей:
2Fe+3Cl3 + 6KI- = 2Fe+2I2 + I20 + 6KCl;
2Fe+3Cl3 + 3K2S-2 = 2Fe+2S + S0 + 6KCl
По этой же причине не удается выделить из раствора цианид железа(III) - Fe(CN)3.
FeCl36H2O применяется при лечении анемии, обладает кровоостанавливающим действием. Fe2(SO4)9H2O используют как коагулятор при очистке воды.
Наиболее характерное координационное число для Fe(III) - 6. Катионные комплексы менее устойчивы аналогичных соединений железа(II). Координационные соединения анионного типа устойчивы, например, K3[Fe(CN)6] (красная кровяная соль), K3[Fe(ОН)6], K3[FeF6], K4[Fe(SCN)6].
Соединения со степенью окисления +6. Соединения железа(VI) представлены производ-ными аниона FeO42-, которые получаются окислением оксида железа(III) в щелочной среде:
Fe2+3O3 + 3KN+5O3 + 4KOH = 2K2Fe+6O4 + 3KN+3O2 + 2H2O
Тетраоксоферраты(VI) - сильные окислители, в растворах быстро разлагаются с выделением кислорода:
4K2FeO4 + 10H2O = 4Fe(OH)3 + 8KOH + 3O2
