
- •Таврический национальный университет
- •Лекция № 1. Водород
- •Соединения водорода
- •Литература: [1] с. 330 - 338, [2] с. 411 - 415, [3] с. 262 - 270 Лекция № 2. Элементы VII-a-подгрупы (галогены)
- •Cоединения галогенов
- •Лекция № 3. Элементы via-подгруппы
- •3.1. Кислород
- •Соединения кислорода
- •2Hso4- - 2e- h2s2o8
- •Соединения серы
- •3.3. Подгруппа селена
- •Соединения селена и теллура
- •Литература: [1] с. 359 - 383, [2] с. 425 - 435, [3] с. 297 - 328 Лекция № 4. Элементы va-подгруппы
- •Соединения азота
- •4.2. Фосфор
- •Соединения фосфора
- •4.3. Элементы подгруппы мышьяка
- •Соединения мышьяка, сурьмы и висмута
- •Литература: [1] с. 383 - 417, [2] с. 435 - 453, [3] с. 328 - 371 Лекция № 5. Элементы iva-подгруппы
- •5.1. Углерод
- •Соединения углерода
- •5.2. Кремний
- •Соединения кремния
- •5.3. Германий, олово, свинец
- •Соединения германия
- •Соединения олова
- •Соединения свинца
- •Литература: [1] с. 417 - 435, 491 - 513, [2] с. 453 - 472, [3] с. 371 - 409 Лекция № 6. Элементы iiia-подгруппы
- •Соединения бора
- •6.2. Алюминий
- •Соединения алюминия
- •6.3. Подгруппа галлия
- •Соединения элементов подгруппы галлия
- •Литература: [1] с. 608 - 619, [2] с. 472 - 481, [3] с. 412 - 446 Лекция № 7. Элементы iia-подгруппы
- •7.1. Бериллий
- •Соединения бериллия
- •7.2. Магний
- •Соединения магния
- •7.3. Щелочноземельные металлы
- •Соединения щелочноземельных металлов
- •Литература: [1] с. 587 - 599, [2] с. 481 - 486, [3] с. 447 - 460
- •7.4. Элементы ia-подгруппы (щелочные металлы)
- •Соединения щелочных металлов
- •Литература: [1] с. 543 - 551, [2] с. 486 - 489, [3] с. 461 - 470 Лекция № 8. Общая характеристика d-элементов. Элементы iiiв - vb подгрупп (подгруппы скандия,титана и ванадия)
- •8.1. Общая характеристика d-элементов
- •8.2. Элементы iiiв подгруппы (подгруппа скандия)
- •Соединения элементов подгруппы скандия
- •8.3. Элементы ivв подгруппы (подгруппа титана)
- •Соединения титана, циркония и гафния
- •8.4. Элементы vв подгруппы (подгруппа ванадия)
- •Соединения ванадия, ниобия и тантала
- •Литература: [1] с. 619 - 633, [2] с. 489 - 523, [3] с. 478 - 481, 499 - 520 Лекция № 9. Элементы viв- и viiв-подгрупп
- •9.1 Элементы viв-подгруппы (подгруппа хрома)
- •Соединения хрома, молибдена и вольфрама
- •9.2. Элементы viiв-подгруппы (подгруппа марганца)
- •Соединения маргнаца, технеция и рения
- •Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548 Лекция № 10. Элементы viiib-подгруппы
- •10.1. Элементы триады железа
- •Соединения железа
- •Соединения кобальта
- •Соединения никеля
- •Литература: [1] с. 650 - 679, [2] с. 540 - 550, [3] с. 548 - 584
- •10.2. Платиновые металлы
- •Соединения рутения и осмия
- •Соединения родия и иридия
- •Соединения палладия и платины
- •Лекция № 11. Элементы ib- и iib-подгрупп
- •11.1 Элементы ib-подгруппы (подгруппы меди)
- •Соединения меди
- •Соединения серебра
- •Соединения золота
- •11.2. Элементы iib-подгруппы (подгруппа цинка)
- •Соединения цинка и кадмия
- •Соединения ртути
- •Литература: [1] с. 551 - 563, 599 - 608, [2] с. 550 - 554, [3] с. 585 - 602 Лекция № 12. Химия f-элементов
- •12.1. Лантаниды
- •Соединения лантанидов
- •12.2. Актиниды
- •Соединения актинидов
- •Лекция № 13. Инертные газы
- •13.1. Гелий. Неон. Аргон
- •13.2. Элементы подгруппы криптона
- •Соединения криптона, ксенона и радона
- •Список рекомендуемой литературы
- •Оглавление
6.2. Алюминий
Для алюминия (1s22s22p63s23p1) характерна степень окисления +3, типичные гибридизации – sp3 и sp3d2, в соединениях проявляет координационные числа 4 и 6.
Алюминий - один из наиболее распространенных элементов земной коры (кларк составляет 6,6 мол.%). Основные минералы: Al2O3 - корунд (окрашенные модификации - рубин, сапфир), Al2O3nH2O - боксит, Na3AlF6 - криолит. Значительное количество алюминия находится в земной коре в виде алюмосиликатов.
Алюминий - серебристо-белый металл (т.пл. 660 ºС) с высокой электро- и теплопроводностью, очень легкий (плотность 2,7 г/см3). Широко применяется в электротехнике, по электропроводности уступает только золоту, серебру и меди. Пластичен, хорошо обрабатывается прессованием и ковкой. Сплавы алюминия: силумины (11-14% кремния), дюралюмины (3,5-4% меди, 0,5-1% магния, кремния и марганца), магналий (3-30% магния) отличаются высокой прочностью и легкостью, что делает их основными конструкционными материалами в самолето- и ракетостроении.
В промышленности алюминий получают электролизом глинозема (технический оксид алюминия), растворенного в расплаве криолита Na3AlF6. В расплаве Al2O3 ведет себя как электролит (алюминат алюминия).
Al2O3 = Al3+ + AlO33-;
Катод: Al3+ + 3e- = Al;
Анод: 4AlO33- - 12e- = 2Al2O3 + 3O2
Химические свойства. Алюминий - очень активный металл, по активности уступает только щелочным и щелочноземельным металлам. Однако прочная оксидная пленка на поверхности алюминия придает ему повышенную устойчивость в обычных условиях. Если оксидную пленку удалить, алюминий активно реагирует с водой и кислородом воздуха:
4Al + 3O2 = 2Al2O3; 2Al + 6H2O = 2Al(OH)3 + 3H2
При высоких температурах оксидная пленка не защищает алюминий и металл энергично взаимодействует с кислородом, серой, галогенами, азотом, фосфором, углеродом, образуя соответствующие бинарные соединения. Высокое сродство алюминия к кислороду позволяет использовать его для восстановления металлов из их оксидов (алюмотермия):
t
Fe2O3 + 2Al = 2Fe + Al2O3
Алюминий легко растворяется в водных растворах щелочей и кислот, не обладающих окислительными свойствами:
2Al + 6KOH + 6H2O = 2K3[Al(OH)6] + 3H2;
2Al + 6HCl = 2AlCl3 + 3H2
Концентрированные кислоты-окислители и очень разбавленная азотная кислота на холоду пассивируют алюминий, но растворяют его при нагревании:
t
8Al + 30HNO3(разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
Соединения алюминия
Оксид алюминия существует в нескольких модификациях, основной из которых является -Al2O3 (корунд) - твердое, тугоплавкое соединение (т.пл. 2050 С). По твердости уступает только алмазу, эльбору и карборунду. Очень устойчивое соединение, не реагирующее с водными растворами кислот и щелочей. При сплавлении проявляет свойства амфотерного оксида:
t
Al2O3 + 2NaOH = 2NaAlO2 + H2O;
t
Al2O3 + 3K2S2O7 = Al2(SO4)3 + 3K2SO4
Гидроксид алюминия выделяется при действии аммиака на водные растворы солей алюминия:
Al3+ + 3NH3H2O = Al(OH)3 + 3NH4+
Свежеполученный Al(OH)3 реакционноспособное вещество, типичный амфотерный гидроксид, растворимый в растворах кислот и щелочей:
Al(OH)3 + 3HCl = AlCl3 + 3H2O; Al(OH)3 + 3KOH = K3[Al(OH)6]
Со временем гидроксид алюминия теряет активность за счет частичной потери воды и образования полимерных структур.
Галогениды алюминия - сильные кислоты Льюиса, энергично присоединяют электронодонорные молекулы, очень энергично растворяются в воде, иодид алюминия со взрывом. Фторид алюминия представляет собой полимерное вещество, нерастворимое в воде и органических растворителях. Хлорид, бромид и иодид алюминия - летучие кристаллические вещества, растворимые в органических растворителях, в парах и в инертных органических растворителях существуют в виде димерных молекул. Например:
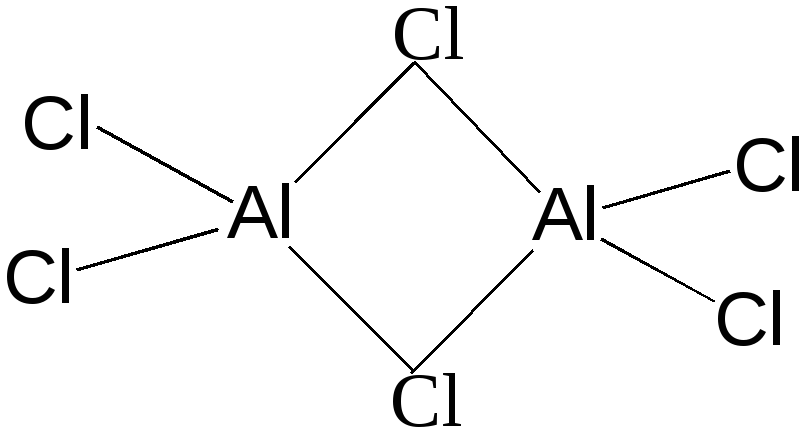
При сплавлении с основными галогенидами образуют анионные координационные соединения типа M+13[AlF6], M+1[AlHal4]. Из них наиболее устойчив гексафтороалюминат Na3[AlF6] (криолит), нашедший применение в промышленности для получения алюминия, стекол и эмалей. Фтороалюминаты щелочных металлов в воде малорастворимы. В хлоро-, бромо- и иодоалюминатах координационное число алюминия равно 4, в растворе комплексные соли полностью гидролизуются.
Соли алюминия в основном хорошо растворимы в воде, сильно гидролизованы. Наибольшее применение находит сульфат алюминия и алюмокалиевые квасцы - K2SO4Al2(SO4)324H2O.
Сульфид алюминия получают прямым синтезом. Соединение представляет собой желтые иглообразные кристаллы, существует только в безводных условиях, водой полностью гидролизуется:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Гидрид алюминия (алан) белое полимерное соединение, получают в эфире по следующей реакции:
AlСl3 + 3Li[AlH4] = 4AlH3 + 3LiCl
При температуре 105 ºС разлагается, активный восстановитель, самовоспламеняется на воздухе. Гидрид алюминия амфотерен, кислотная природа соединения проявляется в реакции с основными гидридами:
AlН3 + NaH = Na[AlH4]
Тетрагидридоалюминаты – белые твердые вещества, сильные восстановители, водой бурно разлагаются:
Na[AlH4] + 4H2O = Al(OH)3 + NaOH + 4H2
Применяются в органическом синтезе.
Нитрид алюминия – AlN – получают прямым синтезом или по реакции:
2Al + 2NH3 = 2AlN + 3H2
Нитрид – желтое кристаллическое вещество, разлагается кипящей водой:
AlN + 3H2O = Al(OH)3 + NH3
Карбид алюминия - Al4С3 - относится к ряду метанидов (производных метана). Твердое солеподобное вещество, получают прямым синтезом, в воде полностью гидролизуется:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
