- •Таврический национальный университет
- •Лекция № 1. Водород
- •Соединения водорода
- •Литература: [1] с. 330 - 338, [2] с. 411 - 415, [3] с. 262 - 270 Лекция № 2. Элементы VII-a-подгрупы (галогены)
- •Cоединения галогенов
- •Лекция № 3. Элементы via-подгруппы
- •3.1. Кислород
- •Соединения кислорода
- •2Hso4- - 2e- h2s2o8
- •Соединения серы
- •3.3. Подгруппа селена
- •Соединения селена и теллура
- •Литература: [1] с. 359 - 383, [2] с. 425 - 435, [3] с. 297 - 328 Лекция № 4. Элементы va-подгруппы
- •Соединения азота
- •4.2. Фосфор
- •Соединения фосфора
- •4.3. Элементы подгруппы мышьяка
- •Соединения мышьяка, сурьмы и висмута
- •Литература: [1] с. 383 - 417, [2] с. 435 - 453, [3] с. 328 - 371 Лекция № 5. Элементы iva-подгруппы
- •5.1. Углерод
- •Соединения углерода
- •5.2. Кремний
- •Соединения кремния
- •5.3. Германий, олово, свинец
- •Соединения германия
- •Соединения олова
- •Соединения свинца
- •Литература: [1] с. 417 - 435, 491 - 513, [2] с. 453 - 472, [3] с. 371 - 409 Лекция № 6. Элементы iiia-подгруппы
- •Соединения бора
- •6.2. Алюминий
- •Соединения алюминия
- •6.3. Подгруппа галлия
- •Соединения элементов подгруппы галлия
- •Литература: [1] с. 608 - 619, [2] с. 472 - 481, [3] с. 412 - 446 Лекция № 7. Элементы iia-подгруппы
- •7.1. Бериллий
- •Соединения бериллия
- •7.2. Магний
- •Соединения магния
- •7.3. Щелочноземельные металлы
- •Соединения щелочноземельных металлов
- •Литература: [1] с. 587 - 599, [2] с. 481 - 486, [3] с. 447 - 460
- •7.4. Элементы ia-подгруппы (щелочные металлы)
- •Соединения щелочных металлов
- •Литература: [1] с. 543 - 551, [2] с. 486 - 489, [3] с. 461 - 470 Лекция № 8. Общая характеристика d-элементов. Элементы iiiв - vb подгрупп (подгруппы скандия,титана и ванадия)
- •8.1. Общая характеристика d-элементов
- •8.2. Элементы iiiв подгруппы (подгруппа скандия)
- •Соединения элементов подгруппы скандия
- •8.3. Элементы ivв подгруппы (подгруппа титана)
- •Соединения титана, циркония и гафния
- •8.4. Элементы vв подгруппы (подгруппа ванадия)
- •Соединения ванадия, ниобия и тантала
- •Литература: [1] с. 619 - 633, [2] с. 489 - 523, [3] с. 478 - 481, 499 - 520 Лекция № 9. Элементы viв- и viiв-подгрупп
- •9.1 Элементы viв-подгруппы (подгруппа хрома)
- •Соединения хрома, молибдена и вольфрама
- •9.2. Элементы viiв-подгруппы (подгруппа марганца)
- •Соединения маргнаца, технеция и рения
- •Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548 Лекция № 10. Элементы viiib-подгруппы
- •10.1. Элементы триады железа
- •Соединения железа
- •Соединения кобальта
- •Соединения никеля
- •Литература: [1] с. 650 - 679, [2] с. 540 - 550, [3] с. 548 - 584
- •10.2. Платиновые металлы
- •Соединения рутения и осмия
- •Соединения родия и иридия
- •Соединения палладия и платины
- •Лекция № 11. Элементы ib- и iib-подгрупп
- •11.1 Элементы ib-подгруппы (подгруппы меди)
- •Соединения меди
- •Соединения серебра
- •Соединения золота
- •11.2. Элементы iib-подгруппы (подгруппа цинка)
- •Соединения цинка и кадмия
- •Соединения ртути
- •Литература: [1] с. 551 - 563, 599 - 608, [2] с. 550 - 554, [3] с. 585 - 602 Лекция № 12. Химия f-элементов
- •12.1. Лантаниды
- •Соединения лантанидов
- •12.2. Актиниды
- •Соединения актинидов
- •Лекция № 13. Инертные газы
- •13.1. Гелий. Неон. Аргон
- •13.2. Элементы подгруппы криптона
- •Соединения криптона, ксенона и радона
- •Список рекомендуемой литературы
- •Оглавление
4.2. Фосфор
Фосфор представлен в природе одним изотопом - 31Р, кларк фосфора равен 0,05 мол.%. Встречается в виде фосфатных минералов: Ca3(PO4)2 - фосфорит, Ca5(PO4)3X (X = F,Cl,OH) - апатиты. Входит в состав костей и зубов животных и человека, а также в состав нуклеиновых кислот (ДНК и РНК) и аденозинфосфорных кислот (АТФ, АДФ и АМФ).
Получают фосфор восстановлением фосфорита коксом в присутствии диоксида кремния.
t
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Простое вещество - фосфор - образует несколько аллотропных модификаций, из которых основными являются белый, красный и черный фосфор. Белый фосфор образуется при конденсации паров фосфора и представляет собой белое воскоподобное вещество (т.пл. 44 С), нерастворимое в воде, растворимое в некоторых органических растворителях. Белый фосфор имеет молекулярное строение и состоит из тетраэдрических молекул P4.

Напряженность связей (валентный угол P-P-P составляет всего 60 ) обусловливает высокую реакционную способность и токсичность белого фосфора (смертельная доза около 0,1 г). Поскольку белый фосфор хорошо растворим в жирах, в качестве антидота при отравлении нельзя применять молоко. На воздухе белый фосфор самопроизвольно воспламеняется, поэтому хранят его в герметически упакованной химической посуде под слоем воды.
Красный фосфор имеет полимерное строение. Получается при нагревании белого фосфора или облучении его светом. В отличие от белого фосфора малореакционноспособен и нетоксичен. Однако остаточные количества белого фосфора могут придавать красному фосфору токсичность!
Черный фосфор получается при нагревании белого фосфора под давлением 120 тыс.атм. Имеет полимерное строение, обладает полупроводниковыми свойствами, химически устойчив и нетоксичен.
Химические свойства. Белый фосфор самопроизвольно окисляется кислородом воздуха при комнатной температуре (окисление красного и черного фосфора идет при нагревании). Реакция протекает в два этапа и сопровождается свечением (хемилюминесценция).
t t
2P + 3O2 = 2P2O3; P2O3 + O2 = P2O5
Ступенчато происходит также взаимодействие фосфора с серой и галогенами.
t t
2P + 3Cl2 = 2PCl3; PCl3 + Cl2 = PCl5
При взаимодействии с активными металлами фосфор выступает в роли окислителя, образуя фосфиды - соединения фосфора в степени окисления -3.
t
3Ca + 2P = Ca3P2
Кислотами-окислителями (азотная и концентрированная серная кислоты) фосфор окисляется до фосфорной кислоты.
P + 5HNO3(конц) = H3PO4 + 5NO2 + H2O
При кипячении с растворами щелочей белый фосфор диспропорционирует:
4P0 + 3KOH + 3H2O = P-3H3 + 3KH2P+1O2
фосфин гипофосфит калия
Соединения фосфора
Соединения со степенью окисления –3. Фосфиды s-элементов представляют соединения с ионно-ковалентным типом связи, они солеподобны, легко разлагаются водой:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
Фосфиды d-металлов являются соединениями переменного состава (бертолидами), обычно тугоплавки, имеют металлический блеск, электропроводны и химически малоактивны.
Ковалентным фосфином является PH3 - фосфин - бесцветный газ, с характерным неприятным запахом чеснока, очень токсичен. На воздухе самопроизвольно воспламеняется, в воде малорастворим. В отличие от аммиака образует соли только с очень сильными кислотами.
PH3 + О2 = Р2O5 + H2O; PH3 + HI = РH4I
иодид фосфония
Образуется фосфин при диспропорционировании белого фосфора в щелочных растворах. Лабораторным методом получения является гидролиз фосфидов:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Соединения со степенью окисления +1. Наиболее важными соединениями фосфора в степени окисления +1 являются фосфорноватистая кислота и ее соли - гипофосфиты. Фосфорноватистая кислота - H[H2PO2] - бесцветное кристаллическое вещество, хорошо растворимое в воде, сильная одноосновная кислота (Ka = 810-2).

Фосфорноватистая кислота и гипофосфиты - сильные восстановители. При нагревании фосфорноватистая кислота диспропорционирует:
3H[H2P+1O2] = P-3H3 + 2H2[HP+3O2]
фосфористая кислота
Соединения со степенью окисления +3. Степень окисления +3 фосфор имеет в галогенидах, оксиде, фосфористой кислоте - H[H2PO3] - и ее солях - фосфитах. PF3 - газ, PCl3 и PBr3 – жидкости, дымящиеся на воздухе вследствие гидролиза.
PCl3 + 3H2O = H[H2PO3] + 3HCl
Молекула тригалогенида фосфора имеет геометрию тригональной пирамиды с атомом фосфора в вершине. В образовании связей принимают участие sp3-гибридные орбитали, валентный угол составляет приблизительно 100.

Оксид фосфора(III) - P2O3 – существует в нескольких модификациях, построенных из пирамидальных структурных единиц - PO3. Обычная форма имеет молекулярную решетку, образованную молекулами – P4O6 – бесцветное кристаллическое вещество следующего строения:

По химическим свойствам типичный кислотный оксид - ангидрид фосфористой кислоты.
P2O3 + 3H2O = 2H2[HPO3]; P2O3 + 4NaOH = 2Na2[HPO3] + H2O
Фосфористая кислота - H2[HPO3] - бесцветные гигроскопичные кристаллы, хорошо растворимые в воде. H2[HPO3] является сильной двухосновной кислотой (K1 = 210-2, K2 = 610-7).

Соли фосфористой кислоты - фосфиты - сильные восстановители.
Hg+2Cl2 + H2[HP+3O3] + H2O = H3P+5O4 + Hg0 + 2HCl
Соединения со степенью окисления +5. Основные соединения фосфора в степени окисления +5: PHal5, POHal3 (Hal = F, Cl, Br), P2O5, H3PO4 и ее соли.
Фторид фосфора(V) - газообразное вещество, молекула которого имеет геометрию тригональной бипирамиды:
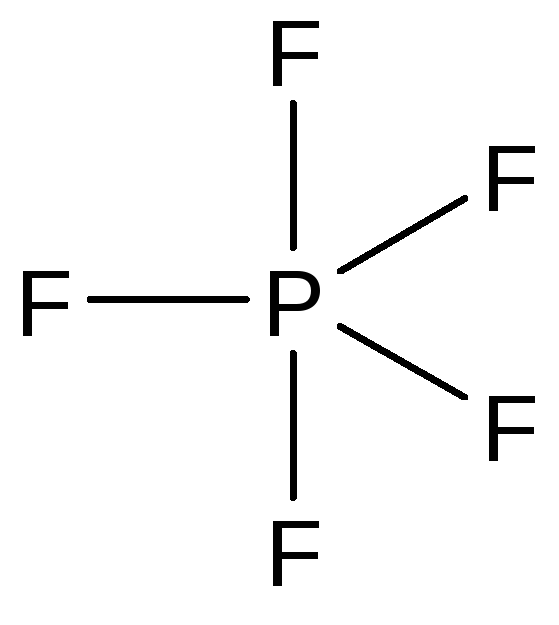
Аналогичное строение имеют другие галогениды фосфора(V) в газообразном состоянии. В кристаллах их строение соответствует следующим формулам: [PCl4]+[PCl6]-, [PBr4]+Br-. Галогениды фосфора - реакционноспособные и гидролитически неустойчивые соединения.
PF5 + HF = H[PF6]; PCl5 + 4H2O = H3PO4 + 5HCl
Оксогалогениды фосфора(V) также гидролитически неустойчивы, например:
POCl3 + 3H2O = H3PO4 + HCl
Широко применяются в органической химии для получения хлорсодержащих и фосфорорганических соединений.
Оксид фосфора(V) - P2O5, точнее P4O10 - бесцветное снегоподобное вещество.

Типичный кислотный оксид, реакция с водой идет ступенчато и приводит в конечном итоге к образованию ортофосфорной кислоты:
t
P2O5 + H2O = 2HPO3; HPO3 + H2O = H3PO4
метафосфорная кислота ортофосфорная кислота
Повышенное сродство к воде позволяет использовать оксид фосфора(V) для осушки газов и органических растворителей, а также в качестве водоотнимающего средства, например:
P2O5 + 2HClO4 = 2HPO3 + Cl2O7
Ортофосфорная кислота - H3PO4 - бесцветные гигроскопичные кристаллы (т.пл. 42 С) неограниченно растворимые в воде.

Кислота средней силы при диссоциации по первой ступени (K1 = 810-3), слабая - при диссоциации по второй и третьей ступеням (K2 = 610-8, K3 = 110-12). Образует три ряда солей, например, NaH2PO4 - дигидрофосфат натрия; Na2HPO4 - гидрофосфат натрия; Na3PO4 - фосфат (ортофосфат) натрия. Фосфаты щелочных металлов и аммония хорошо растворимы в воде. Фосфаты остальных металлов малорастворимы. Переход к кислым солям сопровождается заметным повышением растворимости. Фосфаты щелочноземельных металлов и аммония применяются в качестве фосфорных удобрений: Ca3(PO4)2 - фосфоритная мука; CaHPO42H2O - преципитат; Ca(H2PO4)2H2O - двойной суперфосфат; Ca(H2PO4)2H2O + 2CaSO4 - суперфосфат; NH4H2PO4 + (NH4)2HPO4 - аммофос. Широко применяются комбинированные удобрения, содержащие несколько питательных элементов: аммофос + KNO3 - азофоска; (NH4)2HPO4 + NH4NO3 + KCl - нитрофоска.
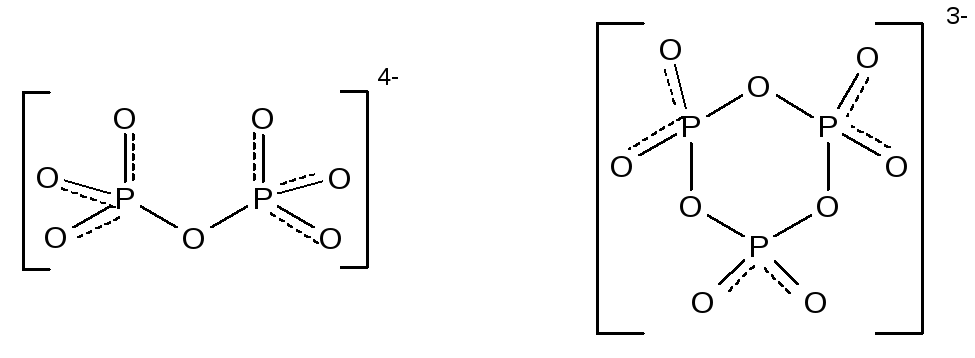
Присоединение фосфорного ангидрида к фосфорной кислоте приводит к образованию ряда полифосфорных кислот, простейшей из которых является дифосфорная (пирофосфорная) кислота - H4P2O7.

Полифосфорные кислоты образуют ряд солей с открытой цепью из 2 – 10 атомов фосфора –полифосфаты – или циклического строения – метафосфаты. Полифосфаты представляют собой соли аниона общей формулы – [PnO3n+1](n+2)-. Например, Na4P2O7 – диполифосфат (пирофосфат), Na5P3O10 - триполифосфат. К метафосфатам относятся соли аниона общей формулы – [PnO3n]n-. Например, Na3P3O9 – триметафосфат, Na4P4O12 - тетраметафосфат. Структура диполифосфат- и триметафосфат-анионов: