
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / 77 сборник
.pdfuse disorder during pregnancy. J Dev Orig Health Dis. 2019 Feb;10(1):132-137. doi: 10.1017/S2040174418000478. Epub 2018 Aug 16. PMID: 30113278.
10.Гаджиева М.Т. Современные представления об эпидемиологии, этиологии и патогенезе отслойки плодных оболочек и хориона/плаценты / Гаджиева М.Т. // Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. – 2016. - №4. – С. 102.
11.Gonen N, Levy M, Kovo M, Schreiber L, Noy LK, Volpert E, Bar J, Weiner E. Placental Histopathology and Pregnancy Outcomes in "Early" vs. "Late" Placental Abruption. Reprod Sci. 2021 Feb;28(2):351-360. doi: 10.1007/s43032-020-00287-3. Epub 2020 Aug 18. PMID: 32809128.
12.Правила проведения патолого-анатомических исследований плаценты Класс XV и XVI МКБ-
10.Клинические рекомендации / Франк Г. А. и др. / Российское общество патологоанатомов. – М.,
2017. – 74 с
13.Перетятко Л.П., Стороженко Т.В. ПРЕЖДЕВРЕМЕННАЯ ОТСЛОЙКА НОРМАЛЬНО РАСПОЛОЖЕННОЙ ПЛАЦЕНТЫ: ПРЕДРАСПОЛАГАЮЩИЕ ФАКТОРЫ, ЭТИОЛОГИЯ, ПАТОГЕНЕЗ, КЛИНИКО-МОРФОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ // Современные проблемы науки и образования. – 2014. – № 4. URL: https://science-education.ru/ru/article/view?id=14466 (дата обращения: 07.04.2023).
14.Downes KL, Grantz KL, Shenassa ED. Maternal, Labor, Delivery, and Perinatal Outcomes Associated with Placental Abruption: A Systematic Review. Am J Perinatol. 2017 Aug;34(10):935-957. doi: 10.1055/s-0037-1599149. Epub 2017 Mar 22. PMID: 28329897; PMCID: PMC5683164.
15.Wang Y.N. Multivariate analysis of risk factors with placental abruption in preeclampsia/. Wang Y.N., Yang Z. // Depatment of Obstetrics and Gynecology. – 2010. – N. 45(11). – P.825-828.
16.Kanervo MM, Tupola SJ, Nikkola EM, Rantakari KM, Kahila HK. Buprenorphine-naloxone, buprenorphine, and methadone throughout pregnancy in maternal opioid use disorder. Acta Obstet Gynecol Scand. 2023 Mar;102(3):313-322. doi: 10.1111/aogs.14497. Epub 2022 Dec 23. PMID: 36562462; PMCID: PMC9951318.
17.Жаркин Н.А., Лавенюкова Е.М., Мирошников А.Е. Преждевременная отслойка нормально расположенной плаценты. Эпидемиология, факторы риска, прогнозирование, исходы // Российский вестник акушерство-гинеколога. – 2018. - №3. – С. 20-24
18. Филиппов О.С., Гусева Е.В. |
Материнская смертность в Российской Федерации |
в 2019 г.. Проблемы |
репродукции. 2020;26(6-2):8-26. |
Filippov OS, Guseva EV. Maternal mortality in the Russian Federation in 2019. Russian Journal of Human
Reproduction. 2020;26(6-2):8-26. |
(In Russ.) |
https://doi.org/10.17116/repro2020260628. |
|
ЭПИДЕМИОЛОГИЧЕСКАЯ ОБСТАНОВКА ПО МАЛЯРИИ В РЕСПУБЛИКЕ АДЫГЕЯ Автор: Матыченко З.А.
Научный руководитель: Рамазанова Л. И.
Ключевые слова: малярия; малярийные плазмодии; малярийные комары; ареал обитания комаров в Адыгее; хромосомные мутации.
Актуальность исследования: Малярия – протозойное заболевание, передающееся трансмиссивным путём, характеризующееся высокой степенью опасности ввиду возникновений осложнений течения инвазии вплоть до летального исхода. Заболевание носит глобальный характер
— 40% населения мира живёт в странах с высоким уровнем его распространения. Ежегодно регистрируется около 200 миллионов новых фактов инфицирования. Смертность от малярии достигает 430 000 случаев в год (данные за 2017 г.). Малярия занимает третье место по смертности после таких инфекционных заболеваний, как пневмония и туберкулёз. Наибольшее количество зарегистрированных случаев инфицирования определяются на Африканском континенте, но инвазия возможна не только за пределами нашей страны, но и на её территории, а именно в южных регионах. Исторически территория Адыгеи является эндемичной для заболеваний, передающихся трансмиссивным путем. Малярия на Кавказе оказала значительное влияние на жизнеспособность населения, адаптацию и выживание военнослужащих во время Кавказской войны, а также переселенцев-колонистов из центральной России, прибывших для освоения новых земель. Именно по причине широкого распространения переносчиков в заболоченных местах, люди старались устраивать свой быт на солнечных горных равнинах. Но с годами количество водоёмов возросло в результате создания искусственных хранилищ. Сегодня в Адыгее действует пять водохранилищ: Краснодарское, Шапсугское, Тахтамукайское, Шенджийское, Майкопское. Ввиду расширения акватории, увеличилось количество очагов выплода комаров, так как условия содержания водоёмов
отклоняются от нормы, что нарушило экологическое равновесие в регионе, привело к заилению участков водных источников и как следствие к возрастанию рисков возникновения эпидемических очагов трансмиссивных заболеваний, которые зависят от экологических параметров личиночных биотопов. Одним из таких параметров является содержание кислорода в воде.
Гипотеза: уровень содержания кислорода в воде достаточен для выживаемости и хромосомной изменчивости личинок самок комаров-переносчиков рода Anopheles в республике Адыгея.
Цель работы: изучение наличия благоприятных условий обитания и распространение Anopheles в Адыгее и факторы их изменчивости в рамках республики.
Основная часть работы: Малярия, или болотная лихорадка (Malaria) — группа протозойных заболеваний человека, передающихся трансмиссивным инокулятивным и трансфузионным (гемотрансфузионным) путями. Проблемой многих стран являются завозные случаи малярии — люди, не имеющие иммунитета к возбудителю, уязвимы перед инфекцией. На мировом уровне решается проблема глобальной программой ВОЗ. Была проведена работа и разработка курса по ликвидации малярии в странах с высокой степенью заболеваемости. Но препятствием является глобальное потепление, в связи с которым процесс замедлился и усложнился.
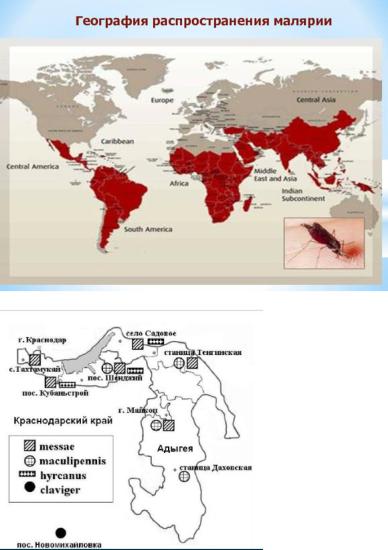
Заболевание распространено более чем в 100 странах мира. В группу высокого риска входят все районы Африки южнее Сахары (до 90% случаев заражения), а это — более 50 государств. Другие крупные очаги инфекции — Индия, Шри-Ланка, Бразилия, Вьетнам и Колумбия. (Приложение 1)
Завозные случаи малярии из эндемичных стран ежегодно регистрируются практически в каждом регионе России, что в свою очередь является риском появления местных очагов инфекции. Во Всемирном докладе о малярии за отчётный год указано, что во всём мире количество заболевания малярией составляет 241 млн человек, из которых 627 000 умерло. В сравнении с предыдущим годом, случаи заражения участились на 14 млн человек, а с летальным исходом – на 69 000 человек.
Около двух третей дополнительных случаев смерти (47 000) были связаны с произошедшими за время пандемии COVID-19 перебоями в мероприятиях по профилактике, диагностике и лечению малярии: 25 апреля 2022 года в шестнадцатый раз был отмечен Всемирный день борьбы с малярией (World Malaria Day), а в 2022 году эта кампания проходит под девизом «Готовы победить малярию»
(Ready to beat malaria).
Нынешних темпов работы недостаточно для достижения этапов, предусмотренных Глобальной технической стратегией ВОЗ по борьбе с малярией на 2016-2030 гг., в частности целевых показателей, предусматривающих сокращение уровней заболеваемости малярией и смертности от нее на 40%.
Впоследнее время прогресс в борьбе с малярией, был замедлен, из-за дефицита финансирования мероприятий по борьбе с малярией на международном и национальном уровнях, а также пандемией COVID-19. В 2020 году общее количество случаев малярии в мире составило 241 млн. (2019 году - 229 млн.) и эта болезнь унесла жизни более 627 тыс. человек (2019 году - 409 тыс.). Увеличение числа случаев и смертности от малярии связаны с перебоями в оказании медицинских услуг во время пандемии COVID-19.
ВРоссийской Федерации в 2021 году число завозных случаев малярии увеличилось на 62 % и составило 94 случая (показатель заболеваемости 0,06 на 100 тыс. населения) против - 58 случаев в 2020 году (0,04 на 100 тыс. населения). В структуре заболевших взрослое население составило 99
%.Среди детей до 17 лет зарегистрирован 1 случай малярии (у ребенка 5 лет).
В2021 году случаи малярии были зарегистрированы в 32 субъектах Российской Федерации (в 2020 году - в 24 субъектах). Наибольшее число случаев малярии зарегистрировано в городах Москве (26 случаев), Санкт-Петербурге (13 случаев), Ростовской области (5 случаев), Республике Башкортостан, Краснодарском крае - по 4 случая.
Это инвазионное заболевание является следствием деятельности возбудителей рода Plasmodium, передающимися комарами рода Anopheles и оказывающими влияние на элементы ретикулогистооцитарной системы (РГС), которая функционально связана с каждым органом, с нервной и эндокринной системами (например, в печени участвует в элиминации билирубина; костном мозге – в насыщении эритробластов негеминным железом) и эритроциты, в которые внедряется плазмодий, где в дальнейшем происходит цикл эритроцитарной шизогонии (стадия жизненного цикла). Последствиями шизогонии и выхода мерозоитов являются разрушение красных кровяных телец и выброс значительной массы токсических отходов паразита, обломков эритроцитов и свободного гемоглобина. Эти факторы отравляют организм и способствуют размножению лимфоидных и ретикулярных клеток, а это вызывает гиперплазию костного мозга и гепатоспленомегалию (латынь: hepatosplenomegaly - увеличение печени и селезёнки). Помимо этого, чужеродный белок паразитов
ираспад собственного белка способствуют ряду острых осложнений, таких как поражение сосудов
ивозникновение злокачественных форм малярии: злокачественная (молниеносная) трёхдневная малярия, которая вызывается P. Falciparum и является самой тяжёлой формой малярии, так как для неё характерны слипание эритроцитов и прикрепление к их стенке мелких сосудов (паразитарные стазы), что приводит к закупорке капилляров и ведет к летальному исходу, если это происходит в сосудах головного мозга. К осложнениям четырёхдневной малярии, которую вызывает P. Malariae, относят церебральную форму (малярийная кома – возникает чаще в первые 24-43 часа от начала заболевания, особенно у лиц с дефицитом массы тела), инфекционно-токсический шок (алгидная форма), тяжёлую форму гемоглобинурийной лихорадки. Чаще всего эта форма встречается во всех странах Африки и Среднего Востока, Юго-Восточной Азии, на островах Тихого океана.
Всредней полосе РФ климатические условия, благоприятствующие распространению плазмодия, практически невозможны, в отличие от южных регионов, так как температура воздуха окружающей среды должна быть постоянно не ниже 16-20°С (в зависимости от вида возбудителя)
инепрерывной в течение 30 дней — это условие является главенствующим в географическом ареале возможного распространения малярии, коими обладает Юг России, а именно республика Адыгея, которой посвящена данная статья.
Исторически территория Адыгеи является эндемичной по ряду заболеваний, передающихся трансмиссивным путем. Случаи малярии в Республике Адыгея не регистрируются с 2005 года. Но в республике периодически регистрируются завозные случаи малярии: в 2005 году у студента из Республики ЧАД; в 2014 году у гражданина, прописанного в городе Северодвинске Архангельской области, в эпиданамнезе которого выявлено пребывание в конце 2013 года в Индии; в декабре 2016 года у жителя города Адыгейска, в эпиданамнезе которого указано пребывание в конце 2016 года в Конго, Уганде.
Обращаясь к историческому аспекту данного вопроса, надо отметить, что одним из факторов риска заболевания населения Северо-Западного Кавказа малярией до начала XX в. было наличие ее природных очагов. Известный российский антрополог, врач И. Пантюхов, в 1866 г. в своей работе «Особенности болезней на склонах Кавказа», отмечал, что перемежающаяся лихорадка есть эндемическая болезнь для обоих склонов Кавказа. По его мнению, «Туземцы с древнейших времен прекрасно знали всю губительность малярии, равно как и то, что лекарства тут мало имеют значения, и принимали против заболевания различные гигиенические меры» [5, с. 43].
Малярию, или перемежающуюся лихорадку, адыги называли «техьагъу» (в переводе «лихорадка»). Адыгские целители владели магическими и рациональными приемами лечения, но большое внимание уделяли профилактическим и гигиеническим мероприятиям. Так как возникновение болезни связывали с заболоченными местами, то для поселения выбирались пространства в отдалении от малярийных мест. Чаще это были солнечные горные долины. Естествоиспытатель К.Н. Россиков отмечал, что аулы располагаются по возвышенным площадям и больше в восточной части, чем в западной, как более сухой и производительной [6].
Профилактическим можно считать и соблюдение режима труда. Если обрабатываемые поля находились вблизи комариных мест, с поля уходили сразу по заходу солнца и возвращались в аул, находящийся в отдалении. К профилактическим мерам можно отнести и особенности хозяйственной деятельности адыгов. Разведение большого количества мелкого рогатого скота, использующего в качестве корма кустарники подлеска, способствовало очищению леса, лучшему проникновению солнечного света, усилению вентиляции, уменьшению влаги, а значит, оздоровлению окружающей среды. Использование камыша и куги в хозяйстве способствовало очищению заболоченных мест. В качестве профилактических мероприятий можно рассматривать и характер питания. Использование в пище острого перца, чеснока, лука, различных пряностей уменьшало риск заболевания малярией. Кроме культурных традиций имело значение длительное проживание в природном очаге, способствовавшее развитию биологической адаптации и уменьшению неблагоприятного исхода в случае тяжелых форм перемежающейся лихорадки.
Малярия на Кавказе оказала значительное влияние на жизнеспособность населения, адаптацию
ивыживание военнослужащих во время Кавказской войны, а также переселенцев-колонистов из центральной России, прибывших для освоения новых земель. Известный исследователь Кубани Л.В. Македонов писал: «Колонизация предгорий Северо-Западного Кавказа потребовала больших жертв, чем война, так как смертность доходила до ужасающих границ» [7, с. 13].
Активная борьба с малярией развернулась в годы советской власти. В 1922 г. была создана Майкопская городская противомалярийная станция. В 1937 г. на основании приказа и Положения НК здравоохранения СССР на базе объединенных Майкопской городской противомалярийной
станции и малярийной группы Адыгейского областного отдела здравоохранения была образована Адыгейская областная противомалярийная станция.
Являясь научно-практическим учреждением, ведущим активную борьбу с малярией и гельминтозами, руководство станции разрабатывало планы противомалярийных мероприятий. Требования, предъявляемые станцией к хозяйствующим субъектам и лечебно-профилактическим учреждениям по проведению противомалярийных мероприятий, строго выполнялись: это и проведение мелиоративных работ по осушению заболоченных мест, и авиаопыление, нефтевание, засыпка заболоченных территорий, расчистка прудов, профилактическая и лечебная хинизация населения.
В результате проведения комплекса санитарно-эпидемиологических работ медикоэкологическая ситуация в начале 1960-х гг. изменилась. Было объявлено, что малярия как эпидемическое заболевание в СССР ликвидирована, к сожалению, при этом была упразднена и сеть противомалярийных станций. В процессе ликвидации малярии в СССР были уничтожены фенотипы возбудителя, адаптированные к условиям средней полосы и местным видам переносчиков. После окончания противомалярийных работ по осушению заболоченных мест были забыты эпидемиологические механизмы возникновения малярии как трансмиссивной инфекции. В Республике Адыгее активно стали строиться искусственные водоемы.
Сегодня в Адыгее функционируют пять водохранилищ: Краснодарское, Шапсугское, Тахтамукайское, Шенджийское, Майкопское, позволяющие использовать ресурсы поверхностных вод рационально и эффективно. В 1975 г. вступило в строй Краснодарское водохранилище – крупнейшее на Северном Кавказе. После заполнения его водой оно слилось с Тщикским водохранилищем. Однако существующие наносы р. Белой отделяют нижнюю часть бывшего Тщикского водохранилища от остальной акватории. Это приводит к тому, что даже при полной сработке Краснодарского водохранилища в верхней части Тщикского остается небольшой замкнутый объем воды. Последующее развитие дельты р. Белой и активная аккумуляция наносов Кубани привели к практически полному заилению нижней части Тщикского и части Краснодарского водохранилищ на участке, прилегающем к станице Васюринская.
Значительное расширение акватории искусственных водоемов без должного содержания нарушило экологическое равновесие в регионе, что способствует увеличению очагов выплода комаров. Вплоть до глубокой осени население, проживающее по берегам водохранилищ, отчаянно борется с тучами комаров. Соответственно возросли риски возникновения эпидемических очагов трансмиссивных заболеваний. В то же время надо отметить, что малярия является классическим примером заболевания, способного быстро восстанавливать свои позиции при ослаблении контроля. В начале 90-х годов произошло восстановление малярии в сопредельных с Россией республиках Закавказья. В связи с этим возникла необходимость возобновления исследований малярийных комаров на всех территориях, относящихся к зоне риска по малярии. Группой ученых проведены исследования фауны малярийных комаров рода Anopheles семейства Culicidae Республики Адыгея. В изученных местообитаниях в Республике Адыгея и на сопредельной территории Краснодарского края обнаружены четыре вида малярийных комаров: Anopheles messeae, An. maculipennis, An. hyrcanus, An. Claviger. (Приложение 2)
Благоприятные климатические и экологические условия для выплода малярийных комаров, высокая миграция населения и постоянный завоз инфекции из зарубежных очагов определяют Краснодарский край и Адыгею как территории устойчивого риска распространения малярии. Также надо иметь в виду, что изменение климатических условий и активизация миграционных процессов способствуют расширению ареала арбовирусных инфекций.
Установлено, что на низменных территориях Закубанской равнины повсеместно доминирует An. messeae. Вместе с комарами этого вида развиваются личинки An. hyrcanus и An. maculipennis. В предгорьях Западного Кавказа доминирующим видом становится An. maculipennis (табл. 1; выборки 6-7). В ст. Даховской доля комаров этого вида достигает 100%. Родниковый малярийный комар An. claviger обнаружен в изолированном местообитании в пос. Новомихайловка на территории Краснодарского края. Следует отметить, что Закубанская низменность находится на краю видового ареала An. messeae, и на территории Адыгеи проходит южная граница распространения этого вида. Особый интерес представляет проблема взаимодействия малярийных комаров An. messeae и An. maculipennis. Экспериментальные исследования конкуренции личинок этих двух видов показали, что при высокой плотности An. maculipennis превосходит An. messeae. Отмечено разобщение первых генераций двух видов во времени. Выявлено, что An. maculipennis развивается позже, чем An. messeae. Высказано предположение, что устойчивое соотношение двух видов сохраняется в
местообитаниях, где доминирующий вид не успевает вытеснить конкурента в течение сезона размножения. Согласно данным, личинки An. messeae преобладают в равнинных биотопах, несмотря на то, что они находятся на границе видового ареала. Очевидно, что особи An. messeae более жизнеспособны в равнинных местообитаниях, в то время как личинки An. maculipennis имеют конкурентное преимущество в более прохладных биотопах предгорий Западного Кавказа. В результате с запада на восток Республики Адыгея наблюдается резкое изменение индекса доминирования взаимодействующих видов. Высотная зональность позволяет конкурентным видам устойчиво сосуществовать на данной территории. При определении экологических характеристик личиночных биотопов (табл. 2). установлено, что важнейшим экологическим параметром, определяющим видовой состав комаров, служит температура воды. Анализ личиночных биотопов показал, что An. messeae в этом отношении является наиболее экологически пластичным видом. Личинки An. messeae развиваются в диапазоне температур от 19.8 до 33.3 ºС. An. hyrcanus предпочитает хорошо прогреваемые водоемы с температурой воды от 31.0 до 33.3°С и повышенной соленостью от 0.43 до 0.81μs. An. maculipennis и An. claviger преобладали в биотопах с прохладной водой (табл. 2; выборки 6-8). Очевидно, способность личинок An. messeae развиваться в водоемах с разнообразными температурными режимами связана с его внутривидовым хромосомным полиморфизмом, имеющим адаптивное значение.
По-видимому, южная граница ареала An. messeae определяется не условиями развития личинок, а условиями зимовки имаго. На равнине зимние температуры слишком высоки для диапаузирующих самок An. messeae, а в горах этот вид вытесняется в период размножения конкурентом An. maculipennis. Кроме того, An. messeae не встречается в долинах Закавказья, поскольку там обитают более конкурентоспособные южные виды малярийных комаров комплекса
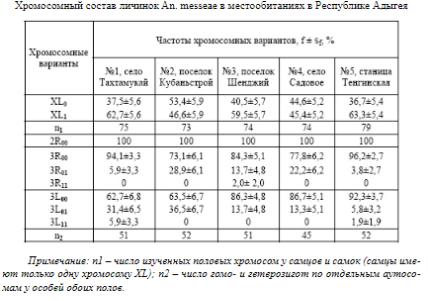
Anopheles maculipennis, такие, как An. melanoon Hacket; An. sacharovi Favre, В результате цитогенетического анализа определен уровень хромосомной изменчивости у малярийного комара An. messeae. В популяциях этого вида на территории Республики Адыгея выявлены следующие хромосомные последовательности: Xl0, Xl1, 2R0, 3R0, 3R1, 3l0, 3l1. Установлено, что уровень хромосомной изменчивости зависит от экологических параметров личиночных биотопов. Одним из таких параметров является содержание кислорода в воде. Биотопы No2 и No4 с высоким содержанием кислорода (от 6.02 до 7.7 O2, mg/l) характеризуются повышенной частотой хромосомных вариантов с инверсиями Xl0 и 3R1 (χ2=4.3 и 13.7; число степеней свободы df=1; p<0,05 и p<0,001 соответственно). Кроме того, показано, что в направлении с запада на восток Закубанской равнины наблюдается снижение частоты гомо- и гетерозигот с инверсией 3l1 (χ2 =
23.6; df = 4; p<0,001).
В целом, изучение хромосомной изменчивости у An. messeae показало, что на территории Республики Адыгея популяции характеризуются низким уровнем инверсионного полиморфизма.
Полностью отсутствует изменчивость хромосомного плеча 2R. Выявлены низкие частоты гомозигот 3R11 и 3l11. В популяциях для особей характерны кариотипы, преимущественно распространенные на юго-западе и юго-востоке видового ареала. Эти краевые популяции значительно отличаются от таковых на юге Средней Азии. В Средней Азии на южной границе видового ареала отсутствуют инверсионные варианты Xl0, но встречаются с высокой частотой гомозиготы 3R11 и 3l11. По-видимому, высокая однородность краевых популяций на европейской и азиатской частях ареала An. messeae снижает адаптивные возможности вида. Однако, несмотря на низкий уровень полиморфизма, особи An. messeae с разными хромосомными вариантами отличались по экологическим предпочтениям (в частности, по отношению к содержанию растворенного кислорода). Очевидно, этим обусловлена более высокая экологическая пластичность An. messeae по сравнению с другими видами малярийных комаров.
Полученные данные по географическому распространению и экологии малярийных комаров позволяют сделать вывод о том, что главным потенциальным переносчиком малярии на Закубанской равнине является An. messeae, а в предгорьях Западного Кавказа на востоке Республики Адыгея - An. maculipennis.
Вывод
1.В изученных местообитаниях в Республике Адыгея и на сопредельной территории Краснодарского края обнаружены 4 вида малярийных комаров: An. messeae, An. maculipennis, An. hyrcanus, An. claviger. установлено, что в низинных районах Закубанской равнины преобладают An. messeae и An. hyrcanus, а в предгорьях – An. maculipennis. малярийный комар An. melanoon не обнаружен.
2. Определена плодовитость гоноактивных самок видов двойников An. messeae и An. maculipennis.
Среднее число яиц в кладке у An. messeae составило 197.1±11.2; у An. maculipennis – 169.2±16.7. 3. В популяциях An. messeae выявлены хромосомные последовательности: Xl0, Xl1, 2R0, 3R0, 3R1, 3l0, 3l1. Установлено, что в биотопах с повышенным содержанием кислорода наблюдается повышенная частота хромосомных вариантов с инверсиями Xl0 и 3R1. Показано, что в направлении с запада на восток Закубанской равнины происходит снижение частоты гомо- и гетерозигот с инверсией 3l1
Приложения: Приложение 1
Приложение 2
Таблица № 1
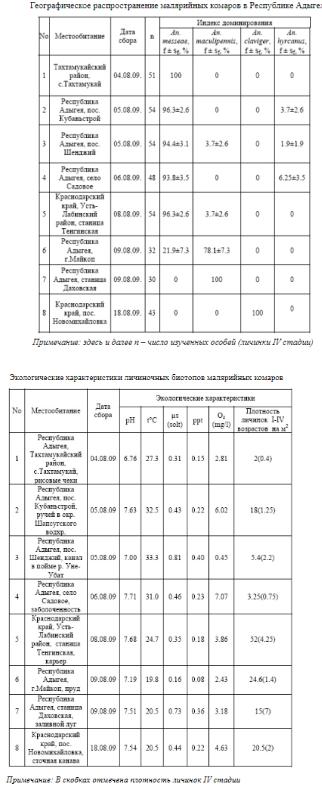
Таблица № 2
Таблица № 3
Список литературы
1.Чебышева Н.В., Сергиева В.П. Медицинская протозоология: паразитические простейшие человека. Учеб.пособие. — М.: ГЭОТАР-Медиа, 2012. — 264 с
2.Гордеев М.И., Москаев А.В., Перевозкин В.П.. Анализ видового и хромосомного состава малярийных комаров республики Адыгея // Географическая среда и живые системы – 2010 - № 3 -
64-71 |
/ [Электронный |
ресурс] |
- |
Режим |
доступа: |
URL: |
https://www.geoecosreda.ru/jour/article/view/888/858 |
|
|
|
|
||
3.Тхагапсова Г.Г. К проблеме медико-экологического мониторинга состояния здоровья населения Республики Адыгея // Вестник АГУ – 2016 - №1 / [Электронный ресурс] – Режим доступа: URL: https://cyberleninka.ru/article/n/k-probleme-mediko-ekologicheskogo-monitoringa- sostoyaniya-zdorovya-naseleniya-respubliki-adygeya/viewer
4.Полищуков И. И., Мельникова Т. Н. МОНИТОРИНГ ВОДОХРАНИЛИЩ РЕСПУБЛИКИ АДЫГЕЯ // Международный журнал экспериментального образования. – 2019. – № 10-1. – С. 5354;
URL:https://expeducation.ru/ru/article/view?id=8504 (дата обращения: 12.04.2023).
5.Ковалёва И. М.. 25 Апреля 2022 – Всемирный день борьбы с малярией/ Ковалёва И. М. // Дружба. – 2022 – 20 апреля / [Электронный ресурс] – Режим доступа: URL: https://kr- drugba.ru/2022/04/20/25-апреля-2022-всемирный-день-борьбы-с-мал/
6.Александров П.А. (врач-инфекционист). Малярия – симптомы и лечение – 2018 – 2 августа / https://probolezny.ru/malyariya/[Электронный ресурс] – Режим доступа: URL: https://probolezny.ru/malyariya/
РАДИАЦИОННО-ИНДУЦИРОВАННАЯ ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА Автор: Данильчук Н.О.
Научные руководители: Алексеев В.В., Арутюнян Г.А.
Ключевые слова: ишемическая болезнь сердца, лучевая терапия, кадиотоксичность, миокард, атеросклероз.
Введение. Современная радиотерапия (РТ) позволяет сохранять жизнь и работоспособность больных с опухолью органов грудной клетки в течение десятилетий [1]. Смертность от онкологических заболеваний снижается, отмечается устойчивая тенденция к увеличению выживаемости. Но при успешном лечении онкологического заболевания прогноз жизни определяется уже не основным, а сопутствующими заболеваниями, и в первую очередь – патологией сердечно-сосудистой системы (ССС). По статистике, онкологическое заболевание является причиной смертности только у половины больных, переживающих рак, тогда как у одной трети из них смерть наступает от сердечно-сосудистых заболеваний (ССЗ) [2]. Поэтому, постлучевое поражение сердца является одним из краеугольных вопросов лечения. Необходимость длительного наблюдения онкологических пациентов после лучевой терапии (ЛТ) является одним из актуальных вопросов практического здравоохранения. В данной работе приводится анализ
современных данных по диагностике и лечению радиационно-индуцированной ишемической болезни сердца (ИБС).
Основная часть. Кардиотоксичность является причиной прямого воздействия лечения на сердечную функцию и структуру или причиной ускоренного развития сердечно-сосудистых заболеваний в присутствии известных факторов риска. Радиотерапия грудной полости может поражать все структурные компоненты сердца, включая перикард, миокард, сердечные клапаны, коронарные артерии и капилляры, проводящую систему. К факторам риска для радиационноиндуцированной ишемии сердца относятся: возраст во время проведения курса лучевой терапии, общая доза облучения, которая не должна превышать 30 Гр/мм2, объем облученной ткани, когда облучению подвергается 65% и более объема сердца [3]. Молодой возраст (больше 25 лет) во время лучевой терапии [4] и высокая доза облучения связаны с увеличением риска развития радиационноиндуцированной ИБС. Термин «радиационно-индуцированная болезнь сердца» [5], появившийся в 60-х годах, отражал комплекс клинически манифестирующих структурных поражений тканей сердца, развившихся в результате облучения этой области. Существует временной интервал между воздействием ЛТ и развитием ИБС. У пациентов после лечения лимфомы Ходжкина среднее время развития ишемической болезни сердца может составлять от 2 до 40 лет, а у пациентов с раком молочной железы около 9–10 лет [6]. Радиационное поражение характеризуется как острыми, так и хроническими изменениями сердечной ткани. В течение нескольких минут после воздействия ионизирующего излучения повреждение клеток вызывает вазодилатацию и повышенную проницаемость сосудов, при этом сами кардиомиоциты устойчивы к радиации. Однако при использовании лечения РТ осложнений значительно возрастает, т. к. основным триггером сосудистых нарушений является эндотелиальная дисфункция.
В этой связи у пациентов после воздействия лучевой терапии виден лучевой ожог эндотелия коронарных артерий, что вызывает воспалительную реакцию в стенке сосуда, в результате высвобождается большое количество цитокинов, ответственных за активацию макрофагов, и как следствие – отложение липопротеинов. Снижение продукции вазоактивных веществ, в том числе оксида азота, наряду с повышением уровня протромботических факторов, приводит к обструкции сосудов микроциркуляторного русла, ишемии, гибели кардиомиоцитов. Атеросклеротические бляшки могут растрескиваться и вызывать тромбоз. В эпикардиально расположенных крупных коронарных артериях развивается фиброз всех слоев сосудистой стенки. В отличие от «классической» атеросклеротической бляшки (АсБ) в ускоренном режиме при радиационноиндуцированном поражении коронарных артерий развиваются АсБ более пролонгированные, гладкие, с выраженным фиброзным компонентом, с меньшим содержанием липидов и более выраженной гиперплазией интимы [7]. Этот процесс в ускоренном режиме в разной степени уменьшает просвет артерии, что приводит к клиническим проявлениями ИБС: стабильной и нестабильной стенокардии, ишемии миокарда.
Атеросклероз проявляется морфологически АсБ в артериях крупного и среднего калибра очаговых, плотных утолщений интимы [8], суживающих просвет. Микроскопически атеромы имеют следующую структуру: поверхность покрыта фиброзной капсулой, состоящей из коллагеновых волокон с диффузным гиалинозом, под капсулой находится некротический центр или ядро, содержащее некротические массы, внутри- и внеклеточные липиды (в особенности холестерин и его эстеры), пенистые клетки (макрофаги и гладкомышечные клетки, содержащие липиды), коллаген, фрагменты разрушенных эластических волокон, фибрин и другие белки плазмы крови, макрофаги, лимфоциты, соли кальция. На периферии атеромы отмечается новообразование сосудов (ангиогенез). Глубже от некротического центра находится атрофированная и фиброзированная средняя оболочка (медия). Эти компоненты атеромы могут иметь разные пропорции. В «стабильных» атеромах фиброзная капсула утолщена, плотная, некротический центр и воспаление слабо выражены, преобладает фиброз. В «нестабильных» («ранимых») бляшках капсула тонкая, нежная, некротический центр богат липидами, воспаление активное; такие бляшки предрасположены к эрозиям, изъязвлениям, тромбозам, кровоизлияниям, что приводит к острой ишемии зон, кровоснабжаемых данным сосудом. При атеросклерозе коронарных артерий стеноз приводит к хронической ишемии и диффузному кардиосклерозу, а острая ишемия – к инфаркту миокарда. Тем самым, воздействие радиотерапии может привести к тому. Что «стабильные» атеросклеротические бляшки могут перейти в «нестабильные», что в свою очередь приведёт к тромбозу и , следовательно, к инфаркту миокарда.
Ввиду того, что АсБ может растрескиваться и образовывать тромбоз хронической травматизации эндотелиоцитов (в частности при артериальной гипертонии, в результате воздействия радиотерапии
на иммунологические реакции, нарушается способность эндотелия к полноценному функционированию с дальнейшим развитием повреждения подлежащих тканей сосуда циркулирующими в крови веществами [9]. Запускается защитная реакция, заключающаяся в продукции молекул клеточной адгезии; моноциты и Т-лимфоциты прикрепляются к поверхности клеток поврежденного эндотелия, сюда же прикрепляются богатые липидами пенистые клетки, формируя жировую полоску, которая в дальнейшем превращается в атеросклеротическую бляшку, сужающую просвет кровеносного сосуда. Накопление тромбоцитов и высвобождение тромбоцитарных гранул (особенно – тромбоцитарного фактора роста) в местах такого повреждения приводит к пролиферации гладкомышечных и соединительнотканных элементов, создавая в итоге основу для последующей инфильтрации сосудистой стенки липопротеинами. Кроме того, немаловажную роль играет инфильтрация стенки сосуда клетками моноцитарного ряда, так как трансформация поглощающих липопротеиновые массы макрофагов в пенистые клетки является одним из ключевых этапов развития атеросклеротических изменений, т. к. запускается защитная реакция, заключающаяся в продукции молекул клеточной адгезии; моноциты и Т-лимфоциты прикрепляются к поверхности клеток поврежденного эндотелия, сюда же прикрепляются богатые липидами пенистые клетки, формируя жировую полоску, которая в дальнейшем превращается в атеросклеротическую бляшку, сужающую просвет кровеносного сосуда. В случае повреждения бляшки и выхода ее содержимого, возможна закупорка сосуда, которая приведет к прекращению кровотока и развитию инфаркта миокарда.
Развитие современных методов визуализации позволяет своевременно выявить пациентов с потенциальным риском развития кардиотоксичности, которым требуется дальнейший сердечнососудистый мониторинг или кардиопротекторная терапия. Такие методы, как ЛТ под визуальным контролем (IGRT), IMRT и SBRT обеспечивают эффективное и избирательное лучевое воздействие на опухоль и максимально щадящее воздействие на прилегающие ткани [10]. Также оценка ишемии миокарда должна проводиться согласно общепринятым рекомендациям по диагностике ишемической болезни сердца. Диагностика включает ЭКГ, ЭхоКГ, мультиспиральная компьютерная томография (МСКТ) коронарных артерий, МРТ сердца, а также стресс-тесты с физической или медикаментозной нагрузкой. Использование современных технологий протонной терапии вместо традиционного фотонного облучения у пациентов с раком молочной железы и лимфомой Ходжкина представляется перспективным с точки зрения снижения риска сердечнососудистых осложнений. А реваскуляризация миокарда способствует восстановлению и поддержанию кровотока в сосудах путём хирургического вмешательства.
Выводы. При успешном лечении онкологических болезней к пациентам требуется повышенная настороженность, поскольку риск развития ишемической болезни сердца сохраняется и увеличивается через десятилетия после лучевой терапии. В связи с этим важно учитывать факторы риска, связанные с лучевым поражением, и своевременно диагностировать патологию. Тщательная оценка патологии миокарда и коронарной анатомии должна проводиться перед принятием решения о выборе тактики реваскуляризации миокарда у пациентов после лучевой терапии. Такой подход позволит минимизировать осложнения и улучшить прогноз у данной категории пациентов.
Список литературы:
1.Дундуа Д.П., Стаферов А.В., Сорокин А.В., Кедрова А.Г. Кардиоонкология: влияние химиотерапевтических препаратов и лучевой терапии на сердечно-сосудистую систему (обзор). / Д.П. Дундуа, А.В. Стаферов, А.В. Сорокин, А.Г. Кедрова // Клиническая практика № 4. – 2016. – С. 41–48.
2.Каприн А.Д., Мацкеплишвили С.Т., Потиевская В.И., Поповкина О.Е., Болотина Л.В., Шкляева А.В., Полуэктова М.В. Сердечно-сосудистые заболевания у онкологических пациентов. / А.Д. Каприн, С.Т. Мацкеплишвили, В.И. Потиевская, О.Е. Поповкина, Л.В. Болотина, А.В. Шкляева, М.В. Полуэктова // Онкология. Журнал им. П.А. Герцена. – 2019. – Т.8, № 2. – С. 139–
147.
3.Махамадходжаева М.А., Ибодулла Дониев Факторы риска сердечно-сосудистых заболеваний. / М.А. Махамадходжаева, Ибодулла Дониев // Scientific progress. – 2021. –Т.2, №6. С.
1902-1906.
4.Van Nimwegen F.A., Schaapveld M., Janus C.P. Cardiovascular disease after Hodgkin lymphoma treatment: 40year disease risk. / F.A. Van Nimwegen, M. Schaapveld., C.P. Janus // JAMA Intern Med. – 2015. – № 175. –С. 1007– 1017. DOI: 10.1001 / jamainternmed.2015.1180
5.Левчук М.Н., Бондаренко Б.Б. Радиационные поражения сердца. / М.Н. Левчук, Б.Б. Бондаренко // Доктор.ру. –2013. – № 2. – С. 25-27. – DOI: 1727-2378.
