
- •В.Г. Крыштоп, н.И. Филиппова основы атомнОй и ядернОй физикИ
- •Введение
- •1. Тепловое излучение
- •2. Фотоэффект
- •3. Тормозное рентгеновское излучение
- •Эффект Комптона
- •Примеры решения задач
- •Проектное задание
- •Модуль 1. Полуклассические теории строения атома Комплексная цель модуля
- •1.1. Первая физическая модель атома – модель Томпсона
- •1.2. Опыт Резерфорда. Планетарная модель атома.
- •1.3. Спектральные закономерности
- •1.4. Постулаты Бора. Опыты Франка и Герца
- •1.5. Боровская модель атома водорода
- •1.6. Магнитный момент атома водорода
- •1.7. Гипотеза де-Бройля
- •1.8. Принцип неопределенности
- •1.9. Примеры решения задач
- •Выполните следующие задания
- •1.10. Тесты рубежного контроля
- •1.10. Принципы оценивания
- •Модуль 2. Основы квантовой механики Комплексная цель модуля
- •2.1 Уравнение Шредигера
- •2.2. Частица в прямоугольной яме
- •2.3. Потенциальные барьеры
- •2.4. Туннельный эффект.
- •2.5. Квантование момента импульса
- •2.6. Атом водорода
- •2.7. Спин электрона
- •2.8. Полный момент импульса электрона.
- •2.9. Примеры решения задач
- •2.10. Тесты рубежного контроля
- •2.11. Принципы оценивания
- •Заключение
- •Ответы на тесты рубежного контроля
- •Литература
- •Содержание
1.5. Боровская модель атома водорода
Чтобы получить согласие с результатами наблюдений, Бор предположил, что электрон в атоме водорода движется только по тем круговым орбитам, для которых его момент импульса
М = пħ, n = 1, 2, 3, ..., (1.18)
где п — квантовые числа.
С помощью этого правила квантования можно найти радиусы круговых стационарных орбит водородоподобных систем (Н, Не+, Li++...) и соответствующие им энергии. Пусть заряд ядра водородоподобной системы равен Ze. Масса ядра значительно больше массы электрона, поэтому ядро при движении электрона можно считать неподвижным. Следуя Бору, будем предполагать, что электрон движется вокруг ядра по окружности радиуса r.
Согласно 2-му закону Ньютона
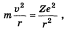 (1.19)
(1.19)
где т —масса электрона. Отсюда кинетическая энергия электрона
 (1.20)
(1.20)
и полная энергия электрона в кулоновском поле ядра
 (1.21)
(1.21)
Согласно правилу квантования (1.18), rmV = nħ, откуда
V= nħ /rm. (1.22)
После подстановки (1.22) в (1.19) подучим выражение для радиуса n-й стационарной орбиты:
 (1.23)
(1.23)
Радиус первой стационарной орбиты электрона в атоме водорода (п = 1, Z = 1) равен
rn = ħ2 /те2 = 0,529·10-10 м. (1.24)
Его называют боровским радиусом.
Энергия Еп электрона на n-й стационарной орбите определяется формулой (1.21), в которой под г надо понимать (1.23). И мы приходим к следующему выражению для Еп:
 (1.25)
(1.25)
Эта формула описывает уровни энергии стационарных состояний электрона в водородоподобной системе. Для атома водорода схема энергетических уровней, соответствующих (1.25), показана на рис. 1.7. При п -><» уровни энергии сгущаются к своему предельному значению Ек = 0.
Состояние
атома с наименьшей энергией (п = 1) называют
основным.
Для
атома водорода основному состоянию
соответствует энергия Ei
= -13,53
эВ. Эта энергия (по модулю) является
энергией
связи электрона
в основном состоянии:
Есв
= Ei.
Именно
такую энергию надо
сообщить электрону в основном состоянии
(п = 1), чтобы удалить его из атома
водорода. По этой причине ее называют
еще и энергией
ионизации:
£ион = Есв = 13,6 эВ.
Это значение, полученное из боровскои теории атома, находится в хорошем согласии с результатами эксперимента.
1.6. Магнитный момент атома водорода
Пусть электрон движется со скоростью v по орбите радиусом г (рис. 1.8). Через площадку, пересекающую орбиту электрона, переносится ежесекундно заряд ev, где е — заряд электрона, v — число оборотов электрона вокруг ядра в секунду. Следовательно, движущийся по орбите электрон образует круговой ток I = ev. Поскольку заряд электрона отрицателен, направление движения электрона противоположно направлению тока.

Магнитный момент такого тока по определению равен μ = IS, или μ = ev·r2. Учитывая, что 2 rv = V и, перепишем предыдущее выражение в виде

 .
.
Остается учесть, что момент импульса электрона М = rmv, и мы получим:

 (1.33)
(1.33)
где знак минус указывает, что направления обоих моментов, μ и М, взаимно противоположны.
Вектор М называют орбитальным моментом электрона. Он образует с направлением движения электрона правовинтовую систему (см. рис. 1.8).
Отношение магнитного момента частицы к ее механическому моменту называют гиромагнитным отношением. Для электрона оно равно

 (1.34)
(1.34)
Воспользовавшись воровским правилом квантования момента импульса, т. е. формулой (1.18), перепишем (1.33) в виде
μ = μБ n , п = 1, 2, 3, ..., (1.35)
где μБ — это так называемый магнетон Бора:
μБ
= 
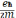 = 0,927 • 10-24
Дж/Т (1.36)
= 0,927 • 10-24
Дж/Т (1.36)
Таким образом, при движении электрона по первой воровской орбите (п = 1) его магнитный момент равен одному магнетону Бора. В дальнейшем мы увидим, что это резко расходится с экспериментом, значит, полученный результат оказывается совершенно неверным. И тем не менее, мы привели формулы, связывающие магнитный момент с механическим, поскольку они послужат основой для получения правильных результатов .
Недостатки теории Бора. Теория Бора явилась крупным шагом в развитии теории атома, в понимании новых квантовых закономерностей, с которыми столкнулась физика при изучении явлений микромира. Эта теория отчетливо показала неприменимость законов классической физики для описания внутриатомных явлений
Теория Бора стимулировала постановку многих экспериментов, принесших важные результаты. Даже в тех многочисленных случаях, когда теория не могла дать количественное объяснение явлений, два постулата Бора служили руководящей нитью при классификации и количественной интерпретации этих явлений.
Однако двух постулатов Бора недостаточно для построения полной теории. Они должны быть дополнены правилами квантования. Эти правила, достаточно искусственно введенные Бором для одноэлектронного атома, радикально проблемы не решили. Их не удалось распространить даже на простейший после водорода атом гелия, содержащий два электрона. Кроме того, теория Бора позволила вычислить только частоты спектральных линий, но не их интенсивность.
Основной же, принципиальный недостаток теории Бора — это ее непоследовательность: она не была ни последовательно классической, ни последовательно квантовой. Эта теория принимала существование стационарных состояний атома, что совершенно непонятно с точки зрения классической физики. И вместе с тем к движению электронов в стационарных состояниях она применяла законы классической механики, хотя и считала неприменимой классическую электродинамику (поскольку нет излучения).
Итак, планетарную модель атома нельзя считать серьезной теорией. Она просто неверна. Тот факт, что эта модель приводит к очень хорошим результатам в случае атома водорода (при расчете некоторых величин), по существу случайный. Этот успех явился мощным толчком к развитию квантовой теории атома. Сам Бор рассматривал свою теорию как промежуточный этап в поисках верной теория. Такой последовательной теорией явилась квантовая физика.
