
- •Патологічна анатомія
- •Атеросклероз
- •Атеросклероз аорти
- •Симптоматичні гіпертензії
- •Ревматичні хвороби
- •Ревматизм (хвороба Сокольського-Буйо)
- •Поліартритична форма
- •Нодозна форма ревматизму
- •Ревматоїдний артрит
- •Хвороба Бєхтєрєва (Штрюмпеля-Марі)
- •Системний червоний вовчак (хвороба Лібмана-Сакса)
- •Системна склеродермія
- •Дерматоміозіт
- •Вузликовий периартеріїт (хвороба Куссмауля – Мейера)
- •Системні васкуліти
- •Алегрічний еозинофільний гранулематозний ангіїт (синдром Чарга-Стросса)
- •Геморагічний васкуліт
- •Облітеруючий тромбангиїт (хвороба Бюргера)
- •Темпоральний ангіїт (хвороба Хортона)
- •Ендокардит Леффлера
- •Набуті вади серця
- •Гастрити
- •Виразки 12-палої кишки
- •Гепатити
- •Вірусні гепатити
- •Вірусний гепатит а
- •Вірусний гепатит в
- •Хронічний вірусний гепатит в
- •Індекс гістологічної активності (за r. J. Knodell et al., 1981)
- •Напівкількісна система обліку ступеня фіброзу печінки при визначенні стадії хронічного гепатиту ( в.В. Серов, 1996)
- •Вірусний гепатит d (дельта-гепатит)
- •Вірусний гепатит с
- •Вірусний гепатит е
- •Вірусний гепатит g
- •Вірусний гепатит ні а – ні е
- •Вірусний гепатит ttv
- •Вірусний гепатит f (?)
- •Хронічний вірусний гепатит невідомого типу
- •Цироз печінки
- •Патогенез і морфогенез
- •Патологічна анатомія
- •Причини смерті від цирозу печінки
- •3) Гуморальні фактори загального захисту -Ig м, Іg і.
- •4) Клітинні фактори:
- •Хронічний бронхіт
- •1) Легеневі:
- •2) Позалегеневі:
- •Хронічний абсцес легенів.
- •Інтерстиційна хвороба легенів (іхл)
- •Пневмосклероз, пневмофіброз, пневмоцироз
- •Плеврит
- •Рак легенів
- •Гостра ниркова недостатність (гнн).
- •Хронічна ниркова недостатність
- •Первинний туберкульоз
- •Гематогенний туберкульоз
- •Парагрип
- •Респіраторно-синцитіальна інфекція
- •Аденовірусна інфекція
- •Віл-інфекція та синдром набутого імунодефіциту
- •Дифтерія
- •Скарлатина
- •Черевний тиф
- •Vibrio cholerae eltor.
Віл-інфекція та синдром набутого імунодефіциту
За оцінкою Об’єднаної програми ООН з ВІЛ/СНІД та Всесвітньої організації охорони здоров’я (ВООЗ), з 1981 по 2009 рік від хвороб, пов’язаних з ВІЛ-інфекцією та СНІД померли 25 мільйонів чоловік. Таким чином, пандемія ВІЛ-інфекції є однією з найбільш згубних в історії людства. Тільки в 2006 році ВІЛ-інфекція стала причиною смерті близько 2,9 мільйонів чоловік. На початок 2007 року у всьому світі близько 40 мільйонів чоловік (0,66 % населення Землі) були носіями ВІЛ. Дві третини із загального числа ВІЛ-інфікованих живуть в країнах Африки, на південь від пустелі Сахари. У найбільш постраждалих країнах пандемія ВІЛ-інфекції та СНІД перешкоджає економічному зростанню і збільшує бідність населення.
ВІЛ-інфекція – це хвороба, що розвивається в результаті довготривалої персистенції вірусу імунодефіциту людини (ВІЛ) в лімфоцитах, макрофагах та клітинах нервової тканини, і характеризується повільно прогресуючою дисфункцією імунної системи.
Синдром набутого імунного дефіциту (СНІД) – кінцева стадія ВІЛ-інфекції, перебігає з ураженням імунної та нервової систем і проявляється розвитком важких вірусних, бактеріальних, паразитарних уражень і (або) злоякісних новоутворень, які призводять до смерті хворого.
Історія відкриття. Вірус імунодефіциту людини був відкритий в 1983 році в результаті дослідження етіології СНІД. Першими офіційними науковими повідомленнями про СНІД стали дві статті про незвичайні випадки розвитку пневмоцистної пневмонії та саркоми Капоші у чоловіків-гомосексуалістів, опубліковані в 1981 році. У липні 1982 року вперше для позначення нової хвороби був запропонований термін СНІД (AIDS). У вересні того ж року, на основі ряду опортуністичних інфекцій, діагностованих у чоловіків-гомосексуалістів, наркоманів, хворих на гемофілію A та гаїтян, вперше було дано повноцінне визначення СНІД як хвороби. Паралельно велися роботи над гіпотезою про можливу інфекційну природу СНІД. Вірус імунодефіциту людини незалежно відкрили в 1983 році в двох лабораторіях: в Інституті Пастера у Франції під керівництвом Люка Монтаньє (Luc Montagnier) та в Національному інституті раку в США під керівництвом Роберта Галло (Robert C. Gallo). Результати досліджень, в яких з тканин пацієнтів вперше вдалося виділити новий ретровірус, були опубліковані 20 травня 1983 року в журналі Science. У цих статтях повідомлялося про виявлення нового вірусу, що належить до групи HTLV вірусів. Дослідники висували припущення, що виділені ними віруси можуть викликати СНІД. 4 травня 1984 року дослідники повідомили про виділення вірусу, що вже носив на той момент назву HTLV-III, з лімфоцитів у 26 з 72 обстежених хворих на СНІД та у 18 з 21 хворих з пре-СНІД станом. У жодного з 115 здорових гетеросексуальних індивідів контрольної групи вірус виявити не вдалося. Дослідники відзначили, що малий відсоток виділення вірусу з крові хворих на СНІД викликаний малою кількістю Т4 лімфоцитів, клітин, в яких, ймовірно, розмножується ВІЛ. Крім того, вчені повідомили про виявлення антитіл до вірусу, про ідентифікацію раніше описаних у інших осіб вірусів і раніше невідомих антигенів HTLV-III та про спостереження розмноження вірусу в популяції лімфоцитів.
У 1986 році було виявлено, що віруси, відкриті в 1983 році французькими і американськими дослідниками, генетично ідентичні. Первинні назви вірусів були скасовані і запропонована одна загальна назва – ВІЛ (вірус імунодефіциту людини). У 2008 році Люк Монтаньє і Франсуаза Барре-Синуссі були удостоєні Нобелівської премії в області фізіології та медицини «за відкриття вірусу імунодефіциту людини».
Етіологія. Вірус імунодефіциту людини (ВІЛ) відносять до родини ретровірусів (Retroviridae), роду лентивірусів (Lentivirus).
В ірус
імунодефіциту людини. Видно будову
вірусу: зовнішню оболонку та розташований
в центрі конусоподібний кор. Вірусна
РНК розташована в його розширених
відділах у вигляді електронно-щільних
зон.
ірус
імунодефіциту людини. Видно будову
вірусу: зовнішню оболонку та розташований
в центрі конусоподібний кор. Вірусна
РНК розташована в його розширених
відділах у вигляді електронно-щільних
зон.
Назва Lentivirus походить від латинського слова lente – повільний. Така назва віддзеркалює одну з особливостей вірусів цієї групи, а саме – повільну і неоднакову швидкість розвитку інфекційного процесу в макроорганізмі. Для лентивірусів також характерний тривалий інкубаційний період.
Для ВІЛ характерна висока частота генетичних змін, що виникають в процесі самовідтворення. Частота виникнення генетичних помилок при реплікації ВІЛ складає 10-3-10-4 помилок (геном * цикл реплікації), що на декілька порядків вище аналогічної величини у еукаріот. Довжина генома ВІЛ складає приблизно 104 нуклеотидів. З цього виходить, що практично кожен вірус хоч би на один нуклеотид відрізняється від свого попередника. В природі ВІЛ існує у вигляді безлічі квазі-видів, залишаючись при цьому однією таксономічною одиницею. В процесі дослідження ВІЛ все-таки були виявлені різновиди, які значно відрізнялися один від одного за декількома ознаками, зокрема різною структурою геному. На сьогоднішній день відомі ВІЛ-1, ВІЛ-2, ВІЛ-3, ВІЛ-4:
• ВІЛ-1 – перший представник групи, відкритий в 1983 році. Є найбільш поширеною формою;
• ВІЛ-2 – вид вірусу імунодефіциту людини, ідентифікований в 1986 році. Відрізняється від ВІЛ-1 структурою геному. Відомо, що ВІЛ-2 менш патогенний і передається з меншою вірогідністю, ніж ВІЛ-1;
• ВІЛ-3 – рідкісний вид, про відкриття якого було повідомлено в 1988 році. Виявлений вірус не реагував з антитілами інших відомих груп, а також володів значними відмінностями в структурі геному;
• ВІЛ-4 – рідкісний вид вірусу, виявлений в 1986 році.
Глобальна епідемія ВІЛ-інфекції головним чином обумовлена розповсюдженням ВІЛ-1, та поширеним переважно в Західній Африці ВІЛ-2. ВІЛ-3 і ВІЛ-4 не грають помітної ролі в розповсюдженні епідемії. У переважній більшості випадків, якщо не вказано окремо, під ВІЛ розуміється ВІЛ-1.
Віруси мають вид сферичних частинок, діаметром 100-120 нм. Капсид зрілого віріона має форму усіченого конусу. Іноді зустрічаються «багатоядерні» віріони.
Всередині капсиду ВІЛ знаходиться білково-нуклеїновий комплекс: дві нитки вірусної РНК, вірусні ферменти (зворотна транскриптаза, протеаза, інтеграза) та білки (p7, nef, vif, vpr). Сам капсид утворений ~2000 копій вірусного білка p24. Крім того, з капсидом ВІЛ-1 (але не ВІЛ-2) зв’язуються ~200 копій клітинного циклофіліну А, який вірус запозичує у зараженої клітини.
Капсид ВІЛ оточений матричною оболонкою, яка утворена ~2000 копій матричного білка p17. Матрична оболонка, у свою чергу, оточена двошаровою ліпідною мембраною, що є зовнішньою оболонкою вірусу. Вона утворена молекулами, захопленими вірусом під час його відбруньковування з клітини в процесі реплікації. В ліпідну мембрану вбудовані 72 глікопротеїнові комплекси, кожен з яких утворений трьома молекулами трансмембранного глікопротеїну (gp41 або ТМ), що служить «якорем» комплексу, та трьома молекулами поверхневого глікопротеїну (gp120 або SU). За допомогою gp120 вірус приєднується до антиген-CD4 рецептора та Co-рецептору, що знаходяться на поверхні мембрани клітин-мішеней. У ліпідній мембрані вірусу також знаходяться мембранні білки клітин, зокрема людські лейкоцитарні антигени (HLA) класів I, II та молекули міжклітинної адгезії.

Схематична будова вірусу імунодефіциту людини.
Огляд глобальної епідеміології ВІЛ-інфекції/СНІД. Всього в світі близько 40 мільйонів чоловік живуть з ВІЛ-інфекцією. Більше двох третин з них населяють Африку на південь від пустелі Сахара. Епідемія почалася тут в кінці 1970-х – початку 1980-х років. За епіцентр вважається смуга, що протягнулася від Західної Африки до Індійського океану. Потім ВІЛ перекинувся південніше. Більше всього носіїв ВІЛ в ПАР – близько 5 мільйонів. Але в перерахунку на душу населення цей показник вище в Ботсвані і Свазіленді. У Свазіленді інфікований кожен третій дорослий. За винятком країн Африки, сьогодні швидше за все ВІЛ розповсюджується в Центральній Азії та Східній Європі. З 1999 по 2002 роки кількість інфікованих тут майже потроїлася. Ці регіони стримували епідемію до кінця 1990-х, а потім кількість заражених почало різко збільшуватися – в основному за рахунок наркоманів.
ВІЛ-інфекція в Україні.
Перший випадок ВІЛ інфекції в СРСР був виявлений в 1986 році. З цієї миті починається так званий період зародження епідемії. Перші випадки ВІЛ-інфекції серед громадян СРСР як правило відбувалися унаслідок незахищених статевих контактів з африканськими студентами в кінці 70-х років XX століття. Короткий спалах ВІЛ-інфекції спочатку 90-х років не набув подальшого поширення. В цілому даний період епідемії відрізнявся надзвичайно низьким рівнем інфікування (на весь СРСР менше 1000 виявлених випадків) населення. На той момент в західних країнах епідемія вже була значущою причиною смертності у віковій групі від 20 до 40 років.
Дана сприятлива епідемічна обстановка призвела до згортання деяких широких протиепідемічних програм, як недоцільних та надзвичайно коштовних. Все це призвело до того, що в 1993-95 роках епідеміологічна служба України була нездатна вчасно локалізувати два спалахи ВІЛ-інфекції, що сталися серед споживачів ін’єкційних наркотиків в Миколаєві та Одесі. Як виявилось згодом, ці спалахи були незалежно викликані різними вірусами, що відносяться до різних субтипів ВІЛ-1. Тільки за два роки (1994-95) в Одесі та Миколаєві було виявлено декілька тисяч ВІЛ-інфікованих. З цієї миті на території колишнього СРСР починається наступна стадія епідемії ВІЛ-інфекції, так звана концентрована стадія, яка продовжується по теперішній час (2010 рік). Дана стадія характеризується рівнем ВІЛ-інфекції 5 та більше відсотків в певній групі ризику (в Україні та Росії це ін’єкційні наркомани). У 1995 році відбувається спалах ВІЛ-інфекції в Калінінграді, потім послідовно в Москві та Санкт-Петербурзі, далі спалахи йшли один за одним по всій Росії в напрямі із заходу на схід. Напрям руху епідемії та молекулярно-епідеміологічний аналіз показали, що 95% всіх вивчених випадків ВІЛ-інфекції в Україні та Росії мають своє походження від початкових спалахів в Миколаєві та Одесі. В цілому, дана епідеміологічна стадія інфекції характеризується концентрацією ВІЛ-інфекції серед ін’єкційних наркоманів, низькою генетичною різноманітністю вірусу, поступовим переходом епідемії з групи ризику в інші популяції.
Шляхи передачі ВІЛ.
ВІЛ нестійкий поза середовищем організму, при висиханні крові (сперми, лімфи і вагінального секрету) гине. ВІЛ практично миттєво гине при температурі вище 56°С. ВІЛ може міститися практично у всіх біологічних рідинах організму. Проте, достатня для зараження кількість вірусу присутня тільки в крові, спермі, вагінальному секреті, лімфі і грудному молоці (грудне молоко небезпечне тільки для немовлят – в їх шлунку ще не виробляється шлунковий сік, який вбиває ВІЛ). Вміст вірусу в інших біологічних рідинах – слині, сльозі – нікчемне малий; немає інформації про випадки зараження через слину, сльози, піт.
Зараження ВІЛ відбувається тільки від інфікованої людини. Існують три основні шляхи передачі ВІЛ:
1) статевий;
2) через кров та інші біологічні рідини, забруднені ними голки й інструменти, при трансплантації органів;
3) перинатальний – від матері дитині під час вагітності і пологів (вертикальний) і при грудному вигодовуванні (горизонтальний). Зараження дітей ВІЛ, як правило, відбувається перинатально.
Патогенез. Основною мішенню ВІЛ у периферичній крові є Т лімфоцити, що несуть на своїй поверхні CD4+ рецептори – CD4+ Т-лімфоцити. Крім Т-хелперів, CD4+ рецептори, що обумовлюють сприйнятливість клітин до ВІЛ, розташовані також на по верхні моноцитів та макрофагів. До зараження ВІЛ сприйнятливі фолікулярні дендритичні клітини, мегакаріоцити, еозинофіли, астроцити, олігодендроцити, клітини мікроглії, CD8+ Т-лімфоцити, В-лімфоцити, епітеліальні клітини ниркових канальців та шийки матки, клітини слизової оболонки травного тракту, гепатоцити, фібробласти легень, кардіоміоцити, епітеліальні клітини слинних залоз, клітини пігментного епітелію сітківки, простати, яєчок, надниркових залоз та інші.
Зниження кількості дендритичних клітин, що є професійними антиген-презентуючими клітинами (в основному і починають імунну відповідь до патогенного чинника) по важливості наслідків для імунної системи є навіть більш значущим чинником ніж загибель Т-хелперів. Причини загибелі дендритичних клітин залишаються нез’ясованими.
Причини загибелі Т-лімфоцитів хелперів:
Апоптоз CD4+ лімфоцитів вважається за основний механізм. Навіть на стадії СНІД рівень інфікування Т4 клітин складає 1:1000, що говорить про те, що вірус сам по собі не здатний вбити таку кількість клітин, яка гине при ВІЛ інфекції;
Вибухова репродукція вірусу;
Злиття мембран заражених і не заражених Т-хелперів з утворенням нежиттєздатних симпластів. Симпласти були виявлені тільки в умовах культури клітин;
Атака заражених клітин цитотоксичними Т-лімфоцитами;
Адсорбція вільного gp120 на CD4+ незаражених Т-хелперів з їх подальшою атакою цитотоксичними Т-лімфоцитами.
В
основі тяжкого імунодефіциту при
ВІЛ-інфекції лежить прогресуюче зниження
кількості CD4+ Т-лімфоцитів, що є, з одного
боку, результатом їх постійного
руйнування, з іншого – недостатнього
поповнення їхньої кількості з клітин
попередників. О
Малюнок
3
Основний резервуар ВІЛ в організмі – макрофаги і моноцити, оскільки в них не відбувається вибухової репродукції вірусу. Вихід відбувається через комплекс Гольджі.
Клінічна характеристика ВІЛ-інфекції та СНІД.
До ВІЛ-інфікованих належать особи, в яких, незалежно від клінічних проявів хвороби, при лабораторному дослідженні виявлені ознаки наявності вірусу імунодефіциту людини.
Клінічна класифікація ВІЛ-інфекції. Найбільш зручною для використання є класифікація ВООЗ, згідно якої виділяється 5 стадій захворювання:
• стадія гострого захворювання;
• стадія безсимптомного носіння;
• стадія персистуючої генералізованої лімфаденопатії;
• СНІД-асоційований комплекс;
• СНІД.
С хематичне
зображення перебігу ВІЛ-інфекції.
хематичне
зображення перебігу ВІЛ-інфекції.
Стадія гострого захворювання.
Після періоду інкубації, що продовжується від 2-х тижнів до 3-х місяців, (а в окремих випадках – до року), у третини інфікованих розвивається стадія гострого захворювання. Вона супроводжується підвищенням температури, явищами фарингіту, лімфаденопатією, збільшенням печінки та селезінки, диспепсичними розладами, нестійкими та різноманітними (уртикарними, папульозними) висипаннями.
С тадія
гострого захворювання (період
сероконверсії): висип. Стадія гострого
захворювання починається приблизно
через 6 тижнів після зараження і може
проявлятися мононуклеозоподібним
синдромом з лихоманкою, ангіною,
збільшенням лімфовузлів. міальгією та
висипом.
тадія
гострого захворювання (період
сероконверсії): висип. Стадія гострого
захворювання починається приблизно
через 6 тижнів після зараження і може
проявлятися мононуклеозоподібним
синдромом з лихоманкою, ангіною,
збільшенням лімфовузлів. міальгією та
висипом.
Стадія гострого захворювання часто супроводжується транзиторним зниженням рівня СD4-лімфоцитів. Не у всіх хворих на початку стадії гострого захворювання можливо виявити антитіла до ВІЛ. Найбільш надійно виявляти р24 антиген ВІЛ. Тривалість клінічних проявів гострої інфекції варіює від декількох днів до декількох місяців, але частіше складає 1-6 тижнів.
Стадія безсимптомного носіння. Характеризується відсутністю клінічних проявів захворювання. В окремих випадках спостерігається помірне збільшення лімфовузлів. В крові у хворих з безсимптомною інфекцією визначаються антитіла до антигенів ВІЛ. Тривалість цієї стадії – від 2 до 10 років і залежить від цілого ряду факторів, природа яких ще мало вивчена.
Стадія персистуючої генералізованої лімфаденопатії. Вона характеризується:
• збільшенням лімфатичних вузлів у двох різних групах (за виключенням пахових лімфовузлів у дорослих) до розмірів більше 1 см, у дітей більше 0,5 см в діаметрі, яке зберігається протягом не менше 3 місяців;
• відсутністю інтеркурентних захворювань, що можуть призводити до лімфаденопатії;
• неспецифічні реактивні зміни при гістологічному досліджені біоптатів лімфовузлів
П ерсистуюча
генералізована лімфаденопатія може
спостерігатись і на наступних стадіях
ВІЛ-інфекції, однак на цій стадії вона
є єдиним клінічним проявом
ерсистуюча
генералізована лімфаденопатія може
спостерігатись і на наступних стадіях
ВІЛ-інфекції, однак на цій стадії вона
є єдиним клінічним проявом
П
 ерсистуюча
генералізована лімфаденопатія у 8-річної
ВІЛ-інфікованої дівчинки.
ерсистуюча
генералізована лімфаденопатія у 8-річної
ВІЛ-інфікованої дівчинки.
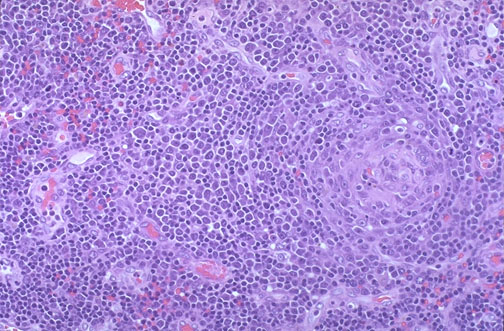
Явища фолікулярної гіперплазії при ВІЛ-лімфаденопатії. Біопсія шийного лімфовузла.
СНІД-асоційований комплекс. Характеризується наявністю таких ознак та симптомів: діарея нез’ясованої причини, нездужання, втомлюваність та сонливість, анорексія, лихоманка, нічна пітливість, головний біль, спленомегалія. З’являються неврологічні порушення, які призводять до втрати пам’яті, та прояви периферійної невропатії. Характерна поява оперізуючого герпесу, рецидивуючих кандидозних висипань на слизових оболонках ротової порожнини, «волосатої» лейкоплакії язика, рецидивуючого простого герпесу, чисельних фолікулітів, себорейних дерматитів, контагіозного молюску, паротиту, гепатоспленомегалії. Втрата ваги тіла відмічається у більшості хворих і, як правило, прогресує.
СНІД. СНІД є кінцевою стадією клінічного перебігу ВІЛ-інфекції. На перший план виступає картина опортуністичних інфекцій і (або) пухлин. Їх поява пов’язана з дефіцитом клітинного імунітету, чинником якого є ВІЛ. Сам термін «опортуністичні інфекції» підкреслює той факт, що ці інфекційні процеси практично не реєструються у осіб з нормальним рівнем імунної відповіді і розвиваються тільки у випадках глибокої імунодепресії.
При лабораторному дослідженні на цій стадії в сироватці крові пацієнтів, як правило, виявляється антиген р24, знижується рівень антитіл до ВІЛ (можливо їх зникнення), має місце значне зниження СД4-лімфоцитів, лейкопенія, лімфоцитопенія, анемія.
Згідно з положенням ВООЗ від 1988 року і доповненням від 1993 року, достовірний діагноз СНІД у пацієнта встановлюється за умови виявлення в нього антитіл до ВІЛ та хоча б одного з СНІД-індикаторних захворювань.
Перелік СНІД-індикаторних захворювань, що входять до Європейського визначення випадку СНІД для реєстрації та епіднагляду (з доповненнями 1993 року).
Опортуністичні інфекції:
Бактеріальні інфекції у дітей, молодших 13 років, множинні чи рецидивуючі.
Кандидоз трахеї, бронхів або легенів. Кандидоз стравоходу.
Кокцидіомікоз, поширений або поза легеневий.
Криптококоз.
Криптоспоридіоз з діареєю тривалістю понад місяць.
Цитомегаловірусна інфекція у хворих віком понад один місяць, з ураженням внутрішніх органів, крім печінки, селезінки чи лімфатичних вузлів. Цитомегаловірусний ретиніт з втратою зору.
Герпетична інфекція з хронічними виразками, що не виліковуються протягом одного місяця, або з ураженням бронхів, легень, стравоходу у пацієнтів віком більше місяця.
Гістоплазмоз, поширений або поза легеневий.
Ізоспороз з діареєю понад один місяць.
Інфекції, викликані M.kansasii, поширені або поза легеневі.
Легеневий туберкульоз у дорослих або підлітків, старших 13 років.
Поза легеневі форми туберкульозу.
Інші захворювання, спричинені мікобактерією, окрім M.tuberculosis, поширені або поза легеневі.
Пневмонія, спричинена Pneumocystis carinii.
Повторні пневмонії.
Прогресуюча множинна лейкоенцефалопатія.
Сальмонельозна септицемія, рецидивуюча (крім спричиненої S.typhy murium).
Токсоплазмоз мозку у пацієнтів віком понад 1 місяць.
Інші хвороби:
Цервікальний інвазивний рак.
Енцефалопатія, пов’язана з ВІЛ.
Саркома Капоші.
Лімфоїдна інтерстиціальна пневмонія у дітей, молодших за 13 років.
Лімфома Беркітта. Лімфома імунобластна. Лімфома мозку (первинна).
Синдром виснаження, обумовлений ВІЛ (слім-хвороба, схуднення).
Індикаторні хвороби з недостатньою інформацією:
Опортуністичні інфекції невстановленої етіології.
Лімфома невстановленого походження.
Тема №12
БАКТЕРІАЛЬНІ ІНФЕКЦІЇ: ДИФТЕРІЯ, СКАРЛАТИНА
