
Аляутдин большой
.pdfГлава 18
АНТИАРИТМИЧЕСКИЕ СРЕДСТВА
Противоаритмические (антиаритмические) средства — клинико-фар- макологическая группа препаратов, применяемых при нарушениях сердечного ритма и воздействующих непосредственно на сердце или на его иннервацию.
Кардиомиоциты как основной структурный элемент сердца подразделяют на типичные (рабочие, сократительные) и атипичные. Типичные кардиомиоциты содержат сократительные белки (актин и миозин), благодаря которым осуществляется насосная функция органа.
Атипичные кардиомиоциты не содержат сократительных белков. Их основные функции — проводимость и автоматизм (способность к самопроизвольной генерации импульса). Они образуют проводящую систему сердца (рис. 18.1).
Проводящая система состоит из:
●синусового (синоатриального) узла;
●межузловых (интернодальных) проводящих пучков;
●атриовентрикулярного соединения (атриовентрикулярного узла);
●атриовентрикулярного пучка (пучка Гиса);
●волокон Пуркинье.
Основная функция проводящей системы сердца — поддержание нормального ритма сердечных сокращений.
Синусовый (синоатриальный) узел расположен в верхнелатеральной стенке правого предсердия, около устья верхней полой вены. Он состоит из пучка волокон длиной 15 мм, шириной 3 мм и толщиной 1 мм. Потенциал покоя кардиомиоцитов синусового узла составляет 55 мВ.
Синусовый узел генерирует импульсы с частотой 70–80 в минуту. Это наиболее высокие значения во всей проводящей системе. Меньшая частота генерации импульсов нижерасположенных элементов проводящей системы подавляется («обнуляется») более высоким уровнем автоматизма синусового узла. Поэтому именно он в норме определяет ЧСС и выполняет функцию водителя ритма (pacemaker), а генерируемые им импульсы проводятся по проводящей системе к рабочим кардиомиоцитам желудочков.

424 |
Часть II. Частная фармакология |
Рис. 18.1. Проводящая система сердца
Глава 18. Антиаритмические средства |
425 |
Атриовентрикулярное соединение состоит из атриовентрикулярного узла, тонких прободающих и толстых дистальных волокон предсердножелудочкового пучка. Атриовентрикулярный узел находится в задней части стенки правого предсердия, непосредственно позади трехстворчатого клапана. Уровень его автоматизма достигает 40–60 импульсов в минуту и в норме подавляется синусовым узлом.
Значения проводимости неодинаковы в разных отделах проводящей системы. Так, межузловые пучки проводят импульс со скоростью 0,3 м/с, а в прободающих волокнах атриовентрикулярного соединения отмечают наиболее низкие значения проводимости — 0,02–0,05 м/с.
Оба узла проводящей системы находятся в стенках предсердий, отделенных от желудочков непроводящей фиброзной тканью, препятствующей ретроградному проведению возбуждения во время систолы. Через эту фиброзную преграду из предсердий в желудочки проходят медленно проводящие прободающие волокна атриовентрикулярного пучка. Таким образом, все атриовентрикулярное соединение функционирует как фильтр, передающий возбуждение только в одну сторону и ограничивающий проведение лишних импульсов от тканей предсердий, имеющих высокий автоматизм, на желудочки.
Атриовентрикулярный пучок (пучок Гиса) расположен в межжелудочковой перегородке. Он обладает наиболее высокой проводимостью (1,5–5 м/с). Пучок Гиса делится на две ножки (правую и левую), проходящие субэндокардиально. От них отходят волокна Пуркинье, располагающиеся в толще стенок желудочков и контактирующие там с рабочими кардиомиоцитами. Волокна содержат некоторое количество филаментов миозина, что позволяет им сокращаться вместе с типичными кардиомиоцитами желудочков.
Проводимость рабочих клеток желудочков составляет 0,6–1,0 м/с. Ее высокие значения в системе Гис–Пуркинье и сократительных кардиомиоцитах желудочков позволяют импульсам от водителей ритма с большой скоростью распространяться по миокарду. Это делает систолическое сокращение быстрым и скоординированным.
Автоматизм и проводимость находятся под контролем эфферентной иннервации сердца. Парасимпатическая нервная система оказывает угнетающее влияние за счет стимуляции М2-холинорецепторов. Холинергическая иннервация сердца не распространяется на желудочки: правая ветвь блуждающего нерва иннервирует синусовый узел, левая — атриовентрикулярный.
Симпатическая нервная система повышает автоматизм и проводимость за счет стимуляции β1-адренорецепторов. Адренергические во-
426 |
Часть II. Частная фармакология |
локна иннервируют как саму проводящую систему, так и сократительные кардиомиоциты, а следовательно, регулируют и проводимость, и автоматизм, и сократимость.
Нарушения автоматизма и проводимости приводят к сердечным аритмиям. Среди их причин выделяют:
●гипоксические явления (в результате ухудшения коронарного кровотока);
●нарушения метаболических процессов в сердце;
●изменения нейроэндокринной регуляции вследствие различных заболеваний (тиреотоксикоз, пороки сердца, тромбоэмболия легочной артерии и др.).
Кроме того, некоторые группы ЛВ способны повышать автоматизм и изменять проводимость, способствуя тем самым развитию аритмий (оказывая проаритмическое или аритмогенное действие). К таким препаратам относят адренергические, кардиотонические и даже антиаритмические средства.
Аритмии классифицируют по:
●локализации:
—наджелудочковые (суправентрикулярные);
—желудочковые (вентрикулярные);
●влиянию на частоту сердечных сокращений:
—брадисистолические (снижающие ЧСС);
—тахисистолические (повышающие ЧСС);
●механизму развития:
—блокады (развиваются в результате снижения проводимости);
—экстрасистолии (развиваются в результате повышения автоматизма);
—аритмии повторного входа («reentry-аритмии» — развиваются в результате нарушения проводимости).
Блокады проводящей системы обычно протекают в брадиаритмической форме; экстрасистолии и аритмии повторного входа — в тахиаритмической форме (их часто объединяют в группу «экстрасистолии и тахиаритмии»).
Для выяснения причин возникновения аритмий и понимания механизмов действия антиаритмических средств необходимо рассмотреть некоторые вопросы электрофизиологии миокарда. Моделью для изучения служит модель потенциала действия волокна Пуркинье. Механизм представлен на рис. 18.2.
Потенциал покоя мембраны волокна Пуркинье составляет –90 мВ (см. рис. 18.2а). Однако он самопроизвольно увеличивается во время спонтанной медленной диастолической деполяризации (фаза 4). При дости-

а |
б |
в |
г |
д
Рис. 18.2. Механизм возникновения потенциала действия волокна Пуркинье (пояснения в тексте)
средства Антиаритмические .18 Глава
427
428 |
Часть II. Частная фармакология |
жении порогового уровня возникает потенциал действия, вызывающий сокращение сердца. Спонтанная деполяризация обусловлена медленным входом ионов Na+ и выходом ионов К+. Продолжительность этой фазы прямо влияет на время генерации очередного импульса и в связи с этим отражает автоматизм волокна Пуркинье (чем она длительнее, тем ниже уровень автоматизма). В синоатриальном узле спонтанный диастолический входящий ток ионов Na+ и в меньшей степени К+ определяет ЧСС. Этот ток обозначается If и обеспечивается неизбирательными катионными f-(funny) каналами.
Врезультате спонтанной диастолической деполяризации заряд на мембране достигает –60 мВ. В этот момент открываются потенциалзависимые
натриевые каналы (см. рис. 18.2б) и возникает лавинообразный вход ионов Na+ в клетку. Заряд на мембране при этом мгновенно увеличивается до +35мВ, возникает быстрая деполяризация мембраны (фаза 0). Продолжительность этой фазы отражает проводимость волокна (чем она короче, тем выше проводимость).
Во время фазы 0 (при уровне заряда на мембране –40мВ) открываются
потенциалзависимые кальциевые каналы (см. рис. 18.2в), обеспечивающие ток ионов Са2+. Эти каналы функционируют примерно в 3 раза медленнее натриевых. Благодаря этому ток ионов Са2+ образует фазу «плато» (фаза 2) потенциала действия.
Потенциалзависимые калиевые каналы открываются при достижении
электроположительных значений заряда на мембране (см. рис. 18.2г). Через них ионы K+ выходят из кардиомиоцитов, что обусловливает реполяризацию мембраны: инициальную (фаза 1) и окончательную (фаза 3). Фаза 1
непродолжительна, так как повышение заряда, вызываемое выходом ионов K+, нивелируется противотоком ионов Са2+. Во время окончательной
реполяризации кальциевые и натриевые каналы уже закрыты, поэтому изменение потенциала мембраны достигается только за счет тока ионов К+.
Входе фазы 3 заряд на мембране возвращается к исходному уровню потенциала покоя (–90 мВ). Смена фаз потенциала действия волокна Пуркинье представлена на рис. 18.2д.
●Фаза 0 — быстрая деполяризация (вход ионов Na+), отражает функцию проводимости.
●Фаза 1 — ранняя реполяризация (выход ионов K+ из клетки).
●Фаза 2 — «плато» (вход ионов Са2+).
●Фаза 3 — окончательная реполяризация (выход ионов K+).
●Фаза 4 — спонтанная медленная диастолическая деполяризация (вход ионов Na+ и К+ через специфические f-(funny) каналы), отражает функцию автоматизма.

Глава 18. Антиаритмические средства |
429 |
Общая продолжительность потенциала действия составляет около 1 с. При этом половина времени приходится на фазу 4. В фазы 0, 1 и 2 волокно Пуркинье пребывает в состоянии возбуждения и абсолютной рефрактерности (невозбудимости). В фазу 3 абсолютная рефрактерность сменяется относительной (способностью генерировать внеочередной импульс в ответ на пришедшее извне раздражение). Этот период времени обозначают как эффективный рефрактерный период
(ЭРП). Обычно ЭРП занимает ⅔ окончательной реполяризации, поэтому, чем она продолжительнее, тем длительнее ЭРП и, соответственно меньше риск возникновения потенциала действия в ответ на внеочередную стимуляцию.
Электрофизиологические механизмы генерации потенциала действия
вузлах проводящей системы существенно отличаются от таковых в волокнах Пуркинье (рис. 18.3).
Синусовый и атриовентрикулярный узлы генерируют кальциевые потенциалы действия. Потенциал покоя пейсмейкерных клеток первого составляет –55 мВ. При этом большинство натриевых каналов находятся
винактивированном состоянии, а фаза 4 и фаза 0 обусловлены током ионов Са2+. Однако их проникновение в клетки инициируется входящим током ионов Na+ через специфические If-каналы. Это дает основание считать, что If-каналы имеют основополагающее значение для нормального автоматизма синусового узла.
Основные способы терапии при экстрасистолиях и тахиаритмиях:
●угнетение автоматизма;
●угнетение проводимости;
●пролонгирование ЭРП.
а |
б |
Рис. 18.3. Потенциалы действия водителей ритма (пояснения в тексте): а — синусового узла; б — атриовентриокулярного узла
430 |
Часть II. Частная фармакология |
Первый способ целесообразен при экстрасистолиях (внеочередных сокращениях желудочков), возникающих в результате несвоевременной и эктопической генерации импульса. Повышенное содержание калия
втканях, гипоксия и другие факторы приводят к увеличению уровня автоматизма волокон Пуркинье и сократительных кардиомиоцитов. Формируется эктопический очаг, генерирующий внеочередные импульсы, которые могут распространяться на миокард желудочков и вызывать экстрасистолию. Применение ЛС, пролонгирующих фазу 4, приводит к уменьшению автоматизма и подавлению активности таких очагов.
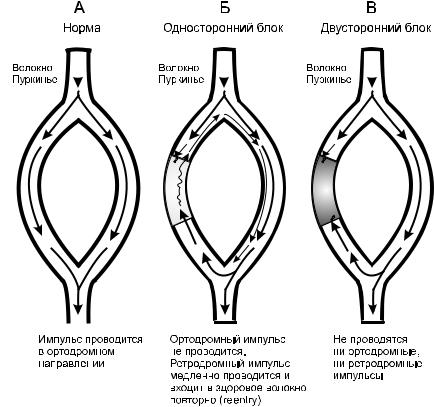
Угнетение проводимости целесообразно при аритмиях повторного входа (reentry-аритмиях). Они возникают в результате неполных блокад
всистеме Гис–Пуркинье (рис. 18.4).
Рис. 18.4. Механизм возникновения reentry-аритмий (пояснения в тексте)

Глава 18. Антиаритмические средства |
431 |
В норме импульс проходит по волокнам с одинаковой скоростью (см. рис. 18.4а). Однако если из-за вышеперечисленных патологических факторов одно из них находится в рефрактерном состоянии, то оно не способно к проведению ортодромного импульса, направленного от узла на периферию. В то же время потенциал действия, прошедший по неповрежденному волокну, может возвратиться антидромно в поврежденное, которое к этому моменту теряет рефрактерность и способно к проведению. Возникает так называемый односторонний блок. В этом случае антидромный импульс повторно входит в неповрежденное волокно, становясь внеочередным (см. рис. 18.4б).
При применении средств, угнетающих проводимость, блок в пораженном волокне становится полным (двусторонне направленным), и волокно теряет способность проводить не только ортодромные, но и ретроградные импульсы. В результате повторный вход внеочередных потенциалов действия прекращается (см. рис. 18.4в).
По механизму reentry возникают не только желудочковые аритмии (рис. 18.5).
Так, синдром преждевременного возбуждения желудочков представляет собой упорядоченную циркуляцию возбуждения между предсердиями и желудочками, если между ними существует дополнительный проводящий пучок (см. рис. 18.5а). В этом случае ортодромный импульс, пройдя к желудочкам по пучку Гиса, может ретроградно возвратиться по дополнительному пучку к предсердиям и стать внеочередным.
а |
б |
в |
Рис. 18.5. Различные варианты reentry-аритмий (а, б, в): С — синусовый узел; АВ — атриовентрикулярный узел; ПГ — пучок Гиса; ДП — дополнительный проводящий пучок
432 |
Часть II. Частная фармакология |
Кроме того, по принципу упорядоченной циркуляции возбуждения возникает трепетание предсердий (см. рис. 18.5б). В этом случае они сокращаются по очереди. Фибрилляция предсердий возникает по принципу беспорядочной циркуляции возбуждения (см. рис. 18.5в).
Пролонгирование ЭРП целесообразно при экстрасистолиях и тахиаритмиях любой локализации. Применение средств, увеличивающих фазу 3, снижает риск генерации желудочками внеочередного импульса
вответ на несвоевременную стимуляцию.
Всоответствии с вышеописанным электрофизиологическим механизмом возникновения потенциала действия волокна Пуркинье можно
заключить, что:
●пролонгирование фазы 0 достигают путем блокады натриевых ка-
налов;
●пролонгирование фазы 3 достигают путем блокады калиевых каналов;
●пролонгирование фазы 4 достигают путем блокады как натриевых, так и калиевых каналов.
Кроме того, снижение уровня автоматизма, проводимости и увеличение ЭРП возникает при блокаде β1-адренорецепторов.
Необходимо также особо подчеркнуть, что угнетение сократимости не приводит к противоаритмическому эффекту и считается побочным действием антиаритмических средств.
Противоаритмические средства классифицируют по применению
имеханизмам действия.
●Средства, применяемые при тахиаритмиях и экстрасистолии:
—I класс — блокаторы натриевых каналов;
—II класс — β-адреноблокаторы;
—III класс — блокаторы калиевых каналов;
—IV класс — блокаторы кальциевых каналов;
—аденозин;
—сердечные гликозиды;
—препараты калия и магния.
●Средства, применяемые при брадиаритмиях и блокадах:
—м-холиноблокаторы;
—β-адреномиметики.
Классификацию антиаритмических средств на 4 класса по механизму действия впервые предложил Vaughan Williams в 1970 г. В несколько модифицированном виде ей пользуются до сих пор. Помимо этих четырех групп при некоторых видах наджелудочковых тахиаритмий эффективны сердечные гликозиды и аденозин, а при экстрасистолиях, связанных с гипокалиемией, — препараты калия и магния.
