
- •Введение
- •Дифференцирование векторных величин
- •1. Кинематика поступательного
- •1.1. Система отсчета. Путь. Вектор перемещения
- •1.2. Скорость. Ускорение при криволинейном движении
- •1.3. Нормальное, тангенциальное и полное ускорения
- •1.4. Движение точки по окружности. Угловая скорость. Угловое ускорение
- •2. Динамика поступательного движения
- •2.1. Законы Ньютона
- •2.2. Силы в механике
- •2.2.1. Сила тяжести
- •2.2.2. Упругие силы
- •2.2.3. Сила трения
- •2.3. Внешние и внутренние силы. Закон сохранения импульса
- •3. Работа и энергия
- •3.1. Работа силы и ее выражение через криволинейный интеграл
- •3.2. Кинетическая энергия механической системы и её связь с работой
- •3.3. Потенциальная энергия материальной точки во внешнем силовом поле и ее связь с силой, действующей на материальную точку
- •3.4. Потенциальная энергия системы взаимодействия. Связь кинетической энергии системы с работой внутренних и внешних сил
- •3.5. Закон сохранения механической энергии. Закон сохранения и превращения энергии как проявление неуничтожимости материи и ее движения
- •3.6. Удар абсолютно упругих и неупругих тел
- •4. Динамика вращательного движения
- •4.1. Момент силы и момент импульса
- •4.2. Уравнение моментов
- •4.3. Движение центра тяжести твердого тела
- •4.4. Момент инерции тела относительно оси вращения
- •4.5. Уравнение динамики вращательного движения твердого тела относительно неподвижной оси. Закон сохранения момента импульса
- •4.6. Кинетическая энергия твердого тела. Работа внешних сил при вращении твердого тела
- •4.7. Кинетическая энергия при плоском движении твердого тела
- •5. Элементы специальной теории относительности
- •5.1. Преобразования Галилея. Механический принцип относительности
- •5.2. Постулаты специальной теории относительности. Преобразования Лоренца
- •5.3. Следствия из преобразований Лоренца
- •5.3.1. Одновременность событий в разных системах отсчета
- •5.3.2. Длина тел в разных системах отсчета
- •5.3.3. Длительность событий в разных системах отсчета
- •5.4. Пространственно-временной интервал
- •5.5. Релятивистская кинематика. Релятивистский закон сложения скоростей
- •5.6. Релятивистская динамика
- •6. Механические колебания и волны
- •6.1. Понятия о колебательных процессах. Гармонические колебания. Амплитуда. Частота. Фаза колебаний
- •6.2. Свободные гармонические колебания
- •6.2.1. Математический маятник
- •6.2.2. Пружинный маятник
- •6.2.3. Физический маятник
- •6.2.4. Скорость и ускорение точки, колеблющейся по гармоническому закону
- •6.2.5. Энергия гармонических колебаний
- •6.3. Сложение колебаний
- •6.3.1. Сложение колебаний одного направления и одинаковой частоты
- •6.3.2. Сложение двух гармонических колебаний одного направления, но разного периода
- •6.3.3. Сложение взаимно перпендикулярных колебаний
- •6.4. Затухающие колебания
- •6.5. Вынужденные колебания. Резонанс
- •6.6. Волновые процессы
- •6.6.1. Плоская синусоидальная волна. Фазовая скорость. Длина волны. Групповая скорость
- •6.6.2. Скорость распространения волн в упругой среде
- •6.6.3. Поток энергии в волновых процессах
- •6.6.4. Принцип Гюйгенса-Френеля. Интерференция волн
- •6.6.5. Отражение волн. Стоячие волны
- •7. Молекулярно-кинетическая теория
- •7.1. Статистический метод исследования. Термодинамический метод исследования. Термодинамические параметры. Равновесное состояние и процессы их изображения на термодинамических диаграммах
- •7.2. Основное уравнение молекулярно-кинетической теории газов
- •7.3. Средняя кинетическая энергия молекул. Молекулярно-кинетическое толкование абсолютной температуры. Связь основного уравнения мкт с уравнением Менделеева-Клайперона
- •7.4. Средняя скорость молекул. Поток молекул
- •7.5. Распределение молекул по скоростям. Закон Максвелла
- •7.6. Барометрическая формула.
- •7.7. Больцмановское распределение частиц в потенциальном поле. Закон Максвелла-Больцмана
- •7.8. Экспериментальный метод определения числа Авогадро
- •7.9. Эффективный диаметр молекулы. Число столкновений и средняя длина свободного пробега молекулы
- •7.10. Явления переноса в газах
- •7.10.1. Вязкость газов (внутреннее трение)
- •7.10.2. Закон Стокса
- •7.10.3. Теплопроводность газов
- •7.10.4. Диффузия газов
- •8. Термодинамика
- •8.1. Внутренняя энергия системы. Работа. Количество теплоты. Первое начало термодинамики
- •8.2. Степени свободы молекул. Распределение энергии по степеням свободы
- •8.3. Молекулярно-кинетическая теория теплоемкости газа
- •8.4.1. Изохорный процесс
- •8.4.2. Изотермический процесс
- •8.4.3. Изобарный процесс
- •8.5. Адиабатический процесс
- •8.7. Цикл Карно
- •8.8. Принцип действия тепловой и холодильной машин
- •8.9. Второе начало термодинамики
- •8.10. Приведенное количество тепла. Неравенство Клаузиуса
- •8.12. Статистический смысл второго начала термодинамики. Связь энтропии с термодинамической вероятностью
- •9. Агрегатные состояния и фазовый переход
- •9.1. Реальные газы. Уравнение Ван-дер-Ваальса
- •9.2. Экспериментальные изотермы. Критические состояния
- •9.3. Внутренняя энергия реального газа. Эффект
- •Библиографический список
- •Оглавление
8.4.1. Изохорный процесс
Процесс, протекающий при V=const, называется изохорным. Поскольку при изохорном процессе V=const, а dV=0, то dA=pdV=0, т.е. при изохорном процессе газ работу не совершает. Первое начало термодинамики запишется в этом случае в виде соотношения
dU = dQ.
Количество теплоты, которое необходимо сообщить системе для того, чтобы при постоянном объеме повысить его температуру на величину dT, можно выразить, если известна теплоемкость вещества при постоянном объеме dQ=CVdT и, следовательно, dU=CVdT. Принимая, что CV - теплоемкость идеального газа не зависит от температуры, для внутренней энергии идеального одноатомного газа получим выражение
 .
.
Для киломолей
![]() .
.
Таким образом,
![]() ,
,
т.е. при изохорном изменении состояния газа вся подведенная к системе теплота идет на увеличение внутренней энергии системы.
8.4.2. Изотермический процесс
Процесс, происходящий при постоянной температуре, называется изотермическим процессом. При
T = const, U = const, dU = 0.
Уравнение первого начала термодинамики при изотермическом состоянии газа запишется в следующей форме:
dQ = dA. (8.3)
Из этого выражения следует, что при изотермическом процессе все подводимое к системе количество теплоты превращается в работу. Для подсчета работы, совершенной газом при изотермическом расширении от объема V1 до V2, необходимо проинтегрировать выражение для элементарной работы:
.
Выразив давление из уравнения Менделеева-Клайперона для одного моля газа
![]()
и подставив в уравнение для определения работы, получим
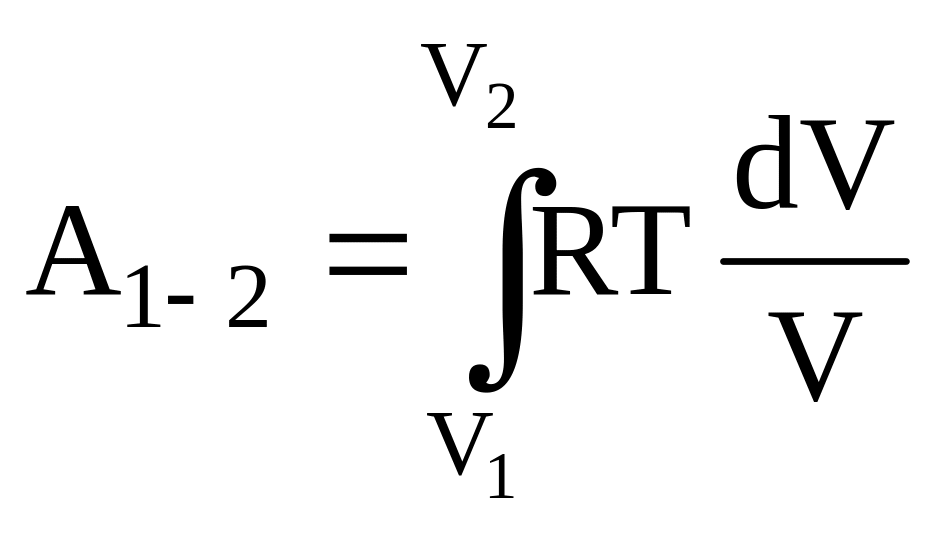 ,
,
![]() .
.
Работа, совершаемая при расширении -молей газа, будет в раз больше, т.е.
![]() .
.
Графически
вычисленная работа (рис.8.6) выражается
на диаграмме с координатами pV
площадью аbcd,
заштрихованной на графике. Вместо
отношения
![]() ,
можно воспользоваться равным ему
обратным отношением давлений, исходя
из закона Бойля-Мариотта, тогда
,
можно воспользоваться равным ему
обратным отношением давлений, исходя
из закона Бойля-Мариотта, тогда
Согласно (8.3), при T=const Q=A, т.е.
|
a
b
d c V1 V2 V Рис.8.6 |
8.4.3. Изобарный процесс
Изобарный процесс – процесс, происходящий при постоянном давлении p=const. Работа в этом случае равна
 .
.
Работа изображается на диаграмме (рис.8.7.) площадью прямо-угольника abcd.
Применим первое начало термодинамики к изобарному процессу dQ = dU + dA. Из определения молярной теплоемкости следует, что dQ = CpdT. Интегрируя выражение, по-лучим количество теплоты, необходимое для нагревания газа от температуры T1 до T2 для од- |
р
a b
d c V1 V2 V Рис.8.7
|
ного моля газа
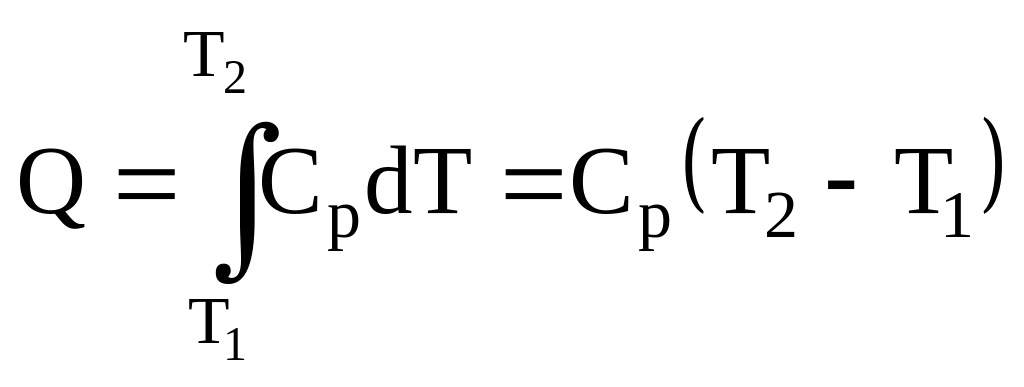 ,
,
для
молей газа
![]() .
.
Таким образом, при изобарном процессе подводимое к газу тепло частично тратится на увеличение его внутренней энергии и частично на совершение работы.
При изобарном сжатии направление процесса меняется на обратное и работа, совершенная газом становится отрицательной dA0. Это означает, что не газ совершает внешнюю работу, а внешние силы совершают положительную работу dA по сжатию газа, т.е.
dA = dA.
Величина dU и dQ при этом также отрицательны, т.е. внутренняя энергия газа уменьшается за счет отдачи им тепла окружающим телам.

 p
p