
1306
.pdf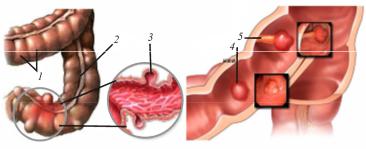
Всероссийская конференция «БИОМЕХАНИКА – 2014» |
251 |
УДК 539.3
КОНЕЧНО-ЭЛЕМЕНТНЫЙ АНАЛИЗ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ СТЕНКИ ТОЛСТОГО КИШЕЧНИКА
Л.Р. Хайдарова, Л.Ю. Коссович
Саратовский государственный университет им. Н.Г. Чернышевского,
Россия, 410012, г. Саратов, ул. Астраханская, 83, nano-bio@sgu.ru
Ключевые слова: конечно-элементный анализ, трехмерная модель, толстый кишечник, патология.
Введение
Одними из основных факторов, способствующих развитию болезней толстого кишечника, являются неправильное питание и малоподвижный образ жизни. По данным статистики, около трехсот человек из тысячи страдают от неправильной работы толстой кишки. Существует множество различных патологий данного органа. В работе рассмотрены поражение стенки толстой кишки дивертикулами и полипами. Дивертикул – это мешковидное слепое выпячивание кишечной стенки, полип – новообразование, возникшее в слизистой оболочке и выступающее внутрь просвета органа. Полип может иметь ножку различной толщины или широкое основание [1].
Материалы и методы
Трехмерные модели органа с пораженными стенками были построены в программном пакете SolidWorks [2]. При построении кишки учитывалось анатомическое строение стенки, а именно наличие тений (мышечные ленты) и гаустр (циркулярные выпячивания стенки) (рис. 1, 2).
Рис. 1. Толстая кишка: 1 – гаустры; 2 – мышечная лента (тения); 3 – дивертикула, 4 – полип на широком основании; 5 – полип на широкой ножке

252 |
Всероссийская конференция «БИОМЕХАНИКА – 2014» |
а |
б |
Рис. 2. Трехмерная модель толстого кишечника: а – дивертикулез; б – полипоз
Численный эксперимент построенных моделей был проведен в конечноэлементном пакете ANSYS Workbench. Механические свойства стенки были получены при проведении натурного эксперимента по растяжению образцов тканей толстого кишечника и тений с сопутствующими слоями стенки. Эксперимент был проведен в продольном и поперечном направлениях. Для тканей стенки модуль Юнга принимался равным 3,3·106 Па, для тений – 5,5·106 Па, коэффициент Пуассона – 0,5. Химус (содержимое толстой кишки) был представлен как однородная несжимаемая ньютоновская жидкость с плотностью 970 кг/м3 и динамической вязкостью 0,01 Па·с [3].
Для моделирования перистальтики толстой кишки на внешнюю поверхность стенки прикладывалось давление 7000 Па [4].
Результаты
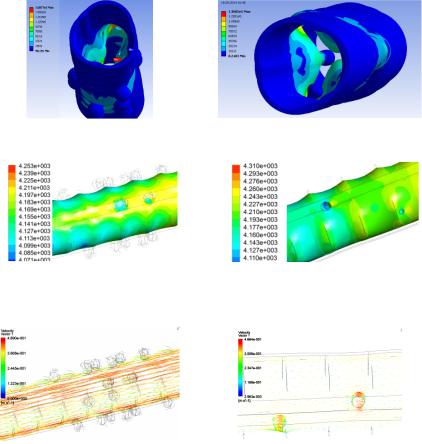
В результате поставленной задачи были получены картины напряжен- но-деформированного состояния стенки толстой кишки и поле скоростей химуса, что позволило наглядно увидеть физиологические процессы, происходящие в заданной биологической системе (рис. 3, 4, 5, 6).
а |
б |
Рис. 3. Поле перемещений стенки толстой кишки: а – с дивертикулами, б – с полипами
Всероссийская конференция «БИОМЕХАНИКА – 2014» |
253 |
а |
б |
Рис. 4. Эквивалентное напряжениестенкитолстойкишки: а– сдивертикулами, б– сполипами
а |
б |
Рис.5. Внутрипросветное давление стенки толстой кишки: а – с дивертикулами, б – с полипами
а |
б |
Рис. 6. Поле скоростей движения химуса: а – с дивертикулами, б – с полипами
Максимальные значения поля перемещений и эквивалентных напряжений моделей достигают максимума в частях стенки, пораженных патологическими изменениями. Эквивалентные напряжения по сравнению с нормой возросли в 108 раз [5, 6].
Выявлено снижение до 25 % значений поля скоростей движения химуса по сравнению с нормой. Уменьшение проходимости внутренних масс в толстом кишечнике обусловлено наличием полипов и дивертикул на стенке органа, которые, в свою очередь, создают препятствия продвижению химуса. В зоне патологических образований внутрипросветное давление достигает своих минимальных значений. Полученные результаты согласуются с данными из медицинских источников [1, 7].
254 |
Всероссийская конференция «БИОМЕХАНИКА – 2014» |
Обсуждение
Конечно-элементное моделирование патологических состояний толстого кишечника позволило рассмотреть изменения, происходящие в данной биологической системе, и оценить влияние типа патологии на работу изучаемого органа в целом. В дальнейшем планируется усложнить модель и рассмотреть другие патологии, учесть нелинейность материалов тканей кишечника, а также провести конечно-элементное моделирование кишечного анастомоза различного типа.
Список литературы
1.Пальцев М.А., Аничков Н.М. Патологическая анатомия: учебник: в 2 т. Т. 2. Ч. I. – М.: Меди-
цина, 2001. – 736 с.
2.Голядкина А.А., Иванов Д.В., Каменский А.В., Кириллова И.В., Сальковский Ю.Е., Сафонов Р.А., Щучкина О.А. Практическое применение системы автоматизированного проектирования SolidWorks в моделировании кровеносных сосудов: учеб. пособие для студентов естественных дисциплин. – Саратов: Наука, 2011. – 148 с.
3.Hari B., Bakalis S., Fryer P. Computational Modeling and Simulation of the Human Duodenum // Excerpt from the Proceedings of the 2012 COMSOL Conference in Milan. – Milan, 2012.
4.Двигательная активность толстой кишки [Электронный ресурс]. – URL: http://www.tryphonov.ru/tryphonov2/terms2/mfcln.htm (обращение к ресурсу 20.08.2013).
5.Городков С.Ю., Коссович Л.Ю., Менишова Л.Р. Конечно-элементное моделирование перистальтики толстого кишечника // Математическое моделирование и биомеханика в современном университете: тез. докл. IX Всерос. школы-семинара. – Ростов н/Д, 2014. – С. 128.
6.Менишова Л. Р., Коссович Л.Ю. Применение компьютерного моделирования при решении задач биомеханики толстого кишечника человека // Компьютерные науки и информационные технологии: материалы междунар. науч. конф. – Саратов: Наука, 2014. – 380 с.
7.Струков А.И., Серов И.В. Патологическая анатомия: учебник. – 4-е изд., стереотип. – М.: Ме-
дицина, 1995. – 688 с.
Всероссийская конференция «БИОМЕХАНИКА – 2014» |
255 |
УДК 533; 612.2
МАТЕМАТИЧЕСКАЯ МОДЕЛЬ ДЫХАТЕЛЬНОЙ СИСТЕМЫ ЧЕЛОВЕКА
М.Ю. Цинкер1, 2
1Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения,
Россия, 614045, г. Пермь, ул. Монастырская, 82, cinker@fcrisk.ru
2Пермский национальный исследовательский политехнический университет, Россия, 614990, г. Пермь, Комсомольский пр., 29
Ключевые слова: математическая модель, дыхательная система человека, эволюция функциональных нарушений.
Введение
Впроцессе жизнедеятельности человек перманентно взаимодействует
сокружающей средой, получая из нее питательные вещества и подвергаясь негативному влиянию совокупности факторов среды обитания (химические, физические и пр.). Проводить комплексное обследование состояние здоровья человека позволяют клинико-лабораторные и функциональные методы исследования [1]. Несмотря на постоянную модернизацию методов диагностики, многие исследования остаются довольно трудоемкими, затратными, неприятными для пациента. Всесторонне исследовать состояние здоровья человека, прогнозировать поведение такой сложной системы, как человеческий организм, позволяет математическое моделирование.
Для построения прогнозов функциональных нарушений состояния здоровья человека, находящегося под влиянием факторов среды обитания, разрабатывается многоуровневая математическая модель [2]. В эволюционной «макромодели» индивидуальный организм предполагается состоящим из конечного числа взаимосвязанных органов и систем. Модель на «макроуровне» описывает механизмы функциональных нарушений, обусловленные естественными процессами и действием факторов среды обитания. На «мезоуровне» подробно рассматриваются процессы, происходящие в отдельных органах и системах, на «микроуровне» – процессы, происходящие в клетках. Данная работа посвящена разработке одной из моделей «мезоуровня» многоуровневой модели человеческого организма – математической модели дыхательной системы [3].
Материалы и методы
Воздух в общем виде представляет собой газовзвесь. Моделирование воздуха газовзвесью необходимо для описания дыхания в запыленных условиях. При дыхании в незапыленных условиях воздух можно считать много-
256 |
Всероссийская конференция «БИОМЕХАНИКА – 2014» |
компонентной смесью газов. Дыхательную систему представим состоящей из крупных воздухоносных путей (первые 4 генерации, начиная с трахеи), входящих в соответствующие участки легких. Легкие, заполненные более мелкими дыхательными путями и содержащимся в них воздухом, представим сплошной деформируемой насыщенной пористой средой. Насыщенная газом пористая среда представлена двухфазной сплошной средой, одна из фаз которой – твердый деформируемый скелет среды, а другая фаза – многокомпонентная смесь газов, заполняющая поровое пространство. Предполагается, что все пространство заполнено двумя фазами, полностью взаимопроникающими и взаимодействующими друг с другом. Стенки легких являются альве- олярно-капиллярной мембраной, через которую посредством диффузии происходит газообмен между воздухом и кровью. В кровь из воздуха попадает кислород, а выделяется углекислый газ. Кроме кислорода и углекислого газа в газообмене участвуют другие химические вещества, содержащиеся в атмосферном воздухе. Регуляция дыхания осуществляется центральной нервной системой за счет контроля уровней кислорода и углекислого газа в крови.
Математическая модель дыхательной системы состоит из трех взаимосвязанных подмоделей: подмодель движения воздуха в крупных воздухоносных путях; подмодель распространения воздуха в деформируемой насыщенной пористой среде легких; подмодель газообмена.
Система уравнений, описывающая течение многокомпонентной смеси газов по крупным воздухоносным путям, включает уравнения Эйлера, дополненные уравнением состояния идеального газа:
|
|
|
|
dρai |
+ (ρai vai )= 0, |
(1) |
|
|
|
|
|
||
|
|
|
|
dt |
|
|
|
∂ |
(ρai vai )+ (ρai vai vai )+ pai = 0, |
(2) |
|||
|
|
|||||
|
∂t |
|
|
|
|
|
|
∂ρai E |
+ (ρai Evi )+ (pai vi )= 0, |
(3) |
|||
|
|
∂t |
|
|
|
|
|
|
|
|
pai = ρai RT, |
(4) |
|
где ρai – плотность смеси |
|
i-й компоненты смеси газов; vai |
– скорость |
|||
i-й компоненты смеси; Е – полная удельная энергия смеси; pai – давление;
R – универсальная газовая постоянная; T – температура смеси.
На входе в трахею задается давление, равное атмосферному. Давление на выходе из бронхов равно давлению на входе в легкие, определяемому из подмодели деформируемой пористой среды. На стенках воздухоносных путей задаются условия непроницаемости и отсутствия трения.
Система уравнений, описывающих движение воздуха в деформируемой насыщенной пористой среде легких включает в себя:
Всероссийская конференция «БИОМЕХАНИКА – 2014» |
257 |
уравнения сохранения масс для газообразной и твердой фаз:
∂ρai + (ρai vai )= 0, |
∂ρs |
+ (ρs w)= 0; |
(5, 6) |
||||
|
∂t |
∂t |
|
|
|||
уравнения сохранения импульса: |
|
|
|
|
|||
|
∂ρsw |
= − (ρsww) |
+ σ, |
где w = du ; |
(7) |
||
|
|
||||||
|
∂t |
|
|
dt |
|
||
уравнение Дарси для описания движения газа в пористой среде: |
|
||||||
|
|
vai = − |
ki (ε) |
pi ; |
(8) |
||
|
|
|
|||||
|
|
|
|
µi |
|
|
|
физические соотношения |
∂A , |
|
|
||||
|
|
σ = |
|
(9) |
|||
|
|
|
|
∂ε |
|
|
|
где для определения потенциальной энергии A используется уравнение Мурнагана
A = |
1 |
(λ+ 2ν)J1(ε)2 |
−2νJ2 (ε) + 1 (l + 2m)J1(ε)3 |
−2mJ1(ε)J2 (ε) + nJ3 (ε); (10) |
|
|
2 |
|
3 |
|
|
тензор деформации Коши-Грина: |
|
|
|||
|
|
|
ε = 1 ( u +( u) + u( u)T ), |
(11) |
|
|
|
|
2 |
|
|
где ρs – плотность твердой фазы пористой среды; w – вектор скорости твер- vai – вектор скорости фильтрации i-й компоненты смеси; ki (ε) –
коэффициент фильтрации; µI – динамическая вязкость; σ – тензор напряжений Коши; ε – тензор деформаций; u – вектор перемещения; λ, ν – константы Лямэ; l, m, n – коэффициенты; J1(ε), J2 (ε), J3 (ε) – главные инварианты тен-
зора деформации.
Диффузия через альвеолярно-капиллярный барьер описывается с помощью уравнения, полученного с использованием первого закона Фика. Диффузионная способность легких зависит от функционального состояния мембраны. Для учета функционального состояния вводится понятие «функциональности альвеолярно-капилярной мембраны» F, под которой будет пониматься ее способность выполнять свои функции.
Уравнение диффузии химических веществ принимает вид
Qi = Ki F (Ci1 |
−Ci2 ), |
(12) |
где Qi – локальный поток i-го вещества |
из воздуха в кровь; Ci1, |
Ci2 – ло- |
кальные концентрация i-го вещества в воздухе легких и крови; Ki – коэффициент проницаемости мембраны для i-го вещества; F – функциональность альвеолярно-капилярной мембраны, принимающая значения в интервале
[0; 1].
258 |
Всероссийская конференция «БИОМЕХАНИКА – 2014» |
Результаты
На основе данных медицинских атласов была воссоздана трехмерная геометрия четырех генераций нижних дыхательных путей [4, 5]. С использованием программного продукта ANSYS Fluent выполнен расчет течения воздуха в крупных воздухоносных путях. В качестве граничных условий были заданы давления на входе и выходе. Получены характеристики процесса течения воздуха на вдохе и на выдохе. По мере продвижения воздуха к легким снижается его скорость. В местах сужений и бифуркаций наблюдается увеличение скорости течения воздуха и возникновение турбулентности. Полученные данные являются входной информацией для решения задачи течения воздуха в пористой среде легких.
Обсуждение
В настоящее время смоделировано течение воздуха в крупных воздухоносных путях. Полная математическая модель дыхательной системы человека в совокупности с «макромоделью» откроет перед исследователями огромные возможности. Появится возможность моделировать процесс дыхания в различных условиях проживания, на вредных производствах; оценивать оседание веществ в воздухоносных путях и попадание в организм; оценивать риски здоровью, а также построить долгосрочный прогноз состояния здоровья человека.
Список литературы
1.Шкляр Б.С. Диагностика внутренних болезней. – Киев: Вища школа, 1972. – С. 648.
2.Трусов П.В., Зайцева Н.В., Кирьянов Д.А., Камалтдинов М.Р., Цинкер М.Ю., Чигвинцев В.М., Ланин Д.В. Математическая модель эволюции функциональных нарушений в организме человека с учетом внешнесредовых факторов // Математическая биология и биоинформати-
ка. – 2012. – № 2. – С. 589–610 [Электронный ресурс]. – URL: http://www.matbio.org/2012/ Trusov_7_589.pdf (дата обращения: 05.12.2012).
3.Цинкер М.Ю. Подход к моделированию дыхательной системы человека, эволюционирующей под действием факторов среды обитания // Актуальные направления развития социальногигиенического мониторинга и анализа риска здоровью: материалы всерос. науч.-практ. конф. с международным участием 15–17 мая 2013 г. / под общ. ред. акад. РАМН Г.Г. Онищенко, чл.- корр. РАМН Н.В. Зайцевой. – Пермь: Книжный формат, 2013. – С. 485–489.
4.Синельников Р.Д., Синельников Я.Р. Атлас анатомии человека: учеб. пособие: в 4 т. Т. 2. – 2-е изд., стереотип. – М.: Медицина, 1996. – 264 с.
5.Вейбель Э.Р. Морфометрия легких человека. – М.: Медицина, 1970.
Всероссийская конференция «БИОМЕХАНИКА – 2014» |
259 |
УДК 519.622.2
О ДИСКРЕТНОМ УПРАВЛЕНИИ ИММУННЫМ ОТВЕТОМ ПРИ ХРОНИЧЕСКОЙ ФОРМЕ ЗАБОЛЕВАНИЯ
М.В. Чирков, С.В. Русаков
Пермский государственный национальный исследовательский университет,
Россия, 614990, г. Пермь, ул. Букирева, 15, ozs-50@mail.ru
Ключевые слова: модели иммунного ответа, дискретное управление, иммунотерапия.
Введение
Общие принципы и механизмы функционирования иммунной системы при инфекционных заболеваниях отражены в базовой математической модели инфекционного заболевания, предложенной Г.И. Марчуком [1]. Модель допускает качественно отличающиеся друг от друга типы решения, которые интерпретируются как формы протекания болезни: субклиническая, острая, хроническая, летальный исход. При лечении наибольшую трудность представляет хроническая форма. В связи с этим представляют интерес задачи управления иммунным ответом при хронической форме заболевания.
В настоящей работе рассматривается подход, при котором в качестве цели управления выступает обеспечение перевода хронической формы в острую с последующим выздоровлением.
Постановка задачи
Базовая модель инфекционного заболевания с учётом управления может быть представлена в виде системы обыкновенных дифференциальных уравнений с запаздывающим аргументом [2]:
|
|
dv = a v −a |
2 |
fv, |
|
|
|
dt |
1 |
|
|
|
|
|
|
|
|
ds |
= a3ξ(m) f (t − τ)v(t − τ) −a5 (s −1), |
||||
dt |
|
|
|
|
(1) |
|
df |
|
|
|
|
|
= a4 (s − f ) −a8 fv +u, |
||||
|
dt |
|
|
|
|
dmdt = a6v −a7m,
где v, s, f – относительные концентрации антигенов, плазматических клеток и антител соответственно, m – доля разрушенных антигенами клеток; непрерывная невозрастающая неотрицательная функция ξ (m), учитывающая сни-

260 Всероссийская конференция «БИОМЕХАНИКА – 2014»
жение силы иммунного ответа вследствие значительного поражения органа. Она может быть представлена в виде
|
1, |
|
0 ≤ m < m , |
|
||||
|
|
|
|
|
|
|
(2) |
|
ξ(m) = m −1 |
, |
m |
≤ m ≤1. |
|||||
|
|
|
−1 |
|
|
|||
|
|
|
|
|
||||
m |
|
|
|
|
|
|
||
Управляющая функция u = u(t) U, характеризующая скорость введения донорских антител, выбирается из множества
U ={u(t) : u(t) = ui−1 [0, B], t [ti−1, ti ), i = |
1, N |
, |
u(T ) = uN −1}, |
(3) |
|||||||||||||||||||||
где B – максимальная |
скорость введения донорских антител, зависящая |
||||||||||||||||||||||||
от физиологически допустимых доз применения препаратов. |
|
|
|||||||||||||||||||||||
Начальные условия, характеризующие наличие устойчивой хрониче- |
|||||||||||||||||||||||||
ской формы заболевания, имеют вид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
v(t) = |
a4a5 (a1 −a2 ) |
s(t) = |
a1a3a4 −a2a5a8 |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
, |
|
|
|
|
|
, |
|
|
||||||||||
|
|
a1 |
(a3a4 −a5a8 ) |
a2 |
(a3a4 −a5a8 ) |
|
(4) |
||||||||||||||||||
|
|
|
|
a1 |
|
|
a4a5a6 (a1 −a2 ) |
|
|
t [t0 − τ,t0 ]. |
|
||||||||||||||
|
f (t) = |
, m(t) = |
|
, |
|
|
|||||||||||||||||||
|
|
|
a1a7 (a3a4 −a5a8 ) |
|
|
||||||||||||||||||||
|
|
|
|
a2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Начальный момент t0 = 0 соответствует началу лечения. В таблице пред- |
|||||||||||||||||||||||||
ставлены значения параметров модели. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
Параметры базовой модели заболевания |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Форма |
a1 |
|
a2 |
|
a3 |
a4 |
|
a5 |
|
a6 |
|
|
a7 |
|
|
a8 |
τ |
m |
|||||||
Хроническая |
1 |
|
0,8 |
|
|
|
1000 |
0,17 |
|
0,5 |
|
|
10 |
|
0,12 |
|
8 |
0,5 |
0,1 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Острая |
2 |
|
0,8 |
|
|
|
19 000 |
0,17 |
|
0,5 |
|
|
10 |
|
0,12 |
|
8 |
0 |
0,1 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для построения критерия управления на отрезке [0, T] зададим равномерную сетку
|
|
|
|
T |
|
|
|
|
|
||||
Ω = ti : ti = i∆t, i =1, N, |
∆t = |
|
, |
(5) |
||
|
||||||
|
|
N |
|
|||
на которой зафиксируем значения концентрации антигенов опорного решения. В качестве опорного решения будем задавать участок фазовой траектории функции v (t), соответствующий полному выведению антигенов в острой форме заболевания. С помощью управления необходимо в узлах сетки (5) достичь равенства концентрации антигенов заданным значениям:
v(ti ) = vi , i = |
1, N |
. |
(6) |
Таким образом, необходимо построить управление, обеспечивающее выполнение условия (6) в решении задачи (1)–(4).
