
2 курс / Биохимия / Книжки и сборники / Biokhimia_dlya_chaynikov
.pdfТаблица 6.2. Некоторые из возможных
окислительно-восстановительных реакций
Потеря одного или более электронов |
Получение одного или больше электронов |
Получение кислорода |
Потеря кислорода |
Потеря атома водорода |
Получение атома водорода |
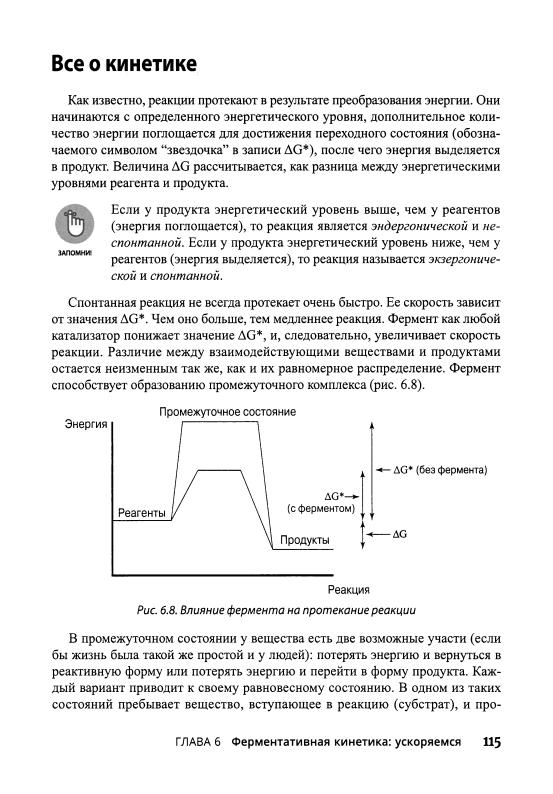
Рассмотрим реальный пример: сукцинатдегидрогеназа катализирует окис- ление иона сукцината. В этом случае окисление заключается в потере двух атомов водорода с образованием транс-двойной связи. Фермент алкогольдеги- дрогеназа удаляет два атома водорода из спирта, что приводит к образованию альдегида. Ниже приведен общий несбалансированный вид этих реакций:
Сукцинатдегидрогеназа ,- QQCCH = СНОО
СН3СН2ОН Алкогольдегидрогеназа > СН3СНО
Вам здесь не место: трансферазы
Функция трансферазы заключается в активировании переноса группы от
одной молекулы к другой. Лминотрансфераза переносит аминогруппу, а фос-
фотрансфераза переносит фосфорильную группу. Общая, несбалансирован-
ная форма этих реакций приведена на рис. 6.1.
R — |
сн— |
сосг |
о |
Лминотрансфераза |
|
|
|
NH3+ |
+ |
R — С — |
СОО- |
|
|
|
|
|
|
R’— СН— |
СОСГ |
О |
|
|
|
|
NH3+ |
+ |
R — С — СОО- |
|
О |
|
|
О |
|
|
о— |
р — |
о- + |
R 'OH Фосфотрансфераза -п— р — |
0 + |
ROH |
|
R |
О- |
|
|
О- |
R' |
|
Рис. 6.7. Общая несбалансированная форма двух катализированных
реакций переноса
110 ЧАСТЬ 2 Фундамент биохимии: белки
Вода всему голова: гидролазы
Гидролазы выступают катализатором расщепления связей в результате при-
соединения молекулы воды (как к Н, так и ОН). Протекание реакции зависит от уровня pH и сопровождается потерей ионов водорода. Фосфатаза катали- зирует гидролиз монофосфатных сложных эфиров, а пептидаза катализирует гидролиз пептидной связи. Общая форма этих реакций показана на рис. 6.2.
|
о |
|
|
|
о |
|
R |
С |
N |
R' + |
НОН ÿ™ R |
С |
О" + +H3N R' |
|
|
Н |
|
|
|
|
о— |
О |
|
|
|
|
|
р — |
о- |
+ нон |
фосФатаза R |
он + |
ню42- |
R О-
Рис. 6.2. Общая форма двух катализированных реакций гидролиза
Разбираем на составляющие: лиазы
Лиазы выступают катализаторами отделения групп. Этот процесс сопрово-
ждается образованием двойной связи или присоединением группы к двойной
связи. Дезаминаза помогает отделить аммоний, а декарбоксилаза выступает
катализатором потери С02. В общем виде эти реакции проиллюстрированы на рис. 6.3.
R СН2-СН R' Дезаминаза R CH=CH-R’ + NH3
NH2
н
R С |
COO- Декарб°ксилаза R СН2 + о=С=0 |
|
NH3+ |
NH3+ |
|
Рис. 6.3. Общая форма двух реакций, катализированных лиазами |
|
|
|
ГЛАВА 6 Ферментативная кинетика: ускоряемся |
Ш |
Перетасуем колоду: изомеразы
Рацемаза и эпимераза относятся к изомерам. Ферменты изомеразы катали- зируют переход одного изомера в другой. Рацемаза, изображенная в верхней части рис. 6.4, катализирует реакцию рацемизации энантомеров. Эпимераза,
подобная показанной в нижней части рис. 6.4, выступает катализатором пре-
образования одного эпимера в другой. Как и другие реакции катализации эти процессы равновесные.
н о |
он Рацемаз^ |
|
сн3 |
о |
|
H2N с— с— |
H2N |
с— |
с— он |
||
сн3 |
|
|
н |
|
|
- |
|
|
- |
аланин |
|
L аланин |
|
|
D |
||
сн2-он |
|
|
сн2-он |
||
с=о |
|
|
с=о |
||
н— с— он |
Эпимераза |
HQ |
с |
н |
|
н— с— он о |
н— с— он о |
||||
|
•р — о~ |
|
сн2-о Р О” |
||
|
О" |
|
|
|
О" |
0-рибулоза-5-фосфат 0-ксилулоза-5-фосфат
Рис. 6.4. Примеры реакций, катализируемых рацемазой
и эпимеразой
Собираем все вместе:лигазы
Фермент лигаза является катализатором объединения двух молекул, меж-
ду которыми формируется ковалентная связь. При протекании такой реакции
часто образуются высокоэнергетические связи, подобные задействованным в АТФ. Рис. 6.5 иллюстрирует действие двух лигаз: пируваткарбоксилазы и
ацетил-СоА-синтетазы. Пируваткарбоксилаза катализирует образование С-С
связи, а ацетил-СоА-синтетаза — образование С-S связи.
112 ЧАСТЬ 2 Фундамент биохимии: белки

индуцируются в субстрате, в ферменте или в них обоих. Модификации запу- скают процесс реакции. На рис 6.7 проиллюстрирован принцип применения модели индуцированного соответствия для описания такого же фермент-суб-
стратного комплекса как на рис. 6.6.
0W Субстрат
wWV Фермент
/ |
\у1 ^ |
Фермент-субстратный |
у |
комплекс |
WWV
Рис. 6.6. Модель замок-ключ, описывающая катализ ферментов
(дЛчдУ— Субс,рат
*Фермент
/ /\ / |
/\ \ |
|
Фермент-субстратный |
|
V |
|
V / |
^ |
комплекс |
WV |
|
|
|
|
|
7V |
|
|
|
Рис. 6.7. Модель индуцированного соответствия для катализа ферментов
114 ЧАСТЬ 2 Фундамент биохимии: белки

не вызывает увеличения скорости реакции, потому что в растворе не остается
фермента, который в состоянии взаимодействовать с дополнительными моле-
кулами субстрата. Скорость большинства реакций стремиться к уровню насы-
щения по гиперболической кривой. Теоретически, скорость реакции достигает насыщения только при бесконечной концентрации субстрата.
Действительный график скорости реакции, V, в зависимости от концентра-
ции субстрата (рис. 6.9) предоставляет мало полезных (а зачастую совершенно
неинформативных) сведений. Соответствующий опыт проводится при посто-
янной концентрации фермента. Особый интерес вызывает уровень максималь-
но возможной скорости реакции, Vmax. Действительная скорость реакции стре-
миться к Vmax асимптотически. При низкой концентрации субстрата реакция наблюдаются кинетические процессы первого порядка, когда скорость реакции зависит только от концентрации реагентов. При высоких концентрациях ки- нетический процесс переходит в фазу нулевого порядка — скорость реакции не зависит от концентрации реагентов. (Позже в этой главе показано, как из-
меняется график при более сложных взаимодействиях фермент-субстратной
системы.) В области между участком нулевого порядка и участком первого по- рядка проходят смешанные кинетические процессы, которые сложно отделить
один от другого. Ключевыми для участков с низкой концентрацией (первый
порядок) с точки зрения анализа выступают значения!4Vmax и Км, где Км — это
Скорость реакции (V )
|
« •••—••••- |
• |
<- |
Vmax, |
/«• |
|
|
||
f |
V z Kmax |
|
|
|
i \ |
Концентрация субстрата |
Км,
Рис. 6.9. Зависимость скорости реакции от концентрации субстрата
ГЛАВА 6 Ферментативная кинетика: ускоряемся |
117 |

ступ). Анализ каждого фермента предоставляет дополнительные сведения о
заболевании.
Например, человек упал с лестницы и получил перелом сразу нескольких ко-
стей и потерял сознание. Его забрали в больницу, где измерили концентрацию
СК всыворотке крови. Как и ожидалось, она оказалась повышенной. Опытный врач сразу же направит пациента на анализ концентрации СК-МВ. Если СК-МВ также оказывается намного выше нормы, тоэтоуказывает на то, что вероятной причиной падения с лестницы был сердечный приступ. Поставив правильный диагноз, врач назначит своевременную терапию, которая с большой вероят-
ностью предотвратит необратимое повреждение сердечной мышцы.
Исследование ферментов:
уравнение Михаэлиса-Ментен
Одним из прорывов в изучении ферментивной кинетики было получение уравнения Михаэлиса-Ментен. Сегодня биохимики могут применять его для
обработки кинетических данных и описания поведения множества ферментов.
(Существуют исключения, в которых график зависимости скорости реакции от концентрации субстрата отличается от приведенного на рис. 6.9.) В общем слу-
чае результаты кинетических опытов описывают поведение аллостерических
(регуляторных) ферментов. Уравнение Михаэлиса-Ментен имеет следующий
вид.
v =~ [ K] js\_'
S + K y
где V — скорость реакции, [S] — концентрация субстрата, Vmax — максималь- ная скорость реакции, а Км— константа Михаэлиса. Как показано на рис. 6.9, скорость катализа, К, увеличивается линейно при низкой концентрации суб- страта, но начинает выравниваться при повышении концентрации. Интерпре- тация начинается с проверки следующего общего пути реакции.
|
* |
> |
ES к_ |
|
Е + Р, |
|
|
Е + S < k-'1 |
|
2 |
|||
где Е — это фермент, S — субстрат, ES — |
к |
фермент-субстратный комплекс, |
||||
а Р — |
продукт. Различные частные случаи |
относятся к константам скорости |
||||
разных этапов; отрицательная константа скорости характерна для обратного процесса. На первом этапе отдельные фермент и субстрат объединяются, об-
разуя фермент-субстратный комплекс (переходное соединение). Скорость об-
разования ES равняется кх. После образования ES может распасться на Е и S
ГЛАВА 6 Ферментативная кинетика: ускоряемся |
119 |
