
- •1. Экзаменационные вопросы
- •Уровни организации ферментов.
- •Механизм действия ферментов. Понятие об активном центре фермента, этапы ферментативного катализа.
- •Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от различных факторов. Уравнение Михаэлиса-Ментен, роль Кm и Vmax в характеристике фермен- тов.
- •Ингибиторы ферментов. Типы ингибирования. Графическое представление зависимости скорости ферментативной реакции от присутствия ингибиторов различных типов.
- •Механизмы регуляции активности ферментов. Примеры.
- •Аллостерические ферменты. Регуляция их активности. При- меры.
- •Энзимодиагностика. Энзимотерапия. Примеры.
- •Введение в обмен веществ. Биологическое окисление
- •Важнейшие признаки живой материи. Особенности живых организмов, как открытых термодинамических систем.
- •1 Закон термодинамики:
- •2 Закон термодинамики:
- •4.Представление о биологическом окислении. Сопряжение экзергонических и эндергонических процессов в организме (на примере фосфорилирования глюкозы).
- •7. Окислительное фосфорилирование: сущность, биологическое значение процесса.
- •9. Окислительное декарбоксилирование пировиноградной кислоты: схема процесса, связь с синтезом атф. Строение пируватдегидрогеназного комплекса: ферменты, коферменты, регуляция процесса.
- •Обмен углеводов
- •1 Схема-
- •2 Схема-
- •3 Этап оу – промежуточный обмен
- •Роль фосфорилазы при мобилизации гликогена
- •Обмен аминокислот, белков и нуклеотидов
- •Глюкозо-аланиновый цикл
- •Реакции глюкозо-аланинового цикла (выделен рамкой). Реакции, связанные с транспортными формами аммиака
- •Обмен липидов и липопротеидов
- •Гидролиз эфиров холестерина
- •Стеаторея
- •Этапы биосинтеза желчных кислот
- •Регуляция синтеза желчных кислот
- •Образование вторичных желчных кислот. Энтерогепатический цикл.
- •Метаболизм кетоновых тел при голодании
- •Биологические мембраны. Перекисное окисление липидов
- •1. Основные мембраны клетки и их функции.
- •2. Строение и состав мембран: структура и свойства липидов,белков, углеводов мембран. Общие свойства мембран и их функции.
- •3. Трансмембранный перенос малых молекул. Типы переноса веществ через мембрану. Трансмембранный перенос макромолекул и частиц. Механизмы мембранного транспорта
- •Проницаемость плазматической мембраны
- •Пассивный транспорт
- •Простая диффузия
- •Облегченная диффузия
- •Особенности облегченной диффузии
- •Активный транспорт
- •Ионные каналы
- •Эндоцитоз
- •Экзоцитоз
- •Функции биологических мембран
- •4. Механизмы трансмембранной передачи гормонального сигнала в клетку.
- •5. Активные формы кислорода (афк). Биологическое действие афк. Ферментативные и неферментативные системы, генерирующие афк.
- •6. Стадии свободно-радикального окисления липидов.
- •7. Повреждающее действие первичных и вторичных продуктов пероксидного окисления на мембраны и другие структуры клетки.
- •8. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •9. Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •10. Роль афк в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Роль афк в антимикробной защите грудного молока.
- •11.Роль пероксидного окисления при гипоксии (ишемии). Факторы гипоксии, инициирующие пол. Понятие о «кислородном» и «кальциевом» парадоксах.
- •12. Простагландины и лейкотриены: схема синтеза и их биологические функции.
- •Гормоны. Гормональная регуляция метаболических процессов
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология Гипофункция
- •Биохимия питания и печени. Нервная, мышечная и соединительная ткани. Биохимия крови
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Двойственная роль креатинфосфата
- •Пути генерации атф и восстановление атф в мышечных клетках миокарда
- •Механизм мышечного сокращения
- •Этапы цикла мышечного сокращения
- •Миозиновая регуляция сокращения
- •Сравнение актин-миозинового взаимодействия в 2-х видах мышц
- •Механизм расслабления поперечнополосатого мышечного волокна
- •Метаболические нарушения при инфаркте миокарда
- •Лабораторная диагностика инфаркта миокарда
- •Обмен железа: основные функции, пул железа в организме, всасывание в жкт, «ферритиновый блок».
- •Поступление экзогенного железа в ткани из кишечника
- •Нарушение метаболизма железа
- •4 Семестр
- •Диабет и мутации митохондрий.
Диабет и мутации митохондрий.
Механизм регуляции высвобождения инсулина β клетками поджелудочной железы тесно связан с уровнем АТФ.
Дефект гена глюкокиназы (изофермент глюкокиназа4) приводит к появлению диабета с фенотипом МОД2. Из-за низкой активности глюкокиназа блокируется секреция инсулина.
Мутация генов тРНК также нарушает выработку АТФ и может возникнуть диабет
II типа.
При генетических мутациях НАДФ трансгидрогеназы-важного механизма защиты от АФК, повреждение митохондрий уменьшает выработку АТФ, блокируя высвобождение инсулина β клетками.
Итак, мутации митохондриального генома накапливаются в течение жизни организма. Мутации в генах, которые кодируют компоненты дыхательной цепи, АТФсинтазу, систему защиты от АФК, а также мутации в генах тРНК вызывают у
человека ряд заболеваний, чаще всего поражающих мышечный аппарат, сердце, мозг, поджелудочную железу.
Полиморфизм гена апобелка Е, клиническое значение.
Аллельный полиморфизм гена aполипопротеина Е (ApoE) - генетический маркер риска нарушений липидного обмена
Исследование аллельного полиморфизма гена ApoE имеет прогностическое значение, позволяющее определить риск развития ишемической болезни сердца вследствие нарушения липидного обмена.
Ген ApoE кодирует аминокислотную последовательность белка aполипопротеина Е. Aполипопротеин Е синтезируется в печени и головном мозге, и играет существенную роль в метаболизме липидов. Aполипопротеин Е входит в состав жировых частиц хиломикронов и липопротеинов очень низкой плотности (ЛПОНП), инициируя их захват и удаление из крови через взаимодействие со специфическим рецептором на поверхности клеток печени. АроЕ участвует в некоторых других процессах, таких как иммунорегуляция, нервная регенерация и активация некоторых липолитических ферментов (липазы печени, липазы липопротеинов и лецитин-холестерин ацилтрансферазы). Он необходим для доставки холестерина от глиальных клеток мозга до нейронов. Эффективность взаимодействия ApoE с рецепторами определяется уникальным строением белковой молекулы.
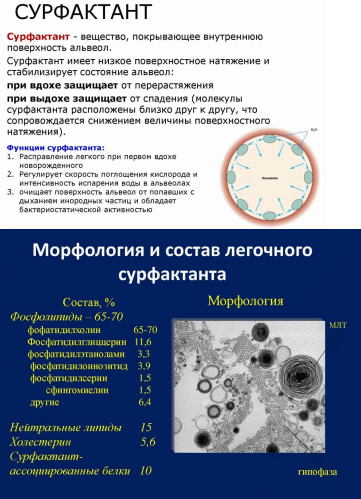
Биохимические основы синдрома дыхательных расстройств. Строение сурфактатнта.

Лабораторная диагностика панкреатитов.

Молекулярные механизмы патогенеза острого панкреатита.

Патогенетические особенности нейродегенеративных заболеваний нервной системы.
Амилоидоз - маркер нейродегенеративных заболеваний.
Такие заболевания как болезнь Альцгеймера, Хантингтона,
Паркенсона являются результатом нарушения нормального процесса формирования структуры белка. Растворимый белок за счет неправильного фолдинга белка превращается в нерастворимые внеклеточные амилодные волокна. Такие заболевания относят к амилоидозам.
Отложение амилоида приводит к разрушению клеток. Болезнь Альцгеймера вызвана отложением внеклеточного амилоида нейронами при участии белка βамилоида. Отложение амилоида является одной из ведущих причин заболевания, кроме того у таких больных происходит агрегация белка тау, который вызывает лобновисочную деменцию. С возрастом значительно увеличивается количество окисленных белков, в ходе таких реакций образуются альдегиды и свободные радикалы. Образующиеся β-амилоидные агрегты усиливают образование пероксида водорода, формируется окислительный стресс.
Сывороточный белок амилоид яляется нормальным белком- предшественником фибрилярного тканевого белка, синтезирующегося в печени.
Амилоид А является маркером острой фазы воспаления.
Стимулятором его увеличения в сыворотке является интерлейкин1. Амилоид явялется фибрилярным белком, амилоидоз-диспротеиноз сопровождается глубоким нарушение белкового обмена, появлением в межуточной ткани и стенках сосудов амилоида, то есть – амилоидных фибрилл, которая у людей с болезнью Альцгеймера откладывается в виде бляшек на поверхности нейронов. В амилоиде много β слоев, ориентированных перепендикулярно амилоидной фибрилле. В β амилоидном белке возникают вытянутые двухслойные параллеьные β
складки, которые могут взаимодействовать друг с другом, образовывая волокна. Прогрессирующее накопление бляшек β амилоида связанны с нарушением 3-х генов: 1) с мутациями в гене его предшественника; 2) мутации в генах предшественников
прессенилинов (PS-1, PS-2), что способствует секреции β амилоида и образованию его формы с повышенной склоностью к агрегации. Амилоидозы бывают вызваны наследуемыми мутациями лизоцима, αцепи фибриногена А, аполипотеинов А1, АII. Амилоидный белок обычно секретируется только пораженой тканью, так что его высокая концентрация вокруг этой ткани приводит к отложению амилоидных волокон.
Амилоидозы относятся к системным заболеваниям. Первичный системный амилоидоз может быть вызван отложением волокон, состоящих из неправильно свернутых легких цепей иммуноглобулинов или их фрагментов.
У пациентов с хроническими ифекционными или воспалительными заболеваниями, такими как ревматоидный артрит, туберкулез, кистозный фиброз, некоторые формы рака усиливается секреция амилоида А. Этот белок в виде волокон откладывается в селезенке, почках, печени, в области сердца- это вторичный амилоидоз. β-амилоид, который играет главную роль в возникновении болезни Альцгеймера происходит из большого тансмембранного белка, который называется белком-предшественником β-амилоида или АРР ( amiloid-β precursor protein), он обнаружен во многих тканях.
38. Маркеры заболеваний бронхолёгочной системы. Механизмы повреждающего действия полимеров α1-антитрипсина.
α-1антитрипсин относится к белкам острой фазы. Воспалительные процессы могут усиливать его образование и способствовать повреждению печени.
Основная функция α-1антиприпсина -защита легких от действия эластазы нейтрофилов. Выраженный дефицит ингибитора ведет к нарушению физиологического баланса между протеазами и ингибиторами в ткани легких, следствием чего является раннее развитие энфиземы легких, и респираторного дистресс-синдрома.
α -1антитрипсин является гликопротеидом, синтезируемым в печени. Он обеспечивает
90% активности, ингибирующей трипсин в крови, α-1антитрипсин тормозит не только действие трипсина, но и химотрипсина, эластазы, калликреина, катепсинов, и других тканевых протеаз.
Ингибиторы сериновых протеаз (серпины) – суперсемейство белков, широко распространенных в живых организмах, включая растения, вирусы, животных. К ним относятся α -1антитрипсин, ингибитор фактора С1- комплемента, антитромбин III, ингибитор активатора плазминогена 1 (PAJ 1) занимающих ключевые позиции в процессах воспаления, системе комплемента, коагуляции и фибринолизе.
Все члены суперсемейства серпинов имеют с α -1 антитрипсином схожесть третичной структуры.
В основе пространственной структуры серпинов лежат 3 участка, уложенных в форме β структуры (А-С) и подвижная петля, которая представляет последовательность аминокислот, играющих роль псевдосубстрата для протеазы. У α -1 антитрипсина в состав петли входит последовательность метионин-серин, выполняющий функцию «приманки» для эластазы нейирофилов. Эластаза, связавшись с ингибитором при участии петли, неспособна катализировать гидролиз пептидной связи. Этот комплекс узнается печеночными рецепторами и удаляется из кровотока.
Динамика содержания α -1антитрипсина при воспалительных процессах.
Содержание α -1антитрипсина повышается при воспалительных процессах:
Острых и хронических инфекционных заболеваний;
Гепатитах;
При вакцинации;
Послеоперационных состояниях; Остром и хроническом панкреатите; При злокачественных образованиях.
Понижается:
Врожденный дефицит ингибитора, сочетающийся с ювенильной базальной энфиземой легких, муковисцидозом;
При вирусном гепатите (нарушение синтеза в печени);
Респираторный дистресс-синдром;
Коагулопатия;
В острой фазе термической травмы.

