
- •1. Экзаменационные вопросы
- •Уровни организации ферментов.
- •Механизм действия ферментов. Понятие об активном центре фермента, этапы ферментативного катализа.
- •Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от различных факторов. Уравнение Михаэлиса-Ментен, роль Кm и Vmax в характеристике фермен- тов.
- •Ингибиторы ферментов. Типы ингибирования. Графическое представление зависимости скорости ферментативной реакции от присутствия ингибиторов различных типов.
- •Механизмы регуляции активности ферментов. Примеры.
- •Аллостерические ферменты. Регуляция их активности. При- меры.
- •Энзимодиагностика. Энзимотерапия. Примеры.
- •Введение в обмен веществ. Биологическое окисление
- •Важнейшие признаки живой материи. Особенности живых организмов, как открытых термодинамических систем.
- •1 Закон термодинамики:
- •2 Закон термодинамики:
- •4.Представление о биологическом окислении. Сопряжение экзергонических и эндергонических процессов в организме (на примере фосфорилирования глюкозы).
- •7. Окислительное фосфорилирование: сущность, биологическое значение процесса.
- •9. Окислительное декарбоксилирование пировиноградной кислоты: схема процесса, связь с синтезом атф. Строение пируватдегидрогеназного комплекса: ферменты, коферменты, регуляция процесса.
- •Обмен углеводов
- •1 Схема-
- •2 Схема-
- •3 Этап оу – промежуточный обмен
- •Роль фосфорилазы при мобилизации гликогена
- •Обмен аминокислот, белков и нуклеотидов
- •Глюкозо-аланиновый цикл
- •Реакции глюкозо-аланинового цикла (выделен рамкой). Реакции, связанные с транспортными формами аммиака
- •Обмен липидов и липопротеидов
- •Гидролиз эфиров холестерина
- •Стеаторея
- •Этапы биосинтеза желчных кислот
- •Регуляция синтеза желчных кислот
- •Образование вторичных желчных кислот. Энтерогепатический цикл.
- •Метаболизм кетоновых тел при голодании
- •Биологические мембраны. Перекисное окисление липидов
- •1. Основные мембраны клетки и их функции.
- •2. Строение и состав мембран: структура и свойства липидов,белков, углеводов мембран. Общие свойства мембран и их функции.
- •3. Трансмембранный перенос малых молекул. Типы переноса веществ через мембрану. Трансмембранный перенос макромолекул и частиц. Механизмы мембранного транспорта
- •Проницаемость плазматической мембраны
- •Пассивный транспорт
- •Простая диффузия
- •Облегченная диффузия
- •Особенности облегченной диффузии
- •Активный транспорт
- •Ионные каналы
- •Эндоцитоз
- •Экзоцитоз
- •Функции биологических мембран
- •4. Механизмы трансмембранной передачи гормонального сигнала в клетку.
- •5. Активные формы кислорода (афк). Биологическое действие афк. Ферментативные и неферментативные системы, генерирующие афк.
- •6. Стадии свободно-радикального окисления липидов.
- •7. Повреждающее действие первичных и вторичных продуктов пероксидного окисления на мембраны и другие структуры клетки.
- •8. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •9. Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •10. Роль афк в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Роль афк в антимикробной защите грудного молока.
- •11.Роль пероксидного окисления при гипоксии (ишемии). Факторы гипоксии, инициирующие пол. Понятие о «кислородном» и «кальциевом» парадоксах.
- •12. Простагландины и лейкотриены: схема синтеза и их биологические функции.
- •Гормоны. Гормональная регуляция метаболических процессов
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология Гипофункция
- •Биохимия питания и печени. Нервная, мышечная и соединительная ткани. Биохимия крови
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Двойственная роль креатинфосфата
- •Пути генерации атф и восстановление атф в мышечных клетках миокарда
- •Механизм мышечного сокращения
- •Этапы цикла мышечного сокращения
- •Миозиновая регуляция сокращения
- •Сравнение актин-миозинового взаимодействия в 2-х видах мышц
- •Механизм расслабления поперечнополосатого мышечного волокна
- •Метаболические нарушения при инфаркте миокарда
- •Лабораторная диагностика инфаркта миокарда
- •Обмен железа: основные функции, пул железа в организме, всасывание в жкт, «ферритиновый блок».
- •Поступление экзогенного железа в ткани из кишечника
- •Нарушение метаболизма железа
- •4 Семестр
- •Диабет и мутации митохондрий.
Стеаторея
Панкреатическая. Нарушение синтеза или секреции липолитических ферментов в кишечник при заболеваниях поджелудочной железы (панкреатит, муковисцидоз), при врожденном или приобретенном дефиците панкреатической липазы.
- гидролиза жиров, поэтому с калом выделяется значительное количество нерасщеплённых жиров в виде мелких жировых включений.
Гепатогенная. Нарушено поступление желчи в тонкую кишку вследствие закупорки общего желчного протока камнем (холестаз) или при наличии опухоли.
- эмульгирования, поэтому замедляется гидролиз липидов и они обнаруживаются в кале в виде крупных жировых включений.
- мицеллообразования: не всасываются гидрофобные продукты гидролиза и жирорастворимые витамины А, Д, Е, К
Этапы катаболизма жирных кислот: реакции, ферменты. Энергетический эффект полного окисления С16:0. Регуляция процесса β-окисления ВЖК.

Окисление жирных кислот в митохондриях до СО2 и Н2О – является одним из главных способов получения энергии.
Окислению предшествует:
• активация ВЖК (для ослабления стабильности С-С связей),
• транспорт ацил-КоА через мембрану из цитозоля в матрикс митохондрий, где локализованы ферменты окисления.
Активация ВЖК в цитозоле протекает при участии HSКоА, АТФ и фермента ацил-КоА синтетазы:
Далее пирофосфат гидролизуется ферментом пирофосфатазой:
Н4Р2О7 + Н2О → 2 Н3РО4
и дополнительная энергия, выделенная при гидролизе макроэргической связи пирофосфата, обеспечивает полноту протекания реакции активации ВЖК.
Ацил-КоА синтетазы находятся как в цитозоле, так и в матриксе митохондрий. Они отличаются специфичностью к жирным кислотам с различной длиной радикала.
Транспорт ВЖК из цитозоля в матрикс для коротко- и средне-цепочечных жирных кислоты (до С14) осуществляется без переносчиков, поскольку они легко проникают через мембрану митохондрий.
Для переноса кислот с более длинным радикалом (их большинство) требуется специальная карнитиновая транспортная система.
На наружной мембране митохондрий имеется фермент карнитинацилтрансфераза I, которая катализирует образование сложноэфирной связи между ацильной и спиртовой группами карнитина:

Ацил-карнитин в цитозоле связывается с белком транслоказой, встроенной в наружную мембрану митохондрий и после прохождения через межмембранное простанство, на внутренней стороне митохондриальной мембраны происходит обратная реакция – образование ацил-СоА без затраты АТФ с участием фермента - карнитин-ацил-трансфераы II. Высвобождаемый карнитин возвращается назад за последующим остатком насыщенной жирной кислоты.

Рис.2-2. Транспорт жирных кислот через мембраны митохондрий.
C помощью карнитина происходит также удаление из митохондрий разветвленных ацильных остатков, которые образуются в результате распада аминокислот. В почках карнитин участвует в переносе и выведении ацильных групп, которые не могут метаболизироваться в организме.
Процесс β- окисления: локализация, последовательность реакций, ферменты. Биологическое значение. Регуляция процесса β-окисления. Энергетический эффект окисления ВЖК (на примере пальмитиновой кислоты).
Во многих тканях окисление жирных кислот - важный источник энергии. Это ткани с высокой активностью ферментов ЦТК и дыхательной цепи - клетки красных скелетных мышц, сердечная мышца, почки. Эритроциты, в которых отсутствуют митохондрии, не могут окислять жирные кислоты. Жирные кислоты не служат источником энергии для мозга и других нервных тканей, так как они не проходят через гематоэнцефалический барьер, как и другие гидрофобные вещества.
β-окисление - это аэробный процесс катаболизма жирных кислот путём последовательного отщепления двууглеродных фрагментов в виде ацетил-СоА. Ацетил-СоА может вступать в цитратный цикл и окисляться до СО2 и Н2О, а образовавшийся укороченный ацильный остаток вновь вовлекается в следующий цикл β-окисления. В результате β-окисления ВЖК полностью расщепляются до ацетил-СоА.
Для полного распада, например, 16-углеродной молекулы пальмитиновой кислоты требуется семь таких повторяющихся циклов.
Окисление происходит по β-атому углерода и включает четыре последовательные реакции:
• дегидрирование (окисление)
• гидратация • дегидрирование (окисление)
• тиолазная реакция Субстраты: свободные насыщенные жирные кислоты с четным числом атомов углерода.
Локализация: митохондрии.
Ферменты, катализирующие реакции окисления:
• длинноцепочечных жирных кислот, связаны с внутренней мембраной митохондрий.
• средне- и короткоцепочечных жирных кислот, локализованы в матриксе митохондрий.
1. дегидрирование ацил-СоА с участием кофермента FAD (используется, когда отщепляются «Н» от атомов с одинаковой электроотрицательностью) с появлением двойной связи при С2 и образованием транс-изомера (природные ВЖК – цис-изомеры).

2. Гидратация протекает против правила Марковникова (из-за эффекта сопряжения электронная плотность смещается к электроотрицательному атому кислорода и на β-С возникает частично положительный заряд): ОН-группа присоединяется к β-С (отсюда название процесса).

3. Дегидрирование при β-С с участием NAD+ (отщепляет водороды от атомов с различной электроотрицательностью) приводит к образованию оксосоединения.
4.Расщепление дестабилизированной С-С связи при участии НSСоА (тиолиз), которое приводит к образованию: АсСоА и укороченного ацилСоА. Далее цикл повторяется до полного расщепления ацилСоА на двухуглеродные фрагменты.
Суммарное уравнение β-окисления, например пальмитоил-КоА может быть представлено таким образом:
С15Н31СО-КоА + 7 FAD + 7 NAD+ + 7 HSKoA +7Н2О→ →8 CH3-CO-KoA + 7 FADH2 + 7 (NADH + H+)
Далее восстановленные эквиваленты окисляются в цепи переноса электронов: НАДН+Н+ +1/2О2 ->НАД+ +Н2О;
Биологическое значение окисления жирных кислот заключается в обеспечении организма энергией, теплом и водой. Карнитинацилтрансфераза I - регуляторный фермент β-окисления: активаторы - АДФ, АМФ, ацил-КоА 2 2 ингибиторы - АТФ, малонил-КоА (печень).
Регуляция окисления ВЖК устроена так, что процесс окисления происходит только при недостатке энергии. Скорость окисления ВЖК зависит от скорости их транспорта из цитозоля в митохондрии, которой контролируется регуляторным ферментом – карнитинацилтрансферазой I и зависит от соотношения количества малонил-КоА/ацил-КоА. Чем выше в клетке концентрация малонил-КоА, тем ниже скорость переноса жирных кислот в матрикс митохондрий, так как малонил-КоА — аллостерический ингибитор карнитинацилтрансферазы I, а ацил-КоА —его активатор.
Ингибированием карнитинацилтрансферазы I малонил-СоА обеспечивает подавление окисления жирных кислот каждый раз, когда в печень поступает слишком много глюкозы, из избытка которой активно синтезируются ТАГ. Два фермента β-окисления: β-оксиацил-СоА дегидрогеназа и тиолаза ингибируются по типу отрицательной обратной связи: избыток НАДН -ингибитор βоксиацил-СоА дегидрогеназы, а высокие концентрации ацетил-СоА ингибируют тиолазу.
Катаболизм жирных кислот в мышцах регулируется соотношением АТФ/АДФ, т.е. при повышении АТФ в клетке активность карнитинацилтрансферазы I снижается. Жирные кислоты не поступают в митохондрии и β-окисления не происходит. Энергетический эффект окисления насыщенной жирной кислоты. Митохондиральное окисление жирных кислот протекает в три стадии: • на первой стадии происходит – окисление, где жирные кислоты подвергаются последовательному окислительному отщеплению двухуглеродных фрагментов в виде АсСоА. • на второй стадии окисления АсСоА окисляются до СО2 в ЦТК, который также протекает в матриксе.
• Восстановленные эквиваленты (НАДН и ФАД. Н2), полученные на первой стадии, далее окисляются в цепи переноса электронов.
За один цикл β-окисления образуются:
• 1 моль ацетил-КоА, окисление которого в цитратном цикле обеспечивает синтез 12 моль АТФ.
• 1 моль FADH2 и 1 моль NADH, окисление которых в дыхательной цепи дает 2 и 3 моль АТФ соответственно.
При окислении пальмитиновой кислоты проходит 7 циклов β-окисления и образуется 8 моль ацетил-КоА, 7 моль FADH2 и 7 моль NADH+Н+. Следовательно, выход АТФ составляет 35 АТФ при β-окислении и 96 АТФ в результате цитратного цикла, что в сумме дает 131 моль АТФ. Поскольку активация ЖК требует затраты 1 АТФ, то из 131 следует вычесть 1 моль АТФ.
Общая формула для подсчета выхода АТФ при полном окислении насыщенных ВЖК записывается следующим образом: [(n/2. 10)] + (n/2-1). 5]-1 = число моль АТФ при катаболизме 1 моль жирной кислоты где n — число С атомов в молекуле ВЖК; n/2 — 1 — число циклов β-окисления; 5 — выход АТФ в одном цикле β-окисления; n/2 — число ацетильных остатков; 10 — выход АТФ при полном окислении ацетил-КоА в цитратном цикле до СО2 и Н2О. -1АТФ – затрачена на активацию ацилКоА.
Этапы биосинтеза жирных кислот: реакции, ферменты. Регуляция процесса биосинтеза ВЖК.
Синтез высших жирных кислот локализован в эндоплазматической сети клетки. Непосредственным источником синтеза является малонил-КоА, образующийся из ацетил-КоА и оксида углерода (IV) при участии АТФ:

Следует подробнее остановиться на характеристике ацетил-КоА-карбоксилазы, поскольку она является полифункциональным ферментом. Ацетил-Ко А-карбоксилаза представляет собой полипептидную цепь, имеющую доменную структуру; каждый домен в полифункциональном ферменте обладает определенной каталитической активностью. Некоторые домены в своем составе могут иметь кофакторы (коферменты). Ацетил-КоА-карбоксилаза содержит биотинкарбоксилазы, биотин-карбоксилпроводящий домен и домен транскарбоксилазы. Все три домена согласованно ускоряют синтез малонил-КоА, который поступает на второй полифункциональный фермент - синтетазу высших жирных кислот, - при посредстве которого и происходит синтез ВЖК.
В составе синтетазы ВЖК выделяют три домена, каждый из которых несет определенную функциональную нагрузку. Первый домен отвечает за элонгацию цепи, второй - за восстановление цепи ВЖК, третий - за высвобождение синтезированного ацила ВЖК из комплекса с ферментом в виде ацила-КоА. Рассмотрим процесс синтеза ВЖК, выделяя работу каждого домена.
Начальным этапом синтеза ВЖК является конденсация малонил-КоА с ацетил-КоА:
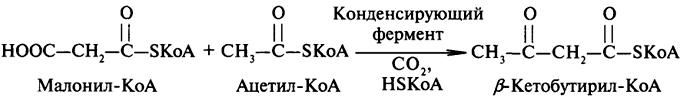
Образовавшийся β-кетобутирил-КоА сначала восстанавливается доβ-оксибутирил-КоА, который далее с участием дегидратазы превращается в кротонил-КоА, содержащий двойную связь. Кротонил-КоА восстанавливается до бутирил-КоА.
Следует подчеркнуть, что ферменты редуктазы в своем составе содержат НАДФ. Работу второго домена синтетазы ВЖК можно представить следующей цепью превращений:

Биосинтез ВЖК носит циклический характер. Синтезированный бутирил-КоА вступает в новый цикл превращений, представленных выше. Для синтеза, например, пальмитиновой кислоты нужно семь таких циклов; в каждом цикле происходит удлинение ацила на два углеродных атома. По достижении ацильным радикалом длины в 16 и более атомов углерода происходит его отщепление от фермента третьим доменом, обладающим тиоэстеразной активностью.

Схема 1. Основные этапы биосинтеза жирных кислот
Мобилизация ТАГ в жировой ткани. Регуляция процесса и судьба продуктов липолиза.
ТАГ используется в организме после их предварительного расщепления (липолиза), в ходе которого освобождаются глицерин и свободные жирные кислоты.
Мобилизация жиров, т.е. гидролиз до глицерола и жирных кислот, происходит в постабсорбтивный период при голодании и активной физической нагрузке.
В клетках жировой ткани распад ТАГ происходит при участии липаз.
ТАГ-липаза отщепляет одну жирную кислоту у первого углеродного атома глицерола с образованием диацилглицерола, который далее с участием ДАГ- и МАГ липаз гидролизуется до глицерола и жирных кислот:
Глицерол, как водорастворимое вещество, транспортируется кровью в свободном виде, а жирные кислоты (гидрофобные молекулы) - в комплексе с белком плазмы - альбумином. ТАГ-липаза находится в неактивной форме и активируется гормонами (адреналином, норадреналином, глюкагоном, тироксином, глюкокортикоидами, СТГ, АКТГ) в ответ на стресс, голодание, охлаждение.
Активируется ТАГ липаза по каскадному механизму через аденилат-циклазную (АЦ) систему (рис 3-5) по типу фосфорилирования/дефосфорилирования:
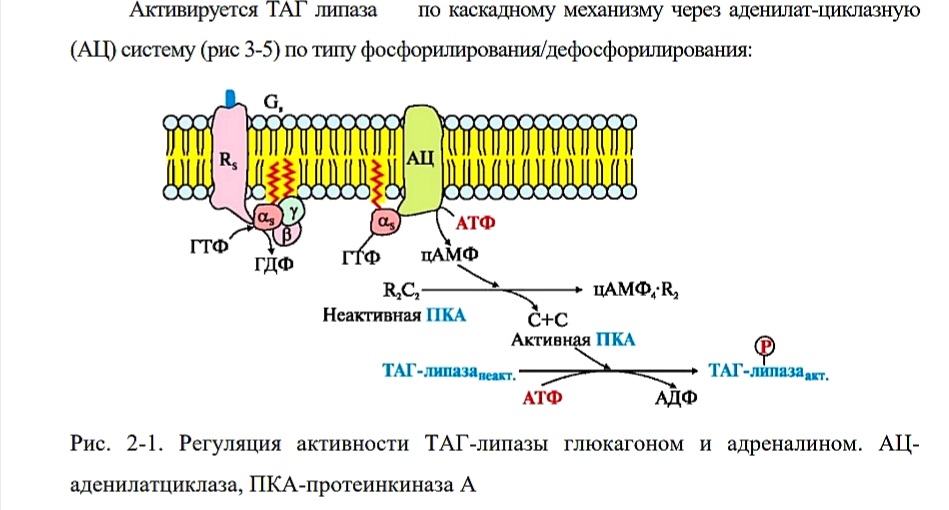
Рис. 2-1. Регуляция активности ТАГ-липазы глюкагоном и адреналином. АЦаденилатциклаза, ПКА-протеинкиназа А В настоящее время известны свыше 200 природных жирных кислот, но наиболее часто в организме человека встречаются не более десяти.
 м
м
Схема синтеза глицерофосфолипидов. Представление о роли лецитина в функционировании сурфактанта легкого.
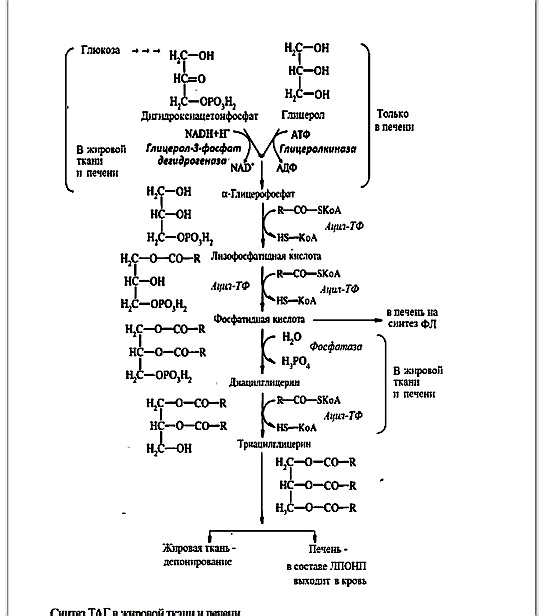
Глицерофосфат образуется:
• восстановлением дигидроксиацетонфосфата (метаболита гликолиза) – в печени и жировой ткани;
• из глицерола – только в печени, а в жировой ткани из-за отсутствия глицеролкиназы глицерин не используется.
Триацилглицеролы образуются при взаимодействии двух молекул ацил-СоА жирных кислот с глицерол-3-фосфатом c выделением фосфатидной кислоты. К первому углеродному атому глицерол-3-фосфата в большинстве случаев присоединяется насыщенная жирная кислота, а ко второму углеродному атому переносится остаток насыщенной или ненасыщенной жирной кислоты. Далее фосфатидная кислота дефосфорилируется до диацилглицерина, который затем ацилируется третьей молекулой ацил-СоА с образованием триацилглицеринов
Роль лецитина в формировании сурфактанта.
Дыхание. Фосфолипиды лецитина являются «строительным материалом» для лёгочного сурфактанта — смеси веществ, выстилающих изнутри лёгочные альвеолы. Сурфактант обеспечивает нормальный газообмен в лёгких: кислород попадает в кровь, а углекислый газ удаляется из крови. Нарушение этого процесса ведёт к гипоксии организма, и лецитин способен предотвратить её развитие.
Функции сурфактанта:
снижает поверхностное натяжение альвеол и обеспечивает их стабилизацию
предупреждает спадение альвеол, обеспечивает несмачиваемость при вдохе
улучшает диффузию газов, увеличивает растяжимость легких
препятствует пенообразованию
Биосинтез ТАГ: последовательность реакций, субстраты, ферменты. Особенности синтеза в печени, жировой ткани, энтероцитах. Регуляция процесса.
Запасание жиров в жировой ткани - основная форма депонирования источников энергии в организме человека. Жиры являются самыми высококалорийными веществами в организме, так как жирные кислоты, входящие в их состав, являются наиболее восстановленными молекулами (т.е. содержащими много связей -СН2-), при окислении которых выделяется большое количество энергии.
Характеристика синтеза ТАГ (липогенеза): Период активации абсорбтивный, при при избыточном поступлении в организм углеводов Локализация: цитозоль клеток: печени, жировой ткани, лактирующей молочной железы Субстраты для синтеза ТАГ
• глицерол в виде глицерол-3-фосфат и
• активные формы жирных кислот - ацил-КоА
Основными источниками ВЖК являются:
• хиломикроны, доставляющие экзогенные жиры из кишечника
• ЛОНП, транспортирующие эндогенные жиры, синтезированные в печени из глюкозы
• Ацетил-КоА, образовавшийся при распаде глюкозы.
Скорость освобождения ВЖК из состава липопротеинов зависит от количества и активности липопротеинлипазы (ЛПЛ), которая выходит из адипоцита и фиксируется на поверхности стенки капилляра с помощью гепарансульфата.
Структура и функции холестерина в организме человека. Фонд, пути использования в организме и выведения холестери- на. Метаболическая и гормональная регуляция биосинтеза.
Холестерин – является:
• структурным компонентом мембран клеток
• предшественником: - стероидных гормонов: половых, коры надпочечников, кальцитриола, - желчных кислот - витамина Д3

Схема биосинтеза холестерина в организме человека: локализация, субстраты, ферменты, этапы.
Локализация синтеза холестерола
▪ печень - до 80%
▪ тонкий кишечник - 15-20%,
▪ другие ткани (кожа, кора надпочечников, половые железы) – до 5% Субстраты
▪ ацетил-КоА ▪ НАДФН+Н+
Этапы
Первые стадии синтеза идут в цитозоле клеток, а более поздние на мембранах ЭПР в три этапа:
•I-й этап –образование мевалоновой кислоты
•II-й этап –образование сквалена
•III-й этап – циклизация сквалена и образование холестерина.
Исходным субстратом для синтеза холестерина, как и ВЖК, является ацетилСоА.

На этапе синтеза мевалоновой кислоты:
• происходит конденсация двух молекул ацетил-СоА с участием фермента тиолаза, что приводит к образованию ацетоацетила-СоА,
• который конденсируется с третьей молекулой ацетил-СоА (фермент ГМГ-СоА-синтаза) с образованием шести-углеродного соединения âгидрокси-â-метилглутарил-СоА (HMG-СоА).
• Далее происходит восстановление ГМГ-СоА до мевалоната, на которое каждая молекула НАФН предоставляет по два электрона. Катализирует реакцию регуляторный фермент ГМГ– редуктаза –интегральный белок гладкого ЭР.
Последовательность реакций I этапа сходна с начальными этапами синтеза кетоновых тел. Однако синтез кетоновых тел протекает в матриксе митохондрий гепатоцитов, а синтез холестерола - в цитозоле клеток.
На этапе образования сквалена: мевалоновая кислота в ходе фосфорилирования и декарбоксилирования превращается в активированную структурную единицу – изопентенилпирофосфат, при полимеризации которого образуется 30-углеродное нециклическое соединение - сквален Далее линейная молекула сквалена превращается в циклическое соединение ланостерол, от которого отщепляются 3 углеродных атома в форме СО2 и образуется холестерин.

Рис. 4-2. Регуляция синтеза холестерола.
Высокие внутриклеточные концентрации холестерина активируют процессы:
• этерификации холестерина и его депонировании в виде эфиров за счет активации фермента АХАТ
• снижение синтеза рецепторов ЛПНП за счет подавление транскрипции гена, кодирующего их синтез, и захват холестерина из крови уменьшается.
Формирование в печени транспортной формы холестерола для доставки его в ткани.
В печени пул холестерина составляется из холестерина:
• синтезированного самими клетками и
• поступившего из остаточных хиломикронов. Этот пул холестерина существует не только для собственных нужд печени, но и для снабжения других тканей.
Большая часть синтезированного холестерола и его эфиров вместе с жирами, синтезированными из глюкозы, удаляется из печени в составе ЛПОНП незрелых. В кровеносном русле ЛПВП передают на ЛПОНП апобелки С-II и Е, и ЛОНП переходят в ЛОНПзрелые. Эти частицы содержат 55% ТАГ, фосфолипиды и апобелки, основным из которых является апопротеин В-100, в меньшей степени содержатся белки: апоС-I, ароС-II, ароС-III и аро Е.

Рис. 4-3. Транспорт эндогенного холестерина в ткани ЛПОНП переносятся кровью от печени в мышечную и жировую ткани, где после активации липопротеин липазы белком аро-CII, происходит высвобождение свободных жирных кислот из триацилглицеринов.
Адипоциты захватывают жирные кислоты и вновь переводят их в жиры, а миоциты сразу же окисляют жирные кислоты с целью получения энергии. При потере триацилглицеринов часть ЛПОНП превращается в остаточные ЛПОНП, называемые липопротеинами промежуточной плотности (ЛППП), при дальнейшем удалении триацилглицеролов из состава ЛПОНП образуются липопротеины низкой плотности (ЛПНП), которые содержат много холестерина и его эфиров.
Поступление холестерина в клетку. Каждая частица ЛПНП в кровяном русле содержит ароВ-100, который распознается рецепторами на мембране клеток, которым требуется холестерин. После связывания ЛПНП с рецептором инициируется эндоцитоз, ЛПНП перемещаются в клетку внутри эндосомы, которая далее сливается с лизосомой. Ферменты лизосомы гидролизуют эфиры холестерина до холестерина и жирных кислот, которые далее попадают в цитозоль. АпоВ-100 из ЛПНП также распадается с образованием аминокислот, а рецептор ЛПНП избегает деградации и вновь попадает цитозоль. Количество рецепторов к ЛПНП (апоВ-100-рецепторов) в мембране клеток регулируется холестеролом: чем выше содержание холестерола в клетке, тем меньше рецепторов в мембране У здоровых людей период полураспада ЛПНП в крови составляет от 21 /2 до 5 сут.

Рис. 4-4. Рецептор-зависимый эндоцитоз ЛПНП клетками тканей
Высвободившийся из лизосом холестерол способен:
• идти на построение мембран, использоваться, для синтеза других стероидов;
• подавлять синтез холестерола в клетке, выступая в роли регуляторного фактора экспрессии гена ГМГ-КоА-редуктазы, а также активировать деградацию этого фермента;
• уменьшать количество апоВ-100-рецепторов в плазматической мембране, снижая экспрессию гена этого рецептора; • частично этерифицироваться под действием фермента АХАТ и в форме эфиров сохраняться в липидных каплях цитоплазмы:
Липопротеины высокой плотности незрелые (ЛВПнезрелые) синтезируются в печени и тонком кишечнике (незначительно) в виде маленьких частиц, богатых белком и фосфолипидами. Они содержат мало холестерина и совсем не содержат эфиров холестерина и имеют дисковидную форму. В состав ЛПВП входят апобелки (апоА-I, апоС-I, апоС-II, апоЕ и др.) и фермент лецитин-холестерин-ацилтрансфераза (ЛХАТ или LCAT), катализирующий образование эфиров холестерина из лецитина (фосфатидилхолина) и холестерина, входящих в состав хиломикронов и ЛПОНП (остаточных): Образовавшиеся эфиры холестерина погружаются в гидрофобное ядро ЛПВП(нез), превращая их из дисковидных частиц и сферические. На освободившиеся места путем простой диффузии перемещаются новые молекулы холестерола из клеточных мембран и ЛПНП. Гидрофобное ядро пополняется эфирами холестерола, пока дисковидная частица не превратится в сферическую (4-5).

Рис. 4-5. Образование липопротеинов высокой плотности зрелых (ЛПВПз)
Образованный лизолецитин связывается с альбумином и уносится с поверхности ЛПВП3 током крови. Недостаток фосфатидилхолина в наружном слое ЛПВП3 устраняют липид-переносящие белки, которые восполняют убыль этого фосфолипида, а также частично освобождают гидрофобное ядро от эфиров холестерола, перенося его на ЛПОНП. Изменения в составе частиц восстанавливают их антиатерогенные свойства, т.е. способность «собирать» холестерол из ЛПНП и мембран клеток, такие липопротеины называются ЛПВП2. Таким образом, ЛПВП освобождают от избытка холестерола клеточные мембраны ЛПНП и снижают вероятность развития гиперхолестеролемии и атеросклероза. При недостатке фосфатидилхолина может замедляться формирование в печени ЛПВП, что приведет к повышению содержания в крови ЛПНП, перегруженных холестеролом, и гиперхолестеролемии.

Рис. 4-5. Метаболизм ЛПВП 1 - в печени формируются ЛПВПпред;
2 - в крови они отдают апобелки С-II и Е ХМ и ЛПОНП; 3 - ЛПВП забирают холестерол с поверхностного слоя ЛПНП и клеточных мембран. Фермент АХАТ превращает холестерол в ацилхолестерол. Частицы приобретают сферическую форму за счет пополнения гидрофобного ядра эфирами холестерола и называются ЛПВП3; 4 - с помощью липид-переносящих белков идет обмен фосфолипидами (ФЛ), эфирами холестерола (ЭХ) и ТАГ между ЛПВП3 и ЛПОНП.
Пополнив содержание фосфатидилхолина (лецитина), ЛПВП2 могут продолжить сбор холестерола из клеточных мембран и ЛПНП; 5 - катаболизм ЛПВП происходит в печени. Богатые холестерином ЛПВП затем возвращаются и поглощаются клетками печени путем эндоцитоза, при этом “выгружая” холестерин. Часть ЛПВП поступает в другие ткани.
Функции жёлчных кислот и его регуляция. Энтерогепатиче- ская циркуляция жёлчных кислот, биологическое значение.
Желчные кислоты: строение, биологическая роль, этапы биосинтеза.
Жёлчные кислоты синтезируются из холестерина в печени.
Известны четыре желчных кислоты, из них две кислоты первичные (синтезируются в печени): холевая, хенодезоксихолевая, а две другие – вторичные (синтезируются в кишечнике под действием ферментов микроорганизмов: дезоксихолевая и литохолевая.
Функции желчных кислот:
• являются мощными эмульгаторами липидов
• активируют липолитические ферменты: панкреатическую липазу, фосфолипазу А2
• снижают уровень холестерина, поскольку являются конечными продуктами его распада и частично выводятся из организма.
