- •1. Экзаменационные вопросы
- •Уровни организации ферментов.
- •Механизм действия ферментов. Понятие об активном центре фермента, этапы ферментативного катализа.
- •Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от различных факторов. Уравнение Михаэлиса-Ментен, роль Кm и Vmax в характеристике фермен- тов.
- •Ингибиторы ферментов. Типы ингибирования. Графическое представление зависимости скорости ферментативной реакции от присутствия ингибиторов различных типов.
- •Механизмы регуляции активности ферментов. Примеры.
- •Аллостерические ферменты. Регуляция их активности. При- меры.
- •Энзимодиагностика. Энзимотерапия. Примеры.
- •Введение в обмен веществ. Биологическое окисление
- •Важнейшие признаки живой материи. Особенности живых организмов, как открытых термодинамических систем.
- •1 Закон термодинамики:
- •2 Закон термодинамики:
- •4.Представление о биологическом окислении. Сопряжение экзергонических и эндергонических процессов в организме (на примере фосфорилирования глюкозы).
- •7. Окислительное фосфорилирование: сущность, биологическое значение процесса.
- •9. Окислительное декарбоксилирование пировиноградной кислоты: схема процесса, связь с синтезом атф. Строение пируватдегидрогеназного комплекса: ферменты, коферменты, регуляция процесса.
- •Обмен углеводов
- •1 Схема-
- •2 Схема-
- •3 Этап оу – промежуточный обмен
- •Роль фосфорилазы при мобилизации гликогена
- •Обмен аминокислот, белков и нуклеотидов
- •Глюкозо-аланиновый цикл
- •Реакции глюкозо-аланинового цикла (выделен рамкой). Реакции, связанные с транспортными формами аммиака
- •Обмен липидов и липопротеидов
- •Гидролиз эфиров холестерина
- •Стеаторея
- •Этапы биосинтеза желчных кислот
- •Регуляция синтеза желчных кислот
- •Образование вторичных желчных кислот. Энтерогепатический цикл.
- •Метаболизм кетоновых тел при голодании
- •Биологические мембраны. Перекисное окисление липидов
- •1. Основные мембраны клетки и их функции.
- •2. Строение и состав мембран: структура и свойства липидов,белков, углеводов мембран. Общие свойства мембран и их функции.
- •3. Трансмембранный перенос малых молекул. Типы переноса веществ через мембрану. Трансмембранный перенос макромолекул и частиц. Механизмы мембранного транспорта
- •Проницаемость плазматической мембраны
- •Пассивный транспорт
- •Простая диффузия
- •Облегченная диффузия
- •Особенности облегченной диффузии
- •Активный транспорт
- •Ионные каналы
- •Эндоцитоз
- •Экзоцитоз
- •Функции биологических мембран
- •4. Механизмы трансмембранной передачи гормонального сигнала в клетку.
- •5. Активные формы кислорода (афк). Биологическое действие афк. Ферментативные и неферментативные системы, генерирующие афк.
- •6. Стадии свободно-радикального окисления липидов.
- •7. Повреждающее действие первичных и вторичных продуктов пероксидного окисления на мембраны и другие структуры клетки.
- •8. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •9. Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •10. Роль афк в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Роль афк в антимикробной защите грудного молока.
- •11.Роль пероксидного окисления при гипоксии (ишемии). Факторы гипоксии, инициирующие пол. Понятие о «кислородном» и «кальциевом» парадоксах.
- •12. Простагландины и лейкотриены: схема синтеза и их биологические функции.
- •Гормоны. Гормональная регуляция метаболических процессов
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология Гипофункция
- •Биохимия питания и печени. Нервная, мышечная и соединительная ткани. Биохимия крови
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Двойственная роль креатинфосфата
- •Пути генерации атф и восстановление атф в мышечных клетках миокарда
- •Механизм мышечного сокращения
- •Этапы цикла мышечного сокращения
- •Миозиновая регуляция сокращения
- •Сравнение актин-миозинового взаимодействия в 2-х видах мышц
- •Механизм расслабления поперечнополосатого мышечного волокна
- •Метаболические нарушения при инфаркте миокарда
- •Лабораторная диагностика инфаркта миокарда
- •Обмен железа: основные функции, пул железа в организме, всасывание в жкт, «ферритиновый блок».
- •Поступление экзогенного железа в ткани из кишечника
- •Нарушение метаболизма железа
- •4 Семестр
- •Диабет и мутации митохондрий.
12. Простагландины и лейкотриены: схема синтеза и их биологические функции.
Простагландины обладают широким спектром действия. В эндокринных железах они стимулируют образование гормонов. В жировой ткани они тормозят липолиз. Действуя на одни и те же ткани, они порой оказывают противоположный эффект:
- регулируют сокращение гладких мышц бронхов, кишечника, матки;
- оказывают влияние на сокращение миокарда;
- регулируют кровоток в почках, контролируют выведение с мочой воды и электролитов;
- регулируют проницаемость капилляров, процессы тромбообразования.
В ЦНС простагландины раздражают центры терморегуляции, вызывая повышение температуры, лихорадку. Повышают чувствительность нервных окончаний к раздражающему действию гистамина.
Предшественником всех простагландинов являются полиненасыщенные жирные кислоты, в частности арахидоновая кислота (и ряд ее производных, дигомо-γ-линоленовая и пентаноевая кислоты, в свою очередь образующиеся в организме из линолевой и линоленовой кислот). Арахидоновая кислотапосле освобождения из фосфоглице-ринов (фосфолипидов) биомембран под действием специфических фосфоли-паз А (или С) в зависимости от ферментативного пути превращения дает началопростагландинам и лейкотриенам по схеме:
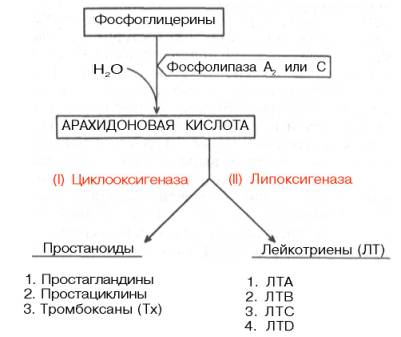
Первый путь получил наименование циклооксигеназного пути превращения арахидоновой кислоты, поскольку первые стадии синтеза простагландинов катализируются циклооксигеназой, точнее простаглан-дин-синтазой В настоящее время известны данные о биосинтезе основных простаноидов. Центральным химическим процессом биосинтеза является включение молекулярного кислорода (двух молекул) в структуру арахидоновой кислоты, осуществляемое специфическими оксигеназами, которые, помимо окисления, катализируют циклизацию с образованием промежуточных продуктов.
Гормоны. Гормональная регуляция метаболических процессов
Биохимия выделительной системы. Минеральный обмен
Гормоны. Классификации гормонов. Иерархический принцип управления в эндокринной системе.
Гормоны – это органические вещества, которые образуются в тканях одного типа (эндокринные железы, или железы внутренней секреции), поступают в кровь, переносятся по кровяному руслу в ткани другого типа (ткани-мишени), где оказывают своё биологическое действие (т. е. регулируют обмен веществ, поведение и физиологические функции организма, а также рост, деление и дифференцировку клеток).
Классификация гормонов
По химической природе гормоны делятся на следующие группы:
1) пептидные – гормоны гипоталамуса, гипофиза, инсулин, глюкагон, гормоны паращитовидных желез;
2) производные аминокислот – адреналин, тироксин;
3) стероидные – глюкокортикоиды, минералокортикоиды, мужские и женские половые гормоны;
4) эйкозаноиды – гормоноподобные вещества, которые оказывают местное действие; они являются производными арахидоновой кислоты (полиненасыщенная жирная кислота).
По месту образования гормоны делятся на гормоны гипоталамуса, гипофиза, щитовидной железы, паращитовидных желёз, надпочечников (коркового и мозгового вещества), женские половые гормоны, мужские половые гормоны, местные или тканевые гормоны.
По действию на биохимические процессы и функции гормоны делятся на:
1) гормоны, регулирующие обмен веществ (инсулин, глюкагон, адреналин, кортизол); 2) гормоны, регулирующие обмен кальция и фосфора (паратиреоидный гормон, кальцитонин, кальцитриол);
3) гормоны, регулирующие водно-солевой обмен (альдостерон, вазопрессин);
4) гормоны, регулирующие репродуктивную функцию (женские и мужские половые гормоны);
5) гормоны, регулирующие функции эндокринных желёз (адренокортикотропный гормон, тиреотропный гормон, лютеинизирующий гормон, фолликулостимулирующий гормон, соматотропный гормон);
6) гормоны стресса (адреналин, глюкокортикоиды и др.);
7) гормоны, влияющие на ВНД (память, внимание, мышление, поведение, настроение): глюкокортикоиды, паратиреоидный гормон, тироксин, адренокортикотропный гормон)
Свойства гормонов
1) Высокая биологическая активность. Концентрация гормонов в крови очень мала, но их действие сильно выражено, поэтому даже небольшое увеличение или уменьшение уровня гормона в крови вызывает различные, часто значительные, отклонения в обмене веществ и функционировании органов и может привести к патологии.
2) Короткое время жизни, обычно от нескольких минут до получаса, после чего гормон инактивируется или разрушается. Но с разрушением гормона его действие не прекращается, а может продолжаться в течение часов и даже суток.
3) Дистантность действия. Гормоны вырабатываются в одних органах (эндокринных железах), а действуют в других (тканяхмишенях).
4) Высокая специфичность действия. Гормон оказывает своё действие только после связывания с рецептором. Рецептор – это сложный белок-гликопротеин, состоящий из белковой и углеводной частей. Гормон связывается именно с углеводной частью рецептора. Причём строение углеводной части имеет уникальную химическую структуру и соответствует пространственному строению гормона. Поэтому гормон безошибочно, точно, специфично связывается только со своим рецептором, несмотря на малую концентрацию гормона в крови.
Иерархический принцип управления в эндокринной системе.
В соответствии с развитием эндокринной системы в процессе эволюции — от внутриклеточной до интегральной для всего организма структуры — изменялись и принципы организации эндокринной системы.
В одиночной клетке-организме регуляция основана на метаболическом контроле, сущность которого заключается в том, что сам регулятор, например глюкоза, непосредственно включается в метаболизм и тем самым оказывает регулирующее влияние на серию процессов.
В дальнейшем гормональная регуляция стала основываться на аллостерическом принципе, при котором регулятор — гормон — непосредственно уже не подвергается метаболической трансформации.
Первоначально и этот механизм возник на уровне еще единичной клетки, примером чего является действие цАМФ, контролирующее углеводный обмен у бактерий. Внеклеточные гормоны обеспечили возможности более сложного типа регуляции: гормон — эффекторная ткань, или метаболит — эндокринная железа. Примером этого может служить система поджелудочная железа — концентрация в крови глюкозы.
Более сложной системой регуляции является механизм, контролирующий продукцию ангиотензина. Последний образуется в крови под влиянием почечного гормона ренина, действующего на ангиотензиноген, продуцируемый печенью.

Механизмы действия гормонов:
Механизмы действия гормонов (мембранный, мембранно-внутриклеточный, цитозольный. Понятие ткани-мишени. (ответ представлен в виде таблицы)
Инсулин: химическая природа, локализация биосинтеза, схема синтеза, механизм действия, органы-мишени, биологиче- ские эффекты.
Структура инсулина:
Инсулин является белком четвертичной структуры, может существовать в формах: мономера, димера, гексамера. Гексамер инсулина стабилизируется ионами цинка.
Инсулин представляет собой полипептид, состоящий из двух полипептидных цепей. Цепь А - 21 аминокислотный остаток, цепь В - 30 аминокислотных остатков, соединены двумя дисульфидными мостиками. В каждой из цепей наблюдаются замены аминокислот в положении 8, 9, 10, которые не влияют на метаболическую активность гормона.
Инсулин - гормон белковой природы, главный анаболический гормон, гормон сытости.
Основные продукты синтеза и секреции, регуляция синтеза и секреции:
Индукция и репрессия гена инсулина регулируется глюкозой, а секреция инсулина индуцируется ионами Ca2+. Секреция инсулина тормозится адреналином, снижается при дефиците ионов кальция, а повышается эстрогенами, кортизолом, секретином, холецистокинином.
Глюкоза регулирует экспрессию гена инсулина, потребление β-клетками глюкозы происходит при участии ГЛЮТ-1- и ГЛЮТ-2-белков ( транспорт глюкозы в жировую ткань и в мышцы происходит с участием белка-переносчика ГЛЮТ-4), в β-клетках глюкоза благодаря глюкокиназе превращается в глюкозо-6-фосфат. При снижении концентрации инсулина транспорт глюкозы приостанавливается.
При стимуляции глюкозой инсулин быстр высвобождается из секреторных гранул, в результате чего происходит транскрипция м-РНК инсулина.
Этапы синтеза и секреции, основные метаболические процессы, регулируемые инсулином.
Этапы синтеза инсулина:
1. Образование сигнального пептида на полирибосомах, связанных с ЭПС, начало синтеза препроинсулина
2. Проникновение сигнального пептида в просвет эндоплазматического ретикулума и направление полипептидной цепи.
3. Образование препроинсулина, содержащий сигнальный пептид из 24 аминокислотных остатков.
4. Отщепление сигнального пептида и образование проинсулина, содержащего 86 аминокислотных остатков.
5. Поступление проинсулин в кмоплекс Гольджи, где под действием специфических протеаз происходит расщепление проинсулина в нескольких участках
6. В результате расщепления проинсулина протеазами происходит образование инсулина, содержащего 51 аминокислотный остаток+ С-пептид, содержащего 31 аминокислотный остаток.
7. Инсулин + С-пептид в эквимолярных количествах включаются в секреторные гранулы.
8. Соединение в гранулах инсулина с Zn2+ (ионы цинка стабилизируют структуру гексамера) с образованием димеров и гексамеров
Этапы секреции инсулина:
Слияние зрелых гранул с плазматической мембраной
Секреция инсулина и С-пептида во внеклеточную жидкость в результате экзоцитоза:
А) транспорт везикулы из места синтеза к плазматической мембране
Б) слияние мембраны везикулы с мембраной клетки
В) высвобождение содержания секретируемой везикулы (инсулина) во внеклеточное пространство
В) объединение липидного бислоя везикулы с внешней мембраной
Распад олигомеров инсулина после секреции в кровь.
Основные метаболические процессы, регулируемые инсулином:
1.Репликация, транскрипция. Инсулин участвует в регуляции клеточной дифференцировки, пролиферации и трансформации.
2.Липолиз, глюконеогенез. Инсулин тормозит процессы липолиза, глюконеогенеза и фосфоролиза гликогена (гликоген фосфорилазы).
3.Проницаемость клеточных мембран для различных веществ. Инсулин повышает проницаемость плазматической мембраны для глюкозы, аминокислот и Са2+.
4.Гликолиз. Инсулин активирует гексокиназу и ключевые ферменты гликолиза: дегидрогеназы цикла трикарбоновых кислот и пентозного пути, редуктазы синтеза жирных кислот.
Метаболические эффекты инсулина:
Инсулин является анаболическим гормоном, который влияет на белковый, углеводный и липидный обмен.
Метаболические эффекты инсулина по времени действия делятся на:
1. быстрые (секунды) — ускорение транспорта глюкозы, аминокислот и калия в инсулинзависимые ткани;
2. медленные (минуты) — стимуляция синтеза белков и торможение их распада, активирование ферментов гликолиза и гликогенсинтазы, угнетение ферментов глиоконеогенеза и фосфорилазы;
3. очень медленные (часы) — увеличение синтеза иРНК, ферментов липогенеза
Влияние на обмен углеводов:
· Увеличивает транспорт глюкозы в клетках (прежде всего и клетки мышечной и жировой тканей). Транспорт глюкозы в клетки происходит при участии специальных белков переносчиков глюкозы (ГЛЮТ-4). В отсутствие инсулина белки - переносчики глюкозы находятся в цитозольных везикулах. Под влитием инсулина происходит перемещение везикул в мембрану клетки.
· Стимулирует синтез гликогена за счет активации гликогенсинтазы и уменьшает распад гликогена за счет ингибирования гликогенфосфорилазы. В печени и мышцах под влиянием инсулина снижается концентрация цАМФ в результате активации фосфодиэстеразы. Кроме того инсулин активирует фосфотазы дефосфорилирующие гликогенсинтазу, в результате чего происходит активация синтеза гликогена и тормозится его распад.
· Усиливает гликолиз за счет повышения активности и количества ключевых ферментов гликолиза: глюкокинозы, фосфофруктокиназы, пируваткиназы, угнетает глюконеогенез, так как снижает активность и количество ферментов обходных реакций глюконеогенеза и гликолиза: пируваткарбоксилазы, Фосфоенолпируват-карбоксикиназы, глюкозо-6-фосфотазы.
· Повышает пентофосфатный путь за счет активации глюкозо-6-фосфатдегидрогеназы.
· Стимулирует превращение глюкозы в жиры.
· Активирует пирукатдегидрогеназный и α-кетодегидрогеназный комплекс
Общий результат стимуляции этих процессов - снижение концентрации глюкозы в крови. Около 50% глюкозы используется в процессе гликолиза, 30-40% превращается в липиды и около 10 % накапливается в форме гликогена.
Влияние на липидный обмен:
· Повышает синтез ВЖК, так как активирует фермент ацетил-КоА-карбоксилазу. Накапливается малонилКоА, который является отрицательным аллостерическим модулятором регуляторного фермента β окисления карнитинацилтрансферазы-1, в результате снижается β-окисление ВЖК.
· Стимулирует синтез жиров, обеспечивая получение для этого процесса необходимых субстратов (ацетил-КоА, α-глицерофосфат и NADPH) из глюкозы.
· Тормозит липолиз, так как активирует фосфатазу, которая дсфосфорилируст и тем самым инактивирует гормончувствительную ТАГ-липазу. Под влиянием инсулина снижается концентрации жирных кислот, циркулирующих в крови.
· Активирует синтез липопротеинлипазы.
· Ингибирует синтез кетоновых тел в печени, так как ацетил-КоА сгорает в ЦТК.
Влияние па обмен белков:
· Ускоряет транспорт аминокислот в клетки.
· Активирует синтез белка.
· Стимулирует пролиферацию клеток, усиливал способность факторов роста активировать размножение клеток.
Глюкагон: химическая природа, механизм действия, органы- мишени, биологические эффекты.
Глюкагон - гормон полипептидной природы, образуется в - клетках островков Лангерганса поджелудочной железы. Особенно много глюкагона синтезируется при голодании, то есть глюкагон является главным гормоном, поддерживающим уровень глюкозы в крови при этом состоянии.
Главные ткани-мишени для глюкагона: печень, жировая ткань, корковое вещество почек, сердечная (но не скелетная) мышца.
В печени гормон стимулирует распад гликогена до глюкозы в течение первых суток голодания. Но, так как запасы гликогена в печени полностью исчезают через сутки, то, начиная со вторых суток голодания, глюкагон активирует в печени глюконеогенез, то есть синтез глюкозы из аминокислот, образующихся при распаде белка. Таким образом, благодаря двум указанным механизмам (увеличению распада гликогена и активации глюконеогенеза в печени), глюкагон поддерживает концентрацию глюкозы в крови во время голодания.
В отличие от адреналина, глюкагон не действует на гликоген мышц. Также в печени глюкагон ингибирует гликолиз, снижает синтез гликогена и жирных кислот, но активирует синтез кетоновых тел.
В жировой ткани глюкагон увеличивает распад жира и тормозит его синтез. В корковом веществе почек глюкагон активирует глюконеогенез. Во всех тканях-мишенях глюкагон увеличивает распад белка, уменьшает его синтез.
Патология. Глюкагонома - опухоль островков Лангерганса, состоящая преимущественно из -клеток.
Адреналин: химическая природа, механизм действия, орга- ны-мишени, биологические эффекты.
Химическая природа- производное аминокислоты тирозина
Место синтеза- мозговое вещество надпочечников
Регуляция синтеза и секреции
· Активируют: стимуляция чревного нерва, стресс.
· Уменьшают: гормоны щитовидной железы.
Механизм действия адреналина(представлен на схеме)

Биологические эффекты адреналина и норадреналина затрагивают практически все функции организма и заключаются в стимуляции процессов, необходимых для противостояния организма чрезвычайным ситуациям.
Адреналин выделяется из клеток мозгового вещества надпочечников в ответ на сигналы нервной системы, идущие из мозга при возникновении экстремальных ситуаций (например, борьба или бегство), требующих активной мышечной деятельности. Он должен мгновенно обеспечить мышцы и мозг источником энергии. Органы-мишени – мышцы, печень, жировая ткань и сердечно-сосудистая система.
В клетках-мишенях имеется два типа рецепторов, от которых зависит эффект адреналина. Связывание адреналина с β-адренорецепторами активирует аденилатциклазу и вызывает изменения в обмене, характерные для цАМФ. Связывание гормона с α-адренорецепторами стимулирует гуанилатциклазный путь передачи сигнала.
В печени адреналин активирует распад гликогена, в результате чего резко повышается концентрация глюкозы в крови (гипергликемический эффект). Глюкоза используется тканями (в основном мозгом и мышцами) в качестве источника энергии.
В мышцах адреналин стимулирует мобилизацию гликогена с образованием глюкозо-6-фосфата и распад глюкозо-6-фосфата до молочной кислоты с образованием АТФ.
В жировой ткани гормон стимулирует мобилизацию ТАГ. В крови повышается концентрация свободных жирных кислот, холестерола и фосфолипидов. Для мышц, сердца, почек, печени жирные кислоты являются важным источником энергии.
Таким образом, адреналин оказывает катаболическое действие.
Адреналин действует на сердечно-сосудистую систему, повышая силу и частоту сердечных сокращений, артериальное давление, расширяя мелкие артериолы.
Кортизол: химическая природа, механизм действия, органы- мишени, биологические эффекты.
Химическая природа кортизола – стероид, что означает, что он легко проникает в клетки. Органами-мишенями являются большинство клеток организма человека
Кортизол секретируется наружным слоем (корой) надпочечников под воздействием адренокортикотропного гормона (АКТГ — гормон гипофиза).
Секреция кортизола зависит от АКТГ, выделение которого в свою очередь регулируется кортикотропин-рилизинг-гормоном (КРГ; кортиколиберин). Эти гормоны связаны между собой классической петлей отрицательной обратной связи .Повышение уровня свободного кортизола тормозит секрецию КРГ. Падение уровня свободного кортизола ниже нормы активирует систему, стимулируя высвобождение КРГ гипоталамусом. Этот пептид, состоящий из 41 аминокислотного остатка, усиливает синтез и высвобождение АКТГ .В коре надпочечников АКТГ повышает скорость отщепления боковой цепи от холестерола — реакции, лимитирующей скорость стероидогенеза в целом. Указанные процессы составляют одну сторону петли отрицательной обратной связи.
По мере нормализации уровня свободного кортизола в крови происходит снижение секреции КРГ гипоталамусом, что ведет к снижению выработки
АКТГ гипофизом, а соответственно и кортизола — надпочечниками; таким образом выполняется вторая половина петли обратной связи. Этот сложный механизм обеспечивает быструю регуляцию уровня кортизола в крови.
Высвобождение АКТГ (и секреция кортизола) регулируется нервными импульсами, поступающими из различных отделов нервной системы. Существует эндогенный ритм, определяющий секрецию КРГ, а следовательно, и АКТГ. Этот циркадианный ритм в норме настроен так, чтобы обеспечивать увеличение кортизола в крови вскоре после засыпания. Во время сна уровень кортизола продолжает возрастать, достигая пика вскоре после просыпания, затем постепенно падает до минимальных величин к концу дня и в ранее вечерние часы. Эта общая динамика возникает в результате последовательных эпизодов импульсного выброса кортизола, которым предшествует импульсная секреция АКТГ. Все вместе эти события составляют сложный цикл, зависящий от светового периода и циклов питания — голодания и сна — бодрствования. Исчезновение суточной периодичности секреции стероидов обычно связано с патологией гипофизарно-адреналовой системы, некоторыми видами депрессивных состояний,а также с дальними перелетами через несколько часовых поясов.
На секрецию кортизола влияют также физический и эмоциональные стрессы, состояние тревоги, страха, волнения и боль. Эти реакции могут нивелировать воздействия системы отрицательной обратной связи и суточного ритма.
Механизм действия кортизола
Нервная система реагирует на внешние воздействия (в том числе стрессовые), посылая нервные импульсы в гипоталамус. В ответ на сигнал гипоталамус секретирует кортиколиберин, который переносится кровью по т.н. воротной системе прямо в гипофиз и стимулирует секрецию им АКТГ. Последний поступает в общий кровоток и, попав в надпочечники, стимулирует выработку и секрецию корой надпочечников кортизола.
Выделившийся в кровь кортизол достигает клеток-мишеней (в частности, клеток печени), проникает путем диффузии в их цитоплазму и связывается там со специальными белками – рецепторами кортизола. Образовавшиеся гормон-рецепторные комплексы после «активации» связываются с соответствующей областью ДНК и активируют определенные гены, что в итоге приводит к увеличению выработки специфических белков. Именно эти белки и определяют ответную реакцию организма на кортизол, а значит, и на внешнее воздействие, послужившее причиной его секреции.
Реакция состоит, с одной стороны, в усилении синтеза глюкозы в печени и в проявлении (разрешении) действия многих других гормонов на обменные процессы, а с другой – в замедлении распада глюкозы и синтеза белков в
ряде тканей, в том числе мышечной. Таким образом, эта реакция направлена в основном на экономию имеющихся энергетических ресурсов организма (снижение их расходования мышечной тканью) и восполнение утраченных: синтезируемая в печени глюкоза может запасаться в виде гликогена – легко мобилизуемого потенциального источника энергии.
Кортизол по механизму обратной связи ингибирует образование АКТГ: по достижении уровня кортизола, достаточного для нормальной защитной реакции, образование АКТГ прекращается.
В кровотоке кортизол связан с кортикостероид-связывающим глобулином – белком-носителем, который синтезируется в печени. Этот белок доставляет кортизол к клеткам-мишеням и служит резервуаром кортизола в крови. В печени кортизол подвергается превращениям с образованием неактивных, водорастворимых конечных продуктов (метаболитов), которые выводятся из организма.
+Глюкокортикоиды оказывают разностороннее влияние на обмен веществ в разных тканях. В мышечной, лимфатической, соединительной и жировой тканях глюкокортикоиды, проявляя катаболическое действие, вызывают снижение проницаемости клеточных мембран и соответственно торможение поглощения глюкозы и аминокислот; в то же время в печени они оказывают противоположное действие. Конечным итогом воздействия глюкокортикоидов является развитие гипергликемии, обусловленной главным образом глюконеогенезом.
Биологические эффекты кортизола в тканях-мишенях.
Основные ткани-мишени- печень, жировые ткани, мышцы
Стимулирует:
· в печени катаболизм АК, глюконеогенез, синтез белков , НК.
· в мышцах катаболзим белков, оюразование АК
· в жировой ткани катаболизм белков, синтез липидов, катаболизм липидов.
Угнетает:
· в мышцах синтез белков
· в жировой ткани синтез белков
Высокие концентрации кортизола стимулируют:
· стимулирует липолиз в конечностях и липогенез в других частях тела(лицо и туловище)
· подавляет имунные реакции, вызывая гибель лимфоцитов, и инфолюцию лимфоидной ткани
· подавляет воспалительную реакцию, снижая число циркулирующих лейкоцитов
Представление о гормональных механизмах реализации стресса.
Представление о гормональных механизмах реализации стресса.
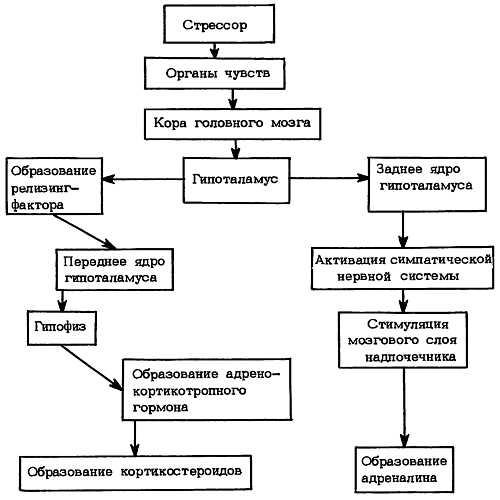
Состояние физичеких и эмоциональных стрессов воспринимают клетки ЦНС и посылают нервные импульсы в мозговой слой надпочечников и в гипоталамус. В мозговом слое надпочечников идет секреция адреналина, а в гипоталамусе синтезируется кортиколиберин (кортикотропин-рилицинг-гормон), подавление которого в гипофизе происходит выработка АКТГ, который воздействует на корковый слой надпочечников.
![]() Длительное
выделение адреналина разрастание
коркового слоя надпочечников и
значительное повышение кортикостероидов.
Длительное
выделение адреналина разрастание
коркового слоя надпочечников и
значительное повышение кортикостероидов.
Патология: феохромацитома– опухоль мозгового слоя надпочечников: повышение выделения адреналина.
Кризис: резко повышается АД, гипергликемия, глюкозурия, головная боль, тошнота, рвота, нарушается зрение => инфаркт миокарда.
Недостаточность – острая и хроническая надпочечная недостаточность.
Болезнь Аддисона – «бронзовая болезнь».
Заболевание развивается медленно: утомляемость, снижение массы тела, гиперпигментация почки с белыми пятнами – витилиго (аутоиммунный процесс).
Гиперпигментация – выброс меланостимулирующего гормона + гиперсекреция АКТГ.
Острая надпочечная недостаточность:
- у новорожденных
- у беременных с тяжелым токсикозом
- сепсис
- тяжелая менингокок.
- ДВС
- обширные ожоги
- обширные хирургические операции.
Биохимические причины возникновения сахарного диабета I типа (ИЗСД) и II типа (ИНСД), биохимические механизмы их возникновения. Лабораторная диагностика сахарного диабета и осложнений.
Сахарный диабет - это заболевание, которое характеризуется гипергликемией, возникающей вследствие абсолютной или относительной инсулиновой недостаточности.
Глюкоза накапливается в крови, т.к. не может проникать в клетки (за исключением клеток печени и мозга).
Выделяют два основных типа сахарного диабета:
I типа
диабет молодого возраста отмечается в 3-5 лет, 11-14 лет - это пики возникновения.
уровень инсулина в крови снижен или не определяется.
характерно острое развитие заболевания.
пациенты имеют худощавый вид.
кетоацидоз (накопление в организме продуктов метаболизма жирных кислот и их токсическое действие, может быть первым проявлением болезни и часто сопровождает течение заболевания).
II типа
возрастной диабет, чаще после 50 лет
уровень инсулина повышен (гиперинсулинемия)
развитие заболевания не острое, постепенное.
заболеванию часто сопутствует ожирение, хотя по мере развития диабета пациенты могут худеть.
кетоацидоз развивается крайне редко.
Лечение.
Сахарный диабет I типа |
Сахарный диабет II типа |
Больные абсолютно зависимы от инъекций инсулина, поэтому такой тип называется ИЗСД - инсулин зависимый сахарный диабет. |
|
Вторичный сахарный диабет
Возникает как следствие генетического заболевания.
Генетические дефекты β-клеток инсулина или действия инсулина.
Акромегалия (гигантизм) - опухоль гипофиза, которая продуцирует избыточное количество соматотропного гормона (роста), СТГ нарушает захват глюкозы жировой и мышечной тканями, путём подавления инсулина.
Феохромоцитома (опухоль мозгового вещества надпочечников) - избыток катехоламинов (адреналин, норадреналин) антагонистов инсулина.
Синдром Иценко-Кушинга (гиперплазмоз коркового слоя надпочечников) - повышенная выработка кортизола, который угнетает захват глюкозы.
Хронический панкреатит или операция на поджелудочной железе - снижение секреции инсулина.
Токсическое воздействие на поджелудочную железу лекарственных средств (статины). Нормально протекающая беременность может сопровождаться транзиторным диабетом, который исчезает.
Диагностика сахарного диабета
Абсолютная или относительная недостаточность инсулина, как подтверждение сахарного диабета, определяется по признаку гиперликемии натощак или выходящее за пределы нормы повышение уровня глюкозы после еды (до 9 мл/л), глюкозурия, кетонурия. В отсутствие симптомов, результаты лабораторных исследований сами по себе, позволяют установить точный диагноз.
Референтные величины концентрации глюкозы в крови
Содержание глюкозы в артериальной крови измеряется с помощью портативного глюкометра. В венозной с помощью биохимических клинико-лабораторных исследований. Однако, содержание в артериальной крови содержание глюкозы выше (на 0,3-0,4 единицы, что составляет погрешность глюкометра):
Новорожденные 2,8-4,4 мМоль/л
Дети 3,9-5,8 мМоль/л
Взрослые 3,9-6,1 мМоль/л
Клинико-лабораторные тесты
Глюкозооксидазный метод - окисление глюкозы глюкозооксидазой с образованием Н2О2, которая затем окисляется пероксидазой - реакция окрашивается, учёт фотометрический.
Глюкозогексокиназный метод. Глюкоза фосфорилируется АТФ гексокиназой, образуя глюкозо-6-фосфат, которая окисляется глюкозо-6-фосфатдегидрогеназой до 6-фосфоглюконата в присутствии НАДФ, восстанавливается в НАДФ-Н, учёт фотометрический (спектральное поглощение 340 нм).
Критерии диагностики сахарного диабета
Диагноз сахарный диабет может быть установлен при наличии одного из следующих критериев:
Клинические симптомы сахарного диабета - полиурия, полидипсия, ожирение или необъяснимая потеря массы тела (глюкоза >11,1мМоль/л).
Уровень глюкозы в плазме крови натощак (отсутствие приёма пищи в течение менее 8 часов) - >7,1 мМоль/л.
Через 2 часа после пероральной нагрузки глюкозы (75г глюкозы) - глюкозтолерантный тест, >11,1мМоль/л или после приёма пищи (>11,1мМоль/л).
Определение глюкозы (мМоль/л) в плазме крови человека натощак
Глюкоза<6,1 мМоль/л 6,1-7,0 мМоль/л >7,0 мМоль/л
диабет маловероятен нарушение толерантности к глюкозе возможен сахарный диабет
Проведение глюкозтолерантного теста (учёт через 2 часа)
Глюкоза <7,8 мМоль/л Глюкоза >7,8 мМоль/л Глюкоза >11,1 мМоль/л
Мероприятия не нужны, Нарушение толерантности Сахарный диабет
диабет маловероятен к глюкозе (диета, наблюдение)
Кроме классических симптомов гиперликемии - глюкозурии, полиурии, жажды, полидипсии и дегидратации, больные с диабетическим кетоацидозом имеют:
Повышенный уровень кетоновых тел в крови и моче (кетонемия, кетонурия).
Запах ацетона при дыхании.
Метаболический ацидоз (низкий уровень РН).
Гипотензия, вследствие нарушения водно-электролитного баланса (потеря К и Na), рвота.
Лабораторная диагностика мочи на сахарный диабет.
Выраженная гипергликемия у больных сахарным диабетом сопровождается пятью классическими симптомами:
Глюкозурия - выведение глюкозы с мочой
Полиурия - увеличение количества мочи
Никтурия - опорожнение мочевого пузыря ночью
Полидипсия - увеличение объёма потребления жидкости
Дегидратация - обезвоживание
Кетонурия - при кетоацидозе в избытке образуются Д-3-гидроксибутират, ацетоуксусная кислота, ацетон
Микроальбуминурия - экскреция альбумина с мочой, превышающая допустимые нормальные значения, для выявления диабетической нефропатии.
Молекулярные механизмы развития сахарного диабета
Находятся на стадии изучения и открытий.
В настоящее время считается, что в развитии СД1 и СД2, и его осложнений, принимает участие иммунное воспаление.
Основу воспалительной реакции составляет цепь биохимических процессов, лежащих в основе иммунных реакций, регуляция которых осуществляется большим количеством нейрогуморальных медиаторов и гормонов. Особое значение имеют семейство низкомолекулярных белков - цитокинов.
Цитокины - это семейство медиаторов, к которым относят интерлейкины, интерфероны и СД-рецепторы лимфоцитов.
Основные этапы воспалительной реакции
Индукторами воспаления являются инфекционные агенты: первично - вирусы, вторично - бактериальные инфекции.

В частности к индукторам сахарного диабета относят Герпес-вирусы, Эпштейн-БАР вирус, цитамегаловирус, Коксаки и др. энтеровирусы. Вирусы нарушают клеточный механизм индукции интерферон – зависимых ионов и конкурирует с гормонами (инсулином). Рецепторами, передающими сигнал являются тирозиновые и Янус-Киназы (1 этап).
происходит активация воспалительных (провоспалительных) цитокинов – ИЛ-1;2;8; фактор некроза опухоли (ФНО), TNF-α, интерферона γ, брадикинина.(2 этап)
Активация лимфоцитов (нейтрофилов и макрофагов) (3 этап)
Фагоцитоз за счет образования Активных форм кислорода и миелопероксидазной активности макрофагов. (4 этап)
Активация брадикинина - медиатора боли. Приводит к образованию NO-радикала и высвобождению гистамина из тучных клеток. Брадикинин расширяет сосуды, гистамин их сужает и вызывает отёк. (5 этап)
Вазоконстрикция сменяет вазодилатацию, нарушается проницаемость сосудов. (6 этап)
Брадикинин стимулирует синтез простагландинов из полинасыщенных жирных кислот, арахидоновой кислоты по циклооксигеназному пути и фактора некроза опухоли (ФНО). (7 этап)
Начинается освобождение противовоспалительных цитокинов - IL-3, IL-4, IL-5, IL-6, IL-10, IL-13, IgE - это способствует процессам восстановления и репарации, этот процесс обладает инсулиноподобным действием, стимулируя захват глюкозы тканями. (8 этап)
Биохимические механизмы адаптации к голоданию, типы го- лодания. Фазы полного голодания. Изменение гормонального статуса и метаболизма при голодании.

Пути использования основных энергоносителей в абсорбтивном периоде:
1 - биосинтез гликогена в печени; 2 - гликолиз; 3 - биосинтез ТАГ в печени; 4 - биосинтез ТАГ в жировой ткани; 5 - биосинтез гликогена в мышцах; 6 - биосинтез белков в разных тканях, в том числе в печени; ЖК - жирные кислоты

Виды голодания.
1. Абсолютное голодание – при отсутствии пищи и воды.
2. Полное голодание – прекращение получение пищи, но с приёмом воды.
3. Неполное голодание (количественное недоедание) – питание, недостаточное по отношению к энергетическим тратам и пластическим нуждам человека. Более или менее равномерный дефицит в рационе питательных веществ – белков, жиров и углеводов ведёт к энергетической недостаточности.
4. Частичное голодание (качественное недоедание) – недостаточное потребление одного или нескольких необходимых пищевых веществ на фоне нормальной, сниженной или даже повышенной энергетической ценности питания. Это проявление одной из неспецифических форм алиментарной недостаточности (например, белковой, витаминной, минеральной).
Частная и смешанная формы голодания являются примерами несбалансированного питания, когда нарушено соотношение пищевых веществ от недостатка одного или нескольких из них. Недостаточность питания возможна и в тех случаях, когда большинство питательных веществ поступает в нужных физиологическим потребностям организма количествах, а некоторые в избытке. Например, содержание в рационе витамина В1 (тиамина) удовлетворяет суточную потребность организма, но имеет место избыточное потребление углеводов. Это может привести к В1-витаминной недостаточности организма, так как расход тиамина увеличивается для обеспечения вхождения углеводов в ЦТК.
Ферментная адаптация при полном голодании
Полное голодание вызывает резкую перестройку метаболических процессов при переходе организма на эндогенное питание. Многие исследователи пытались применить метод голодания в целях лечения болезней.
Длительное голодание характеризуется падением активности большинства ферментов углеводного обмена (глюкокиназы, гексокиназы, НАДФ – зависимых ферментов, ферментов дыхательной цепи и др.), что ведет к снижению интенсивности метаболических процессов в целом. Резко снижается секреция ферментов в пищеварительном тракте. Длительное голодание приводит к глубокому подавлению активности пепсина, гастриксина, химотрипсина, амилазы, липазы. Следствием прекращения поступления пищи являются признаки атрофии пищеварительных желез - полное выключение функции пищеварения, что может быть охарактеризовано как ферментная дезадаптация. Вот почему при возобновлении кормления требуется чрезвычайная осторожность и постепенность количественного увеличения и качественного усложнения рационов питания. Необходим длительный период времени для реабилитации желудочно-кишечного тракта, важнейшим компонентом которого является его ферментная реадаптация.
Стадии процесса ферментной адаптации при голодании
Биохимические наблюдения за голодавшими пациентами в клинике Ю.С.Николаева, позволили выделить следующие стадии: первая-кратковременная характеризуется быстрым исчерпанием резервов гликогена с последующей активацией процессов глюконеогенеза. Запас углеводов истощается за сутки, а энергетический запас достаточен для обеспечения потребностей организма в течение 1-3 суток.
Вспомним, что концентрация глюкозы в крови удерживается на уровне 80 мг/100 мл под действием 3-х основных факторов:
1. мобилизации гликогена и высвобождением глюкозы в печени;
2. выделении жирных кислот жировой тканью;
3. переключении мыщц и печени на использование в качестве источника жирных кислот вместо глюкозы.
Концентрация глюкозы в крови поддерживается на уровне не ниже 50 мг/100 мл. Мозг не выдерживает кратковременного снижения концентрации глюкозы ниже этого уровня. Поэтому при голодании главная задача метаболизма поддержать достаточную концентрацию глюкозы для мозга, а так же эритроцитов, которые зависят от этого субстрата, что на первом этапе достигается глюконеогенезом. Источником аминокислот для этого процесса является мышечная ткань, следовательно, необходимо иметь достаточно большую мышечную массу, чтобы обеспечить глюконеогенез. Концентрация глюкагона и кортизола увеличивается, постепенно нарастает скорость мобилизации жиров для постановки глицерола в глюконеогенез. Секреция инсулина снижается.
ИЗМЕНЕНИЯ ГОРМОНАЛЬНОГО СТАТУСА И МЕТАБОЛИЗМА ПРИ ГОЛОДАНИИ И ФИЗИЧЕСКОЙ РАБОТЕ
1. В постабсорбтивном периоде и голодании уровень глюкозы в плазме крови падает до нижней границы нормы. Отношение инсулин - глюкагон снижается. В этих условиях возникает состояние, для которого характерно преобладание процессов катаболизма жиров, гликогена и белков на фоне общего снижения скорости метаболизма. Под влиянием контринсулярных гормонов в этот период происходит обмен субстратами между печенью, жировой тканью, мышцами и мозгом. Этот обмен служит двум целям:
• поддержанию концентрации глюкозы в крови за счет глюконеогенеза для обеспечения глюкозозависимых тканей (мозга, эритроцитов);
• мобилизации других «топливных» молекул, в первую очередь жиров, для обеспечения энергией всех других тканей.
Проявление этих изменений позволяет условно выделить три фазы голодания. Вследствие переключения метаболизма на режим мобилизации энергоносителей даже после 5-6 недель голодания концентрация глюкозы в крови составляет не менее 65 мг/дл. Основные изменения при голодании происходят в печени, жировой ткани и мышцах (рис. 11.14).
2. Фазы голодания. Голодание может быть кратковременным - в течение суток (первая фаза), продолжаться в течение недели (вторая фаза) или нескольких недель (третья фаза).
В первую фазу концентрация инсулина в крови снижается примерно в 10-15 раз по сравнению с периодом пищеварения, а концентрация глюкагона и кортизола увеличивается. Запасы гликогена исчерпываются, нарастает скорость мобилизации жиров и скорость глюконеогенеза из аминокислот и глицерола, концентрация глюкозы в крови снижается до нижней границы нормы (60 мг/дл).
 Рис.
11.14. Изменения метаболизма основных
энергоносителей при голодании:
Рис.
11.14. Изменения метаболизма основных
энергоносителей при голодании:
1 - снижение инсулин-глюкогонового индекса; 2 - мобилизация гликогена; 3, 4 - транспорт ГЛК в мозг и эритроциты; 5 - мобилизация ТАГ; 6 - транспорт ЖК в мышцы; 7 - синтез кетоновых тел; 8 - транспорт ЖК в печени; 9 - транспорт АК в печень; 10 - глюконеогенез из АК; 11 - транспорт лактата в печень; 12 - транспорт глицерола в печень. Пунктиром обозначены процессы, скорость которых снижается
Во вторую фазу продолжается мобилизация жиров, концентрация жирных кислот в крови повышается, увеличивается скорость образования кетоновых тел в печени и, соответственно, их концентрация в крови; ощущается запах ацетона, который выделяется с выдыхаемым воздухом и потом от голодающего человека. Глюконеогенез продолжается за счет распада тканевых белков.
В третью фазу снижается скорость распада белков и скорость глюконеогенеза из аминокислот. Скорость метаболизма замедляется. Азотистый баланс во все фазы голодания отрицательный. Для мозга важным источником энергии, наряду с глюкозой, становятся кетоновые тела.
3. Изменения метаболизма основных энергоносителей при голодании. Обмен углеводов. Запасы гликогена в организме истощаются в течение 24-часового голодания. Таким образом, за счет мобилизации гликогена обеспечивается только кратковременное голодание. Основной процесс, обеспечивающий ткани глюкозой в период голодания, - глюконеогенез. Глюконеогенез начинает ускоряться через 4-6 часов после последнего приема пищи и становится единственным источником глюкозы в период длительного голодания. Основные субстраты глюконеогенеза - аминокислоты, глицерол и лактат.
4. Обмен жиров и кетоновых тел. Основным источником энергии в первые дни голодания становятся жирные кислоты, которые образуются из ТАГ в жировой ткани. В печени ускоряется синтез кетоновых тел. Синтез кетоновых тел начинается в первые дни голодания. Используются кетоновые тела в основном в мышцах. Энергетические потребности мозга частично обеспечиваются также кетоновыми телами. После 3 недель голодания в мышцах снижается скорость окисления кетоновых тел и мышцы почти исключительно используют жирные кислоты. Концентрация кетоновых тел в крови возрастает. Использование кетоновых тел мозгом продолжается, но становится менее активным из-за снижения скорости глюконеогенеза и снижения концентрации глюкозы.
5. Обмен белков. В течение нескольких первых дней голодания быстро распадаются мышечные белки - основной источник субстратов для глюконеогенеза. После нескольких недель голодания скорость глюконеогенеза из аминокислот снижается в основном вследствие снижения потребления глюкозы и использования кетоновых тел в мозге. Снижение скорости глюконеогенеза из аминокислот необходимо для сбережения белков, так как потеря 1/3 всех белков может привести к смерти. Продолжительность голодания зависит от того, как долго могут синтезироваться и использоваться кетоновые тела. Однако для окисления кетоновых тел необходим оксалоацетат и другие компоненты ЦТК. В норме они образуется из глюкозы и аминокислот, а при голодании только из аминокислот.
Гормоны щитовидной железы: химическая природа и струк- тура, этапы биосинтеза.
Химическая природа:
Тиреоидные гормоны относятся к производным аминокислот и образуются из аминокислоты тирозина.
Место синтеза:
Тиреоидные гормоны синтезируются в клетках эпителия щитовидной железы – в тироцитах
Этапы биосинтеза тиреоидных гормонов:
1 этап. Захватывание ионов йода из крови щитовидной железой при помощи транспортного белка – Na+/K+-АТФазы против высокого градиента концентрации ( йодный насос)
2 этап. Сначала происходит окисление йода до активной формы гипойодита при участии гемсодержащей тиреопероксидазы и Н2О2 в качестве окислителя. Происходит синтез и йодирование гликопротеина тиреоглобулина в тироцитах, Йодирование тирозина на апикальных мембранах клеток фолликулов начала происходит с образованием моноиодтирозина (МИТ) и дииодтирозина (ДИТ).
3 этап. Конденсация двух молекул ДИТ с образованием тироксина (Т4) или МИТ и ДИТ с образованием Т3 происходит в составе молекулы йодтиреоглобулина. Ферментом, катализирующим этот процесс, также является тиреопероксидаза.
4 этап. Протеолиз и секреция тиреоидных гормонов. Йодтиреоглобулин транспортируется из коллоида в фолликулярную клетку (тиреоцит) путём эндоцитоза. Там он гидролизуется ферментами лизосом с освобождением Т3 и Т4.
Регуляция секреции:
1. Тиреолиберин (либерин, синтезируемый в гипоталамусе). Тиреолиберин синтезируется при снижении концентрации йодтиронинов в крови. Благодаря тиреолиберину активируется синтез тиреотропного гормона в аденогипофизе.
2. Тиреотропный гормон ( тропный гормон аденогипофиза) стимулирует выработку йодтиронинов тироцитами. Еще одним стимулом для секреции ТТГ служит снижение концентрации йодтиронинов в крови. Тиреотропный гормон контролирует развитие и функцию щитовидной железы и регулирует биосинтез и секрецию тиреоидных гормонов.
3. Соматостатин – гормон гипоталамуса. Стимулом его секреции является высокий уровень Т3 и Т4 и повышение инсулиноподобного фактора роста (ИФР-1), который в свою очередь стимулируется гормоном роста соматотропином (синтезируется в аденогипофизе). Сам ИФР-1 подавляет синтез и секрецию тиреотропного гормона
Инактивация тиреоидных гормонов:
1.Дейодирование. Процесс протекает вне клеток щитовидной железы. Суть: свободный йод либо включается в синтез Т3 или Т4, либо удаляется с мочой.
Часть тирозина в печени подвергается дезаминированию (тирозин → фумарат + NH3 →цикл трикарбоновых кислот) или декарбоксилированию с образованием дофамина
Другая часть тирозина попадает в щитовидную железу и идет на синтез Т3,Т4
2.Конъюгация продуктов деградации йодтиронинов в печени. Йодированные продукты катаболизма йодтиронинов конъюгируются в печени с глюкуроновой или серной кислотами и экскретируются с жёлчью. В кишечнике конъюгаты гидролизуются ферментами бактерий. При этом освобождаются гормоны, которые затем всасываются.
3. Выведение гормонов через почки. Кровь с гормонами попадает в почки, где происходит дейодирование, окислительное дезаминирование и декарбоксилирование гормонов с образованием трийодуксусной кислоты. Трийодуксусная кислота выводится с мочой.
Гормоны щитовидной железы: механизм действия, органы- мишени, биологические эффекты: влияние на обмен веществ. Понятие о гипер- и гипотиреозе.
Тиреоидные гормоны работают по внутриклеточному механизму.
1.Часть Т3 и Т4 проникают в клетку благодаря своей липофильности. Но большая часть Т3 и Т4 проникает в клетку в виде гормон-рецепторного комплекса, который образуется между Т3,Т4 и специальным рецептором I типа.
2. Периферическое дейодирование Т3 и Т4 происходит в цитозоле клеток. Дейодирование происходит благодаря дейодиназе наружного кольца (ДеНК) и дейодиназе внутреннего кольца (ДеВК) при участии НАДФН+Н; первый фермент (ДеНК) катализирует превращение Т4 в Т3, а второй(ДеВК) - превращение Т4 в реверсивный Т3.
3. Благодаря II типу рецепторов, который находится на ядре и митохондриях, Т4 в Т3 связываясь с ним образуют активный гормон-рецепторный комплекс II – в ядре или в митохондрии комплекс распадается на изначальные компоненты и запускает соответственный биологический эффект.
Синтез тиреоидных гормонов:

Биологические эффекты:
1.Влияние на обмен белков:
А) Повышение активности РНК-полимеразы и синтез РНК. Активируется синтез Nа + /К+ -АТФазы, НАДФ-зависимой малат-ДГ (малик-фермент), митохондриальной αглицерофосфат-ДГ, сукцинат-ДГ, ЦХО.
Б) Регулируют скорость поступления субстрата для синтеза белков (аминокислот, ионов Nа+, К+, Са2+, сахаров, нуклеотидов) в клетку за счет изменения микровязкости мембраны.
В) Оказывают стимулирующее действие на синтез белков.
2.Влияние на обмен углеводов
А) Усиление процесса всасывания углеводов в ЖКТ.
Б) Ускорение процесса распада углеводов. Например, Т3 и Т4 в клетках печени ускоряют гликолиз → образование молочной и пировиноградной кислот → увеличивается распад и уменьшается синтез гликогена в печени.
В) Т3 в физиологических условиях увеличивает в мышцах потребление глюкозы. Т4 мешает углеводам превращаться в жиры. 3.Влияние на обмен липидов
А) Т3 и Т4 в нормальных условиях увеличивают транскрипцию генов, координирующих ферменты липогенеза, , НАДФНзависимой малат-ДГ.
Б) Т3 и Т4 ускоряют синтез холестерина и синтез жёлчных кислот, который происходит в печени.
В)Т3 и Т4 косвенно стимулируют липолиз в жировой ткани.
Г) Усиливают биосинтез фосфолипидов в печени.
Калоригенный эффект - возрастание потребления О2 организмом, сопровождающееся увеличением теплопродукции.
Суть калоригенного эффекта:
Интенсификация обмена веществ приводит к усилению теплопродукции, в ходе которой количество АТФ остается неизменным.
Тиреоидные гормоны усиливают скорость поглощения О2 тканями. Усиленное теплообразование, вызванное действием тиреоидных гормонов, обусловлено увеличением расхода АТФ в энергозависимых процессах, при котором АТФ расщепляется до АДФ, стимулирующий окислительное фосфорилирование.
Понятие о гипер- и гипотиреозе.
Гипотиреоз развивается вследствие недостаточности йодтиронинов.
Обычно это состояние связано с недостаточностью функции ЩЖ, но может возникать и при заболеваниях гипофиза и гипоталамуса. Наиболее тяжёлая форма гипотиреоза, сопровождающаяся слизистым отёком кожи и подкожной клетчатки, называется миксидема. Отёчность обусловлена избытком накопления гликозаминогликанов и воды. При возникновении гипотиреоза у детей старшего возраста наблюдается отставание в росте без задержки умственного развития. У взрослых людей причиной гипотиреоза часто является аутоиммунный тиреоидит, приводящий к нарушению синтеза йодтиронинов (зоб Хашимото), поражение ткани железы ионизирующим излучением, оперативные вмешательства на ней. Гипотиреоз может быть так
же результатом недостаточного поступления йода в организм. Так как это может быть связано с дефицитом йода в почве и воде конкретной местности, компенсаторное увеличение массы железистой ткани ЩЖ в этом случае получило название "эндемический зоб". В результате гипотиреоза снижается основной обмен, скорости гликолиза, мобилизация гликогена и жиров, потребления глюкозы мышцами, уменьшается мышечная масса, снижается теплопродукция. Увеличение массы железистой ткани ЩЖ без изменения продукции гормонов называют эутиреоидным зобом.
Гипертиреоз возникает вследствие повышенной продукции йодтиронинов. Он может иметь место при диффузном токсическом зобе (базедова болезнь, болезнь Грейвса – наиболее распространённом заболевании ЩЖ) или при токсической аденоме ЩЖ. Часто, но всегда при этих заболеваниях происходит увеличение размеров ЩЖ – зоб и развитие тиреотоксикоза. Йодтиронинами, синтезируемыми в избыточном количестве, стимулируются одновременно как анаболические (рост и дифференцировка тканей), так и катаболические (распад углеводов, липидов и белков) процессы. Однако в большей мере усиливаются процессы катаболизма, о чём свидетельствует отрицательный азотистый баланс. Гипертиреоз возникает в результате развития гормонально активной опухоли, избыточного поступления йода, аутоиммунных реакций
Функции почек в организме человека. Процесс образования мочи: клубочковая фильтрация, канальцевые реабсорбция и секреция. Особенности процессов метаболизма в почечной ткани.
Выделительная система – это совокупность органов, выводящих из организма избыток воды, продукты обмена веществ, соли, а также ядовитые соединения, попавшие в организм извне или образовавшиеся непосредственно в нём.
Выделительные процессы — процессы, обеспечивающие удаление из организма конечных продуктов обмена веществ и ксенобиотиков и тем самым способствующие поддержанию постоянства внутренней среды организма и оптимальных условий для жизнедеятельности клеток.
Функции почек.
1. Регулируют ионный состав и ионный баланс организма.
2. Регулируют обмен внеклеточной жидкости в крови.
3. Регулируют кислотно – основное состояние.
4. Поддерживают постоянство осмотического давления крови и других жидкостей.
5. Экскретируют конечные продукты азотистого обмена, и обмена чужеродных веществ, поступивших извне или образовавшихся в избытке в ходе метаболизма (глюкоза и аминокислоты).
6. Принимают участие в регуляции артериального давления крови.
7. Регулируют эритропоэз (выделяют эритропоэтин, который стимулирует синтез клеток крови в костном мозге).
8. Принимают участие в регуляции процесса свёртывания крови (выделяют урокиназу, которая переводит плазминоген в плазмин, активирующий фибринолиз).
9. Секретируют ряд биологически активных соединений (брадикинин, 1,25 – ОН Дз, группу ПГ (простогландинов Е2 и А2), выполняя эндокринную функцию.
10.Экскреторная (выведение или задержка электролитов, воды, продуктов обмена, ионов водорода).
11. Регуляторная (регуляция артериального давления, гемопоэза, кальция, гемостаза).
Процесс образования мочи:
Моча-биологическая жидкость,вырабатываемая почками, и выводимая из организма по системе мочевыводящих путей. Она служит для удаления конечных продуктов обмена(шлаков), избытка соли и воды, а так же посторонних веществ, токсичных образований.
Процесс мочеобразования происходит в нефроне, который является структурно – функциональной единицей почки, и складывается из трёх этапов:
1) клубочковой фильтрации (ультрафильтрации) воды и низкомолекулярных компонентов из плазмы крови в капсулу почечного клубочка с образованием первичной мочи;
2) канальцевой реабсорбции - процесса обратного всасывания профильтровавшихся веществ и воды из первичной мочи в кровь;
3) канальцевой секреции - процесса переноса из крови в просвет канальцев ионов и органических веществ
Особенности метаболизма почечной ткани.
1. Синтез и потребление большого количества АТФ, так как 80% расходуется на активный транспорт.
2. Аэробный тип метаболизма: потребляют 10% от общего использования О2 организмом (при массе почек – 0,4 % от веса).
3. В корковом веществе активен: аэробный гликолиз, глюконеогенез, Е ЛДГ 1,2 (лактатдегидрогеназа), повышены при острой почечной недостаточности в крови.
В почках активен Е – аланин аминопептидаза (ААПз) – 3 –я изоформа. Всего 5 изоформ повышаются при острой почечной недостаточности.
6. Синтезируются инозитфосфатиды для других тканей (клеточных мембран). 7. В почках протекает 1 – ая стадия синтеза креатинфосфата.
7. В почках протекает 1 – ая стадия синтеза креатинфосфата.
Почечные механизмы поддержания кислотно-основного со- стояния плазмы крови.
При медленном поступлении в организм больших количеств воды или солей значительная часть их выводится почками и тем самым почки участвуют в восстановлении нормального осмотического давления крови. Если количества воды или солей поступают в организм очень быстро, то они сначала переходят в мышцы и кожу, а затем постепенно удаляются почками. При введении жидкости непосредственно в кровеносное русло повышается объем крови и артериальное давление, в том числе возрастает давление в приносящей артерии мальпигиева клубочка. Это приводит к увеличению фильтрации и количество образующейся мочи возрастает. Кроме того, повышение давления крови в сосудах раздражает барорецепторы кровеносных сосудов, вследствие чего приносящие артерии клубочков рефлекторно расширяются. Это вызывает увеличение притока крови к клубочкам, в результате чего фильтрация в капсуле и мочеобразование возрастают.
При увеличении концентрации солей в крови и повышении осмотического давления (например, при жажде) увеличивается частота нервных импульсов, которые поступают от осморецепторов, расположенных в супраоптическом ядре гипоталамуса, к нейронам гипоталамуса. Эти нейроны начинают усиленно секретировать физиологически активное вещество, которое поступает по аксонам в заднюю долю гипофиза и превращается в антидиуретический гормон
(вазопрессин). Антидиуретический гормон (АДГ) начинает усиленно выделяться гипофизом в кровь. Поступив в почку, АДГ вызывает увеличение реабсорбции воды и образование более концентрированной мочи. Таким способом организм избавляется от избытка солей при малой потере воды, а это ведет к снижению осмотического давления.
При увеличении содержания воды в крови, возникающем вследствие обильного питья, уменьшается осмотическое давление крови, снижается частота импульсов от осморецепторов к нейронам гипоталамуса. Это приводит к уменьшению секреции АДГ. Меньше АДГ поступает к почкам. В результате уменьшается обратное всасывание воды из первичной мочи в кровь, почка вырабатывает более жидкую вторичную мочу и организм освобождается от излишней воды.
Увеличение концентрации солей в крови, т.е. повышение ее осмотического давления, оказывает также непосредственное влияние на реабсорбции) воды в почечных канальцах. Удерживая с собой некоторое количество воды и препятствуя ее реабсорбции, соли, а в некоторых случаях и другое вещества (например, глюкоза) способствуют увеличению объема выделяемой мочи. Так, при сахарном диабете происходит не только большое выделение глюкозы с мочой, но и увеличивается количество мочи.
Химический состав мочи: органические и неорганические компоненты мочи в норме и их происхождение. Патологические
компоненты мочи и их происхождение. Клиническое значение биохимического анализа мочи.
Химический состав мочи.
Органические компоненты
А) Мочевина – конечный продукт обмена аммиака (NHз).Источники NHз: белки, аминокислоты, пептиды. Мочевина повышается при гиперпротеиновой диете, при повышении распада белков.
Б) Мочевая кислота – конечный продукт распада пуриновых оснований. Повышается при подагре, пище богатой нуклеотидами, лейкемии, гепатитах.
В) Креатинин – конечный продукт распада креатинфосфата, образуется в мышцах. Креатинин используется как эндогенное. Вещество для определения скорости гломерулярной фильтрации.
Г) Гиппуровая кислота – парное соединение в состав которого входит бензойная кислота и глицин, образуется в печени,повышается при употреблении растительной пищи, богатой ароматическими соединениями, из которых
образуется бензойная кислота. При поражении печени, выведение гиппуровой кислоты снижается.
Д) Животный индикан–калиевая соль индоксилсерной кислоты,образуется в печени при обезвреживании индола, поступающего из Толстой кишки,Где он образуется при гниении триптофана. Выделение животного индикана с мочой свидетельствует о функциональном состоянии печени.
И) Безазотистые органические кислоты – оксалат, лактат, цитрат,бутират, валерианат, сукцинат, бетта – оксимасляная кислота и другие.Повышены при усиленной физической нагрузке, особенно – лактат.При алкалозе повышен цитрат и сукцинат.
К) Аминокислоты – продукт распада белков и пептидов. Содержатся в норме до 1 грамма.
Л) Пигменты (урохромы) – придают соломенно – жёлтую окраску моче. К ним относят: стеркабилиноген, глукурониды билирубина, желчные кислоты. Моча темнеет при стоянии за счёт урохромов.
М) Продукты метаболической трансформации гормонов:катехоламинов, стероидов (17 КС), серотонина.По содержанию конечных продуктов можно судить о биосинтезе этих гормонов в организме.Присутствие белкового гормона – хорионического гонадотропина в моче служит показателем беременности.
Неорганические компоненты
В моче присутствуют катионы: Na+, K+, Ca2+, Mg2+,NH4+, и анионы: Cl-, (SO4)2-, (HPO4)2,H2PO4-, а в следовых количествах и другие ионы: Y-,Fe2+, Mn2+.
Биохимическое исследование мочи — это анализ, позволяющий определить содержание биологически важных химических компонентов и сопутствующих продуктов их распада. Его расшифровка позволяет оценить функции органов, ответственных за образование и выведение мочи.
Патологические компоненты мочи и их происхождение
А) Белок. Появление белка в моче - протеинурия.Он появляется при повреждении мочевыводящих путей(внепочечная протеинурия) или базальных мембран нефрона (почечная протеинурия), характерно для пиелонефрита.
Б) Кровь. Симптом появления крови в моче – гематурия.Появление неповреждённых эритроцитов в моче характерно для травм мочевыводящих путей (чаще камней при туберкулёзе, злокачественных новообразованиях).
Появление повреждённых эритроцитов характерно для гломерулонефрита, когда повреждается эпителий почечных клубочков, и эритроцит проходит через клубочковые капилляры и эпителий клубочков.
В) Глюкоза – глюкозурия. Появляется в моче при повышенном употреблении глюкозы, сахарном диабете, стероидном диабете.
Г) Фруктоза – фруктозурия появляется при врождённой недостаточности ферментов, превращающих фруктозу в глюкозу.
Д) Галактоза – галактозурия, врождённая Недостаточность фермента, превращающих галактозу в глюкозу.
Е) Кетоновые тела – кетонурия наблюдается при сахарном диабете, голодании.
Ж) Билирубин – билирубинурия отмечается при желтухах.
З) Креатин – креатинурия выявляется при нарушении превращения креатина в креатинин.
И) Осадки – фосфатурия, уратурия, оксалатурия. Выпадение в осадок солей, наблюдается при Мочекаменной болезни.
К) Мочевая кислота, её повышение наблюдается при повышенном распаде пуриновых оснований – подагре.
Л) Бактерии – бактериурия выявляется в моче при инфекции мочевыводящих путей.
М) Фенилаланин повышен при фенилкетонурии (дефект Е –фенилаланин – гидроксилазы).
Н) Гомогентизиновая кислота повышена при алкаптонурии(дефект Е – оксидазы гомогентизиновой кислоты).
О) 5 – оксипролин увеличен – показатель интенсивности расщепления коллагена и эластина соединительной ткани.
Антидиуретический гормон (вазопрессин): химическая при- рода, механизм действия, органы-мишени, биологические эф- фекты. Несахарный диабет.
АДГ секретируется в супраоптическом ядре гипоталамуса и накапливается в нейрогипофизе. Механизм действия АДГ состоит в том, что под его воздействием усиливается реабсорбция воды в собирательных трубках почек. При снижении секреции АДГ возникает несахарный диабет, который сопровождается выделением больших количеств мочи (иногда десятки литров в сутки), что связано с нарушением реабсорбции воды в собирательных трубках. В больших дозах он вызывает сокращение гладких мышц сосудов (особенно артериол), что приводит к повышению артериального давления.
Альдостерон: химическая природа, механизм действия, органы-мишени, биологические эффекты.
Альдостерон-минералкортикоид, гормон клубочковой зоны коры надпочечников.
Главной тканью-мишенью для действия гормонов является эпителий дистальных канальцев почек, где альдостерон увеличивает реабсорбцию натрия из мочи в кровь. Поэтому альдостерон называют натрийзадерживающим гормоном. Поскольку натрий «тянет» за собой воду, то при избытке минералокортикоидов в организме повышается артериальное давление, усиливаются отеки и воспалительные процессы. Одновременно с увеличением реабсорбции натрия под действием альдостерона возрастает экскреция калия с мочой. Поэтому при избытке гормона в организме снижается концентрация калия в крови, что приводит к повышению возбудимости миокарда, нарушению работы сердца, возникают сильная слабость, характерные изменения на ЭКГ, и может развиться сердечная недостаточность.
Другой тканью-мишенью для минералокортикоидов являются потовые железы. В жару альдостерон препятствует чрезмерной потере натрия с потом. При недостаточном синтезе альдостерона натрий теряется с мочой, что приводит к потере воды, т.е. дегидратации организма. Глюкокортикоиды обладают частичным действием минералокортикоидов, поэтому при длительном применении с лечебной целью глюкокортикоидов больным обязательно назначают препараты калия.
Влияние на солевой обмен гипо- и гиперпродукции альдо- стерона. Система ренин-ангиотензин-альдостерон. Биологиче- ские эффекты ангиотензина II.
Система ренин-анг-альдостерон:
Влияние на солевой обмен гипо- и гиперпродукции альдо- стерона:
В клубочковой зоне происходит синтез минералокортикоидов, основным представителем которых является альдостерон.
Альдостерон усиливает в дистальных канальцах почек реабсорбцию ионов Na+, одновременно увеличивая при этом выведение с мочой ионов К+. Аналогичное усиление натрий-калиевого обмена происходит в потовых слюнных железах, а также в кишечнике. Это приводит к изменению электролитного состава плазмы крови (гипернатриемия и гипокалиемия). Кроме того, под влиянием альдостерона резко возрастает почечная реабсорбция воды, которая всасывается пассивно по осмотическому градиенту, создаваемому ионами Na+. Это приводит к существенным изменениям гемодинамики — увеличивается объем циркулирующей крови, возрастает АД. Вследствие усиленного обратного всасывания воды уменьшается диурез.
При повышенной секреции альдостерона увеличивается склонность к отекам, что обусловлено задержкой в организме натрия и воды, повышением гидростатического давления крови в капиллярах и в связи с этим — усиленной экссудацией жидкости из просвета сосудов в ткани. За счет усиления процессов экссудации и отечности тканей альдостерон способствует развитию воспалительной реакции и является провоспалительным гормоном. Под влиянием альдостерона увеличивается также секреция ионов Н+ в канальцевом аппарате почек, что приводит к снижению их концентрации во внеклеточной жидкости и изменению кислотно-основного состояния (алкалоз).
Снижение секреции альдостерона вызывает усиленное выведение натрия и воды с мочой, что приводит к дегидратации тканей, снижению объема циркулирующей крови и уровня АД. В результате в организме возникают явления циркуляторного шока. Концентрация калия в крови при этом, наоборот, увеличивается, что является причиной нарушения электрической стабильности сердца и развития сердечных аритмий.
Ренин-ангиотензин-альдостероновая система, ее физиологические функции.
Основным фактором, регулирующим секрецию альдостерона, является функционирование ренин-ангиотензин-альдостероновой системы. При снижении АД наблюдается возбуждение симпатической части автономной нервной системы, что приводит к сужению почечных сосудов. Уменьшение почечного кровотока способствует усиленной выработке ренина в юкстагломерулярных нефронах почек. Ренин является ферментом, который действует на плазменный α2-глобулин ангиотензиноген, превращая его в ангиотензин I. Образовавшийся ангиотензин I затем превращается в ангиотензин II, который увеличивает секрецию альдостерона. Выработка альдостерона может усиливаться также по механизму обратной связи при изменении электролитного состава плазмы крови, в частности при гипонатриемии или гиперкалиемии. В незначительной степени секреция этого гормона стимулируется кортикотропином.
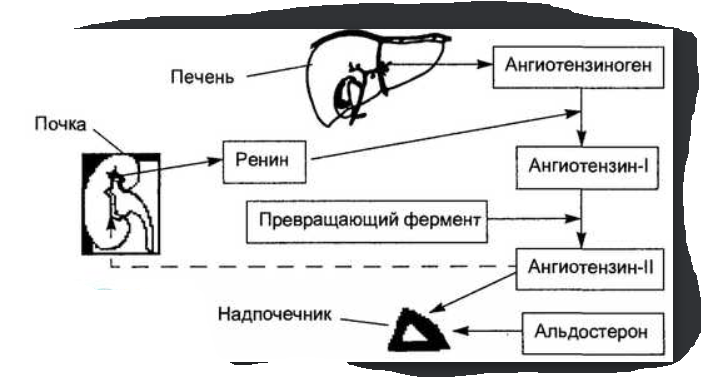
Биологиче- ские эффекты ангиотензина II.
Мощный сосудосуживающий эффект
Вызывает чувство жажды, повышает секрецию АДГ, потенцирует высвобождение норадреналина
Кора надпочечников выделяет альдостерон
Увеличивает скорость гломерулярной фильтрации за счёт сужения эфферентных почечных артериол и повышения давления в почках.
Предсердный натрийуретический фактор (ПНФ): химиче- ская природа, механизм действия, органы-мишени, биологиче- ские эффекты.
Предсердный натрийуретический пептид (ПНП) синтезируется и секретируется кардиомиоцитами предсердий, которыерые содержат гранулы гормона. Это полипептид, циркулирует в крови и имеет 28 аминокислотных остатков.
Стимулирует выделение ПНП растяжение предсердий кровью при увеличении их наполнения - гиперволемии, что приводит к увеличению количества гранул в кардиомиоцитах.
Биологический эффект и механизм действия:
ПНП увеличивает выведение ионов Na+ почками при гиперволемии. Вслед за Na повышается выделение H2O с осмотическим градиентом, что ведет к нормализации объема крови и уменьшение концентрации ионов Na в крови и внеклеточной жидкости. Увеличение экскреции ионов Na почками является следствием влияния ПНП на такие функции клеток-мишеней: расширяет афферентные артериолы в клубочках нефрона, что приводит к увеличению клубочковой фильтрации и поступления ионов Na + в капсулу нефрона; подавляет реабсорбцию ионов Na + в канальцах нефрона, следствием чего является рост выведение ионов Na + с мочой и воды за осмотическим градиентом; тормозит секрецию ренина юкстагломерулярного клетками (ЮГК), в результате чего уменьшается концентрация ангиотензина II и альдостерона, что приводит к снижению реабсорбции ионов Na +.
Паратиреоидный гормон: химическая природа, органы- мишени, биологические эффекты. Влияние на обмен кальция и фосфора гипо- и гиперпродукции ПТГ.
Паратгормон – это гормон белковой природы, который повышает содержание кальция (Са2+) и снижает концентрацию фосфата (Р) в крови.
Действие паратгормона направлено на следующие ткани-мишени:
1) кости – гормон увеличивает выход Са2+ и Р из кости в кровь; тормозит синтез коллагена в остеобластах, увеличивает разрушение минеральной и органической части кости остеокластами и остеоцитами;
2) кишечник – увеличивает всасывание Са2+ и Р из кишечника в кровь;
3) почки – увеличивает реабсорбцию Са2+ из мочи в кровь, но увеличивает выведение Р с мочой. Патология Гиперпаратиреоз – повышенное образование паратгормона, возникающее при опухоли паращитовидных желёз. Так как Са2+ усиленно выходит из кости, то наблюдаются самопроизвольные переломы вследствие рассасывания костной ткани.
Повышение концентрации Са2+ в крови приводит:
а) к окостенению внутренних органов, обызвествлению ушибов, кровоподтёков;
б) к понижению нервно-мышечной возбудимости, что проявляется как атрофия и слабость мышц, а также депрессией, нарушением памяти и внимания.
Избыток паратгормона резко увеличивает секрецию гастрина, что, в свою очередь, приводит к повышению секреции HCl и пепсина в желудке, поэтому при избытке паратгормона могут развиться язвы желудка.
Гипопаратиреоз – может наблюдаться после операций на щитовидной железе, когда по ошибке были удалены и паращитовидные железы, либо возникает у детей при инфекциях дыхательных путей. Такое состояние сопровождается снижением концентрации Са2+ в крови, что приводит к повышению нервномышечной возбудимости. У взрослых наблюдаются конвульсии, судороги, что характеризуется как тетания. У детей может возникнуть спазмофилия, т.е. состояние, когда ребенок во время плача внезапно синеет из-за спазма дыхательных мышц
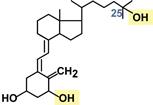
Кальцитриол: химическая природа, этапы синтеза, меха- низм действия, органы-мишени, биологические эффекты. Представление о заболевании «рахит».
Строение кальцитриола |
Представляет собой производное витамина D и относится к стероидам.
Синтез
Образующийся в коже под действием ультрафиолета и поступающие с пищей холекальциферол (витамин D3) и эргокальциферол (витамин D2) гидроксилируются в гепатоцитах по С25 и в эпителии проксимальных канальцев почек по С1. В результате формируется 1,25-диоксихолекальциферол (кальцитриол).
Активность 1α-гидроксилазы обнаружена во многих клетках и значение этого заключается в активации 25-оксихолекальциферола для собственных нужд клетки (аутокринное и паракринное действие).