
- •1. Экзаменационные вопросы
- •Уровни организации ферментов.
- •Механизм действия ферментов. Понятие об активном центре фермента, этапы ферментативного катализа.
- •Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от различных факторов. Уравнение Михаэлиса-Ментен, роль Кm и Vmax в характеристике фермен- тов.
- •Ингибиторы ферментов. Типы ингибирования. Графическое представление зависимости скорости ферментативной реакции от присутствия ингибиторов различных типов.
- •Механизмы регуляции активности ферментов. Примеры.
- •Аллостерические ферменты. Регуляция их активности. При- меры.
- •Энзимодиагностика. Энзимотерапия. Примеры.
- •Введение в обмен веществ. Биологическое окисление
- •Важнейшие признаки живой материи. Особенности живых организмов, как открытых термодинамических систем.
- •1 Закон термодинамики:
- •2 Закон термодинамики:
- •4.Представление о биологическом окислении. Сопряжение экзергонических и эндергонических процессов в организме (на примере фосфорилирования глюкозы).
- •7. Окислительное фосфорилирование: сущность, биологическое значение процесса.
- •9. Окислительное декарбоксилирование пировиноградной кислоты: схема процесса, связь с синтезом атф. Строение пируватдегидрогеназного комплекса: ферменты, коферменты, регуляция процесса.
- •Обмен углеводов
- •1 Схема-
- •2 Схема-
- •3 Этап оу – промежуточный обмен
- •Роль фосфорилазы при мобилизации гликогена
- •Обмен аминокислот, белков и нуклеотидов
- •Глюкозо-аланиновый цикл
- •Реакции глюкозо-аланинового цикла (выделен рамкой). Реакции, связанные с транспортными формами аммиака
- •Обмен липидов и липопротеидов
- •Гидролиз эфиров холестерина
- •Стеаторея
- •Этапы биосинтеза желчных кислот
- •Регуляция синтеза желчных кислот
- •Образование вторичных желчных кислот. Энтерогепатический цикл.
- •Метаболизм кетоновых тел при голодании
- •Биологические мембраны. Перекисное окисление липидов
- •1. Основные мембраны клетки и их функции.
- •2. Строение и состав мембран: структура и свойства липидов,белков, углеводов мембран. Общие свойства мембран и их функции.
- •3. Трансмембранный перенос малых молекул. Типы переноса веществ через мембрану. Трансмембранный перенос макромолекул и частиц. Механизмы мембранного транспорта
- •Проницаемость плазматической мембраны
- •Пассивный транспорт
- •Простая диффузия
- •Облегченная диффузия
- •Особенности облегченной диффузии
- •Активный транспорт
- •Ионные каналы
- •Эндоцитоз
- •Экзоцитоз
- •Функции биологических мембран
- •4. Механизмы трансмембранной передачи гормонального сигнала в клетку.
- •5. Активные формы кислорода (афк). Биологическое действие афк. Ферментативные и неферментативные системы, генерирующие афк.
- •6. Стадии свободно-радикального окисления липидов.
- •7. Повреждающее действие первичных и вторичных продуктов пероксидного окисления на мембраны и другие структуры клетки.
- •8. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •9. Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •10. Роль афк в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Роль афк в антимикробной защите грудного молока.
- •11.Роль пероксидного окисления при гипоксии (ишемии). Факторы гипоксии, инициирующие пол. Понятие о «кислородном» и «кальциевом» парадоксах.
- •12. Простагландины и лейкотриены: схема синтеза и их биологические функции.
- •Гормоны. Гормональная регуляция метаболических процессов
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология Гипофункция
- •Биохимия питания и печени. Нервная, мышечная и соединительная ткани. Биохимия крови
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Двойственная роль креатинфосфата
- •Пути генерации атф и восстановление атф в мышечных клетках миокарда
- •Механизм мышечного сокращения
- •Этапы цикла мышечного сокращения
- •Миозиновая регуляция сокращения
- •Сравнение актин-миозинового взаимодействия в 2-х видах мышц
- •Механизм расслабления поперечнополосатого мышечного волокна
- •Метаболические нарушения при инфаркте миокарда
- •Лабораторная диагностика инфаркта миокарда
- •Обмен железа: основные функции, пул железа в организме, всасывание в жкт, «ферритиновый блок».
- •Поступление экзогенного железа в ткани из кишечника
- •Нарушение метаболизма железа
- •4 Семестр
- •Диабет и мутации митохондрий.
Обмен аминокислот, белков и нуклеотидов
Питательная ценность различных белков. Азотистый баланс. Клинические проявления недостатка белков в пище.
Питательная ценность белков определяется наличием незаменимых аминокислот. Большая часть свободных аминокислот используется для синтеза:
собственных белков организма;
для синтеза биогенных аминов (медиаторов или нейрамедиаторов - глицин, глутамат)
для синтеза гормонов;
для синтеза карнитина и других азотосодержаъцих соединений.
Заменимые аминокислоты — синтез возможен из других веществ. Аланин (Ала), аспартат (Асп), аспарагин (Асн), глутамин (Глу), глутамат (Глн), пролин (Про), глицин (Глн), серин (Сер) - синтезируются в необходимых количествах.
Незаменимые аминокислоты — синтез невозможен в организме человека. Валин (Вал), лейцин (Лей), изолейцин (Иле), метионин (Мет), фенилаланин (Фен), триптофан (Три), лизин (Лиз), треонин (Тре).
Частично заменимые аминокислоты - синтез возможен, но в небольших количествах. Гистидин, аргинин — синтезируются очень медленно, в количествах, не покрывающих потребности организма (детский возраст).
Условно-заменимые аминокислоты – цистеин, тирозин – синтезируются из незаменимых аминокислот — метионина и фенилаланина.
Азотистый баланс – это разница между количеством азота, поступающего с пищей, и количеством азота выделяемого почками в виде мочевины и азотистых солей.
Может быть:
- положительным у детей и беременных женщин, при увеличении мышечной массы у спортсменов, у выздоравливающих после тяжелойболезни, что свидетельствует о преобладании синтеза белков над их распадом.
- отрицательным — при тяжелых заболеваниях, голодании, старении, что свидетельствует об усилении процессов распада белков.
- равным нулю (азотистое равновесие) - у здоровых взрослых людей и нормальном питании.
Клинические проявления недостатка белков в пище:
Боли в мышцах и реже в суставах; замедленный рост (у детей); уменьшение массы и видимого объема мышц; мышечная слабость.
Квашиоркор — вид тяжёлой дистрофии на фоне недостатка белков в пищевом рационе.
Переваривание белков в желудочно-кишечном тракте. Биоло- гическое значение переваривания. Схема процесса. Характери- стика пищеварительных ферментов.
Характеристика пищеварительных ферментов
При переваривании происходит гидролиз пищевых белков до свободных аминокислот. Процесс переваривания начинается в желудке и продолжается в тонком кишечнике под действием ферментов, относящихся к классу пептидаз (пептидегидролаз).
Пептидазы вырабатываются в клетках слизистой желудка в виде проферментов (зимогенов), которые доставляются в полость желудка и тонкого кишечника, где активируются.
Активация зимогенов происходит путем частичного протеолиза - на N-конце ППЦ, где присутствует сигнальный домен профермента.
Преждевременная же активация пропепсина (зимогена) в секреторных клетках слизистой желудка при язвенной болезни.
В желудке при действии пепсина белки пищи денатурируются и гидролизуются до олигопептидов. Панкреатическая (поджелудочная) железа продуцирует хемотрипсин, эластазу, карбоксипептидазу, которые продолжают свою работу в кишечнике, гидролизуя олигопептиды до ди, три, пептидов и свободных аминокислот. Это происходит в пристеночном слое или в клетках кишечного эпителия, где затем они всасываются.


пепсин


Олигопептиды
![]()
Пептиды
Пептидазы
Трипсин
HCO3
Кишечник
(тонкая кишка), аминопептидазы,
дипептидазы, трипептидазы
Поджелудочная
железа, хемотрипсин, эластаза,
карбоксипептидаза



Ди-, трипептиды
Эпителий
кишечника

Аминокислоты

Всасывание
Схема процесса переваривания белков в ЖКТ.
Классификация пептидаз
Все пептидазы, гидролизующие белки, в зависимости от места расположения в пептиде гидролизуемой связи, делятся на эндопептидазы и экзопептидазы.
Эндопептидазы – расщепляют пептидные связи, удаленные от концов пептидные связи (пепсин.трипсин. хемотрипсин. эластаза).
Экзопептидазы – гидролизуют пептидные связи, образованные С-С- концевыми аминокислотами (аминопептидаза, карбоксипептидаза А и В) расщепляют ди- и трипептиды.
Переваривание белков в желудке и кишечнике. Переваривание белков в желудке
Слизистая оболочка желудка для переваривания белков вырабатывает:
пепсиноген, синтезируемый в главных клетках.
соляную кислоту, секретируемую обкладочными клетками.
Пепсиноген — профермент (зимоген), при поступлении пищи секретируется в полость желудка, где происходит его активация в пепсин, (пепсиноген → пепсин). Это происходит в два этапа: 1) медленно под действием HCI образуются малые количества пепсина; 2) быстро аутокаталитически под действием активного пепсина.
Переваривание белков в кишечнике.
Переваривание белков в кишечнике происходит под действием ферментов: поджелудочной железы (трипсин, химотрипсин, эластаз, карбоксипептидазы А и В); эпителия тонкой кишки (аминопептидаза, дипептидазы, трипептидазы).
Трипсин в кишечнике, так же как и пепсин в желудке, образуется в виде зимогена — трипсиногена, а активируется при участии ферментов энтеропептидазы, выделяемой клетками кишечника. Энтеропептидаза отщепляет от N-конца трипсиногена гексапептид, что приводит к изменению конформации молекулы и формированию активного центра трипсина. Активация панкреатических пептидаз (прокарбоксипептидаз, химотрипсиногена, проэластазы) происходит каскадно под действием активного трипсина. В результате образуются свободные аминокислоты, поступающие в клетки кишечника путем вторично-активного транспорта за счёт градиента концентрации (симпорт).
Образование соляной кислоты и её роль в переваривании белков. Регуляция секреции соляной кислоты. Диагностическое значение анализа желудочного сока. Патологические изменения кислотности и патологические компоненты желудочного со- ка.
Функции HCl
1.Участвует в активации пепсиногена и разбухании белков.
2.Создает оптимум рН для пепсина. рН: 1,5-2.0 — (нормальное значение рН желудочного сока)
3.Оказывает бактерицидное действие.
4.Денатурирует белки.
5.Стимулирует выработку фактора Касла слизистой оболочки желудка. Фактор, обеспечивающий утилизацию железа и всасывание витамина В12 в тонком кишечнике. Без этого фактора развивается анемия.
Общая кислотность желудочного сока измеряется с помощью титра. Выражается в титрационных единицах (ТЕ) и измеряется количеством 0,1M NaOH в мл, затраченных на титрование 100 мл желудочного сока в присутствии индикаторов фенолфталеина.
В норме кислотность желудочного сока составляет, ТЕ: общая 40-60, связанная 10-15, свободная 20-40Е.
Молочная кислота в норме в желудочном соке отсутствует. Наличие ее наблюдается при злокачественных опухолях желудка. Молочная кислота может появиться в желудочном соке как продукт жизнедеятельности грибков или опухолевых клеток.
Кроме соляной кислоты, ферментов, солей и слизи, в желудочном соке содержится также особое вещество — т. наз. внутренний фактор Касла. Это вещество необходимо для всасывания витамина В12 в тонких кишках, что обеспечивает нормальное созревание красных кровяных телец в костном мозге. При отсутствии фактора Касла в желудочном соке, что обычно связано с заболеванием желудка, а иногда с его оперативным удалением, развивается тяжелая форма малокровия. Анализ желудочного сока является очень важным методом исследования больных с заболеваниями желудка, кишечника, печени, желчного пузыря, крови и пр
Трансаминирование аминокислот, биологическое значение, субстраты, ферменты, роль витаминов в этом процессе.
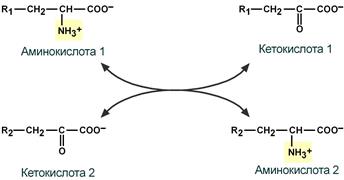
Трансаминирование — это реакция перекоса аминогруппы с аминокислоты (донора) на α-кетокислоту (акцептор), в результате чего образуется новая кетокислота и аминокислота.
Роль реакций трансаминирования в организме.
1. Синтез заменимых аминокислот.
2. Перераспределение аминного азота в тканях и органах.
2. α-кетокислоты окисляются в цикле трикарбоновых кислот.
4. Некоторые α-кетокислоты используются для синтеза глюкозы и кетоновых тел.
5. Трансаминирование происходит во многих тканях, в основном в печени.
Эта реакция заключается в том, что аминокислота и кетокислота обмениваются друг с другом своими функциональными группами при альфа-углеродном атоме. В результате вступившая в реакцию аминокислота превращается в соответствующую альфа-кетокислоту, а кетокислота становится аминокислотой. Эту реакцию катализируют ферменты под названием ТРАНСАМИНАЗЫ (АМИНОТРАНСФЕРАЗЫ). Коферментом всех трансаминаз является активная форма витамина В6 - пиридоксальфосфат (фосфопиридоксаль).

Значение АЛТ и АСТ в клинической диагностике.
Норма в крови 5-40 Ед/л.
При безжелтушных формах вирусных гепатитов: увеличение АЛТ в 6-8 раз, увеличение АСТ в 2-4 раза, при этом определяют соотношение АСТ/АЛТ – это коэффициент де Ритиса, в норме он равен 1,3.
При гепатитах, коэффициент уменьшается до 0,6, однако при циррозе печени он приближается к 1,0, вследствие развивающегося некроза тканей и выхода в кровь митохондриальной фракции АСТ
При инфаркте миокарда активность АСТ увеличивается в 8-10 раз, а АЛТ – 1,5-2 раза. Коэффициент де Ритиса значительно увеличивается.
БИОЛОГИЧЕСКАЯ РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ.
1. ОБЕСПЕЧИВАЮТ СИНТЕЗ НОВЫХ АМИНОКИСЛОТ ИЗ ЧИСЛА ЗАМЕНИМЫХ. Из заменимых аминокислот также могут образоваться необходимые клетке кетокислоты. Эта функция позволяет ругулировать содержание различных аминокислот в клетках организма (корректировка аминокислотного состава клеток).
2.ОБЕСПЕЧИВАЮТ ПРОТЕКАНИЕ РЕАКЦИЙ НЕПРЯМОГО ДЕЗАМИНИРОВАНИЯ.
3.ОБЕСПЕЧИВАЮТ СИНТЕЗ МОЧЕВИНЫ
Окислительное дезаминирование (прямое, непрямое) аминокислот. Схема процесса, стадии, ферменты, биологическое значение процесса.
Дезаминирование – это начало катаболизма аминокислот, удаление а-аминогруппы, которая выделяется в виде аммиака и образование безазотистого остатка (α-кетокислоты). При дезаминироваиии, в отличие от трансаминирования, общее количество аминокислот уменьшается.
Продукт дезаминирования — аммиак — токсическое соединение, в клетках подвергается обезвреживанию.
Дезаминированию не подвергаются лизин и пролин.
Типы дезаминирования
1. Окислительное — характерно для глютаминовой кислоты.
2. Неокислительное — характерно для серина, треонина и гистидина.
3. Непрямое для остальных аминокислот.
4. Непрямое неокислительное - цикл ИМФ-АМФ (инозитолмонофосфат и аденозинмонофосфат)
Окислительное дезаминирование происходит под действием фермента глутаматдегидрогеназы, коферментом, которого является NAD+- в митохондриях.
Неокислительное дезаминирование — вступают а) сирин и треонин — с отщеплением воды; б) гистидин — внутримолекулярным способом.
Непрямое дезаминирование – вступают все остальные аминокислоты и включают 2 стадии:
1) трансаминирование с α-кетоглутаратом и образование глютаминовой кислоты
2) окислительное дезаминирование глютаминовой кислоты в митохондриях.
В непрямом дезаминировании центральную роль играют глутамат и α-кетоглютарат.
Непрямое неокислительное дезаминирование происходит с участием цикла ИМФ-АМФ и характерно для мышечной ткани и мозга, в которых не работает глутаматдегидрогеназа.
Аминогруппа аминокислот с помощью двух последовальных реакций трансаминирования переносится на инозитолмонофосфат (ИМФ) с образованием аденозинмонофосфата (АМФ), который гидролитически дезаминируется с выделением аммиака.

Декарбоксилирование аминокислот. Биологическое значение. Продукты и их судьба.
Реакция декарбоксилирования АК и образование биогенных аминов гистамин, ацетилхолин, серотонин, дофамин, норадреналин, α- и γ аминомасляные кислоты.
Некоторые аминокислоты могут подвергаться декарбоксилированию – отщеплению карбоксильной группы. Продуктами реакции являются СО2и биогенные амины. Ферменты реакции — декарбоксилазы, кофермент пиридоксальфосфат: H2N-CHR-COOH → H2NCH2R + CO2
Декарбоксилирование аминокисот – образование биогенных аминов
Биогенные амины — это биологически активные вещества, выполняющие функцию нейромедиаторов (серотонин, дофамин, ацетилхолин, γ-аминомасляная кислота (ГАМК), регуляторных факторов местного действия (гистамин), гормонов – адреналин, норадреналин.
Тирозин — условно заменимая аминокислота, синтезируется из незаменимой аминокислоты фенилаланина.
В мозговом веществе надпочечников в нервной ткани из тирозина синтезируются катехоламины: гормон адреналин, медиаторы дофамин –(средний отдел головного мозга); норадреналин – тормозной медиатор синаптической нервной системы и головного мозга.
Тирозин под действием (монооксигеназы, тирозингидроксилазы) превращается в ДОФА. Функция ДОФА, как и всех катехоламинов – регуляция деятельности сердечно – сосудистой системы.
В щитовидной железе тирозин используется для синтеза гормонов йодтиронинов (тироксина и трийодтиронина).
Гистамин обеспечивает воспалительную реакцию, аллергическую реакцию, снижает артериальное давление, но повышает внутрисердечное, стимулирует секрецию желудочного сока.

Обмен фенилаланина и тирозина
Синтез нейромедиаторов
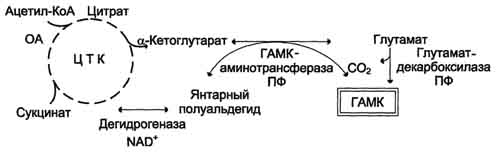
ГАМК. В нервных клетках декарбоксилирование глутамата приводит к образованию ɣ-аминомасляной кислоты (ГАМК) – основного тормозного медиатора.
Инактивация ГАМК проиходит путем трансамирования и превращения в сукцинат.
Ацетилхолин
Ацетилхолин образуется из серина нервной ткани.

Нарушение образования ацетилхолина в синапсах может вызвать миастению – мышечную слабость.
Механизмы токсичности аммиака, симптомы аммиачного отравления. Пути образования аммиака в организме.
Обмен аммиака, источники аммиака в организме
Источники аммиака: 1) катаболизм аминокислот; 2) распад биогенных аминов, нуклеотидов; 3) гниение белков в кишечнике под действием микрофлоры, откуда он частично всасывается в воротную вену. Концентрация аммиака в крови очень мала, так как он быстро всасывается в клетках с образованием нетоксичных продуктов. Содержание аммиака в норме составляет 0,4-0,7 мг/л.
Выведение аммиака. Выводится почками в виде конечных продуктов азотистого обмена: мочевины (синтезируется в печени) и аммонийные соли (образуются в почках).
Образование аммиака в почках
Аммиак в почках образуется главным образом из глутамина при действии глутаминазы и глутаматдегидрогена, образующийся при этом α-кетоглутарат используется как источник энергии.
В тканях аммиак находится в виде иона аммония в равновесии м неионизированным аммиаком: NH4+↔NH3+H+. Для иона аммония мембрана непроницаем
Основным диагностическим признаком служит повышение концентрации аммиака в крови. Диагностика производится путем определения: содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени.
Уровень аммиака может повышаться после белковой нагрузки.
Для снижения концентрации аммиака целесообразна малобелковая диета, а также использовать метаболическую коррекцию нарушений орнитинового цикла путём выведения аргинина, цитруллина , глутамата для выведения аммиака в обход нарушенных реакций, например, в составе фенилацетилглутамина и гиппуриновой кислоты.
Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глугамата:
α-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+.
Уменьшение концентрации α-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции транса-минирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность α-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоа-цетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызывает алкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии тканей, накоплению СО2 и гипоэнергетическому состоянию, от которого главным образом страдает головной мозг.
Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3Р04.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез у-аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
Ион NH4+ практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой (рис. 9-11). Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается.
В почках образуется и выводится около 0,5 г солей аммония в сутки.
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин - основной донор азота в организме. Амидный азот глутамина
Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы.
Существуют 2 изоформы этого фермента - глутаминзависимая и аммиакзависимая, которые используют разные доноры амидных групп. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэргических связей), чем синтез глутамина.
Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины. В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфос-фатсинтетазы I. Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе гшримидиновых нуклеотидов (см. раздел 10). Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.
+В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Эти симптомы связаны с действием аммиака на центральную нервную систему и прежде всего на головной мозг Механизмы токсического действия аммиака:
1) аммиак вызывает снижение содержания α-кетоглутарата, т.к. сдвигает реакцию, катализирующуюся глутаматдегидрогеназой (ГЛЮ-ДГ) в сторону образования глутамата. Этот процесс сопровождается угнетением ЦТК и реакций трансаминирования;
2) высокие концентрации аммиака вызывают синтез глутамина из глутамата в нервной ткани:
Снижение концентрации глутамата подавляет обмен аминокислот и синтез нейромедиаторов (ГАМК) – основного тормозного медиатора
При этом нарушается проведение нервного импульса, наблюдаются судороги. Накопление глутамина в нервных клетках повышает осмотическое давление, и может вызвать отек мозга.
В крови и цитозоле аммиак превращается в ион NH4+, накопление которого нарушает трансмембранный перенос одновалентных катионов Na+ и K+, что также влияет на проведение нервных импульсов.
Известно пять наследственных заболеваний, обусловленных дефектом ферментов орнитинового цикла. Нарушения этого цикла наблюдается при вирусных заболеваниях, так например, вирус гриппа подавляет синтез карбамоилфосфатсинтетазы-1.
Нарушения орнитинового цикла приводят к значительному повышению в крови концентрации: аммиака, глутамина, аланина.
Основным диагностическим признаком служит повышение концентрации аммиака в крови. Диагностика производится путем определения: содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени.
Уровень аммиака может повышаться после белковой нагрузки.
Для снижения концентрации аммиака целесообразна малобелковая диета, а также использовать метаболическую коррекцию нарушений орнитинового цикла путём выведения аргинина, цитруллина , глутамата для выведения аммиака в обход нарушенных реакций, например, в составе фенилацетилглутамина и гиппуриновой кислоты.
Гипераммониемия сопровождается следующими симптомами:
-тошнота, рвота
-головокружение, судороги
-потеря сознания, отек мозга
Пути обезвреживания аммиака. Механизмы транспорта ам- миака в организме: глутаминовый и глюкозо-аланиновый циклы.
Основной реакцией обезвреживания аммиака во всех тканях является синтез глутамина под действием глутаминсинтетазы.
Глутамин является транспортной формой аммиака и азота – нейтральной аминокислотой, способной к облегченной диффузии. Амидная группа глутамина используется для синтеза аспаргина, глюкозоамина, таким образом азот аммиака включается в структурно-функциональные компоненты клетки.
В кишечнике и мышцах глутамин под действием глутаминазы расщепляется на аммиак и глутамат, котороый с помощью аланинаминотрасферазы превращается в алаланин, который также является транспортной формой аммиака и азота.
В нервной системе
Обезвреживание аммиака происходит путем синтеза аспарагина и глутамина, который легко проходит через гематоэнцефалический барьер и с кровью доставляется с почки.
Обезвреживание аммиака мышцах, печени
Глутамин с помощью глутаминазы дезаминируется с образованием NH3 и глутамата. Образовавшийся глутамат с помощью аланинминотрансферазы (АЛАТ) превращается в аланин

Обезвреживание аммиака в печени
Из NH3+CO2 образуется карбамоилфосфат, который включается в орнитиновый цикл Гензелейта (синтез мочевины)
Транспортными формами аммиака из тканей в печень являются глутамин и аланин, в меньшей степени аспарагин и глутамат, некоторое количество аммиака находится в крови в свободном виде. Глутамин и аланин являются наиболее представленными, их доля среди всех аминокислот крови составляет до 50%. Большая часть глутамина поступает от мышц и нервной ткани, аланин переносит аминный азот от мышц и стенки кишечника.

