
Белозеров В.И. Учебное пособие по курсу Техническая термодинамика (исправлено)
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ОБНИНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ АТОМНОЙ ЭНЕРГЕТИКИ
Физико-энергетический факультет
В.И. Белозеров
ТЕХНИЧЕСКАЯ
ТЕРМОДИНАМИКА
Учебное пособие для студентов теплоэнергетических
специальностей
Обнинск 2006
ÓÄÊ 621.1.016
Белозеров В.И. Техническая термодинамика: Учебное пособие для студентов теплоэнергетических специальностей. – Обнинск, 2006. –
260ñ.
Âучебном пособии рассмотрены I и II законы термодинамики и вытекающие из них положения, являющиеся основой для анализа рабочих циклов тепловых двигателей и холодильных установок. Пособием могут пользоваться студенты неэнергетических специальностей, аспиранты и инженеры, повышающие свою квалификацию.
Автор выражает признательность А.В. Шувалову, А.А. Карпенко, С.А.Гаврилину за помощь в подготовке рукописи, а И.А. Чусову – за заме- чания в изложении материала.
Èëë. 142, òàáë. 7, áèáë. 7 íàçâ.
Рецензенты: |
д.т.н., профессор А.В. Жуков |
|
к.т.н., доцент Г.К. Игнатенко |
В.И. Белозеров, 2006 г.
Обнинский государственный технический университет атомной энергетики, 2006 г.
ВВЕДЕНИЕ
Интенсивное развитие энергетики России, связано, в первую очередь, с освоением новых типов схем и элементов оборудования, внедрением в практику новых методик расчета и конструирования – все это предъявляет повышенные требования к знанию фундаментальных дисциплин, среди которых особое место занимает термодинамика.
Основы термодинамики как науки были заложены во второй половине XVIII в., когда Стирлинг запатентовал «машину, которая производит силу посредством нагретого воздуха», а Джеймс Уатт создал первый тепловой двигатель – поршневую паровую машину.
Âнаиболее общем смысле термодинамика – наука о закономерностях превращения энергии. Слово термодинамика образовано из двух слов гре- ческого языка therme – тепло и dynamic – сила (в русском переводе слово «термодинамика» интерпретируется следующим образом: сила как средство совершения работы). Почти две тысячи лет назад Герон Александрийский выполнил опыт, в котором сферический сосуд вращался вокруг своей оси под действием пара, но ответить на вопрос, каким образом пар порождает движение, он не смог.
Â1776 г. Адам Смит опубликовал свой труд «Исследование о природе и причинах богатства народов», в котором он подчеркнул, что уголь служит источником тепла для рабочих, но он не увидел в угле скрытый источник богатства народов. В 1824 г. выдающийся французкий ученый Садди Карно опубликовал фундаментальную работу «Размышления о движущей силе огня и о машинах, способных развивать эту силу», в которой были сформулированы идеи, заложившие основу термодинамики, и физически обосновано второе начало термодинамики.
Âоснове термодинамики лежат два закона, или начала: одно из начал относится к понятию «энергия», а другое – к понятию «энтропия».Каждая система обладает энергией и энтропией. Когда вещество переходит из одного состояния в другое, полная энергия остается неизменной, т.е. сохраняется, а полная энтропия может только возрастать или в идеализированных слу- чаях оставаться неизменной.
Кроме фундаментальных законов термодинамики в настоящем пособии рассмотрены основные термодинамические процессы истечения газов и паров. Достаточно подробно изложены процессы сжатия в компрессорах, циклы двигателей внутреннего сгорания, газотурбинных и паротурбинных установок, циклы холодильных машин. Поскольку пособие, в первую очередь, ориентировано на студентов, изучающих ядерные паропроизводящие установки, в него включены основные сведения о циклах ядерных энергетических установок, в том числе установки с жидкометаллическим теплоносителем и установки с закритическими параметрами.
3
1. Основные понятия и определения.
Термодинамическая система, окружающая среда,
рабочее тело
Термодинамика – это наука о свойствах энергии в различных ее видах, а также о закономерностях перехода энергии от одних тел к другим и из одного вида в другой. Основой этой науки являются два закона природы – первый и второй законы термодинамики. Используя только эти законы, можно путем математического анализа различных энергетических процессов получить характеристику как самих процессов, так и отдельных теплофизических свойств участвующих в них веществ, не касаясь их микроструктуры.
В процессе развития термодинамика вышла за пределы теории тепловых двигателей, и ее законы в обобщенном виде нашли применение во многих других областях науки и техники. В результате был создан
термодинамический метод исследования любых макроскопических процессов, в которых так или иначе проявляются свойства энергии.
В чистом виде этот метод является строго феноменологическим, т.е. он базируется на эмпирических данных, устанавливает связи только между макроскопическими характеристиками процессов и оставляет в стороне молекулярно-кинетическое представление о строении вещества. Можно привести много примеров того, как термодинамический метод исследования сочетается с молекулярной и статистической физикой.
С развитием общей термодинамики как науки чисто феноменологи- ческой всегда существовала и развивалась прикладная наука, которая в отечественной литературе получила название технической термодинамики, и в ней термодинамический метод синтезируется с теорети- ческими и экспериментальными достижениями молекулярной физики и других наук, а на основе этого синтеза изучаются вопросы технического характера.
Техническая термодинамика вместе с теорией тепло- и массообмена является теоретической базой всей современной теплотехники, и этим предопределяется ее содержание.
Термодинамика изучает различные термодинамические системы.
Термодинамической системой (или просто системой) называется произвольная система физических тел, находящихся в механическом и тепловом взаимодействии друг с другом и с окружающими их физическими телами, или иначе, с внешней средой.
4
Изолированной или замкнутой системой является система, не взаимодействующая с окружающей средой, т.е. когда невозможно как тепловое, так и механическое взаимодействие ее с окружающей средой.
Преобразование теплоты в работу осуществляется с помощью рабочего тела и сопровождается изменением его состояния. Рабочим телом называется вещество, способное воспринимать теплоту и совершать работу. Изменение состояния рабочего тела происходит вследствие взаимодействия его с окружающей средой. Это взаимодействие может заключаться
•в подводе теплоты к рабочему телу от какого-либо другого тела (теплоотдатчика) или в отводе теплоты от рабочего тела к другому телу (теплоприемнику);
•в преодолении рабочим телом внешних сил и совершении им работы расширения (или сжатия рабочего тела внешними силами с затратой работы извне).
2.Термические (основные) и калорические
параметры состояния системы и их единицы
измерения
В зависимости от внешних условий один и тот же газ может находиться в различных состояниях. Каждое из таких состояний может быть охарактеризовано конкретными значениями ряда макроскопических (т.е. относящихся ко всему газу в целом) величин, называемых термодинамическими параметрами. Это означает, что каждому состоянию газа соответствует одно и только одно значение каждого из термодинамических параметров.
Чтобы однозначно охарактеризовать состояние вещества, нет необходимости задавать значения всех параметров. Вполне достаточно для этого трех (любых), поэтому в технической термодинамике в качестве основных используются те три параметра, которые имеют конкретный физический смысл и могут быть непосредственно измерены техническими средствами – удельный объем, давление и температура. Совокупность этих параметров характеризует тепловое состояние тела, поэтому их называют термическими параметрами.
Удельным объемом газа, обозначаемым буквой v, называется объем, занимаемый 1 кг данного газа. Так, если масса всего вещества
М кг, а полный объем V м3, то удельный объем его составляет
5
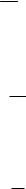
vV , ì3/êã.
M
Величина, обратная удельному объему, т.е. масса вещества, заклю- ченная в единице объема, называется плотностью и обозначается Υ:
ΥM , êã/ì3.
V
Давление представляет собой силу, действующую по нормали к поверхности тела и отнесенную к единице площади этой поверхности:
PF . S
Единицей давления служит паскаль (Па) – давление, вызываемое силой 1 Н, равномерно распределенной по поверхности площадью 1 м2.
Для измерения давления применяются различные единицы: паскаль (Па), бар, техническая атмосфера (1 кгс/см2), физическая атмосфера, миллиметр водяного или ртутного столба. Соотношения между единицами давления следующие:
1 |
êÍ |
103 |
Í |
и в барах 1áàð |
105 |
Í |
102 |
êÍ |
; |
|
|
|
|
||||||
2 |
2 |
|
2 |
2 |
|
||||
ì |
ì |
|
ì |
ì |
|
||||
1 áàð = 750 ìì ðò. ñò. = 0,1 ÌÏà = 1,02 àò = 1,02 104 ìì âîä. ñò. =
=0,987 àòì. ôèç.;
âтехнической системе единиц
1 |
êãñ |
9,81 |
Í |
, 1àòà |
1 |
êãñ |
104 |
êãñ |
0,981 áàð; |
|
|
|
|
||||||
2 |
2 |
|
2 |
2 |
|
||||
ì |
ì |
|
ñì |
ì |
|
||||
1 ôèç.àòì.=760 ìì ðò.ñò.=1,033 òåõí.àòì.=1,013 áàð .
Измерение давления производится путем уравновешивания его ка- кой-то силой (рис. 1). Так, например, в ртутном барометре на площадку f сверху давит вес столба ртути fghΥ, где f – площадь. Снизу на эту же площадку действует сила P f, где Р – барометрическое давление, тогда
ÁÁ
P Υgh, Í/ì2.
Á
6
h |
Ð |
|
h |
||
|
f
Ðèñ. 2
Ðèñ. 1
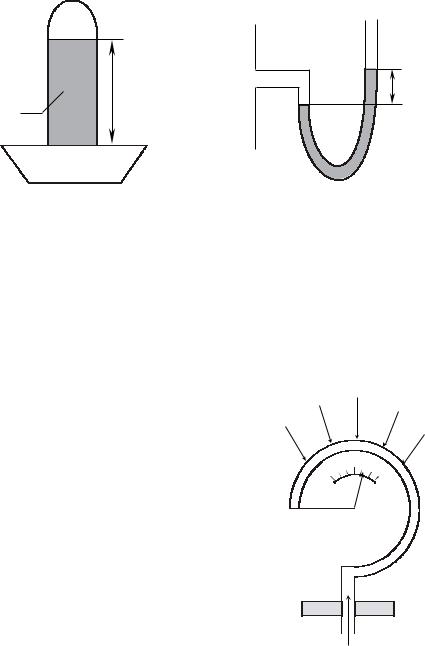
По этому же принципу можно также измерять избыточное давление с помощью открытого (U-образного) манометра (рис. 2). Аналогичные предыдущему рассуждения дают
P P |
Υgh èëè P Υgh P . |
Á |
Á |
Если в резервуаре давление ниже барометрического (вакуум), то
P P Υgh, Í/ì2.
Á
При измерении малых давлений и разреже- |
|
ний применяются водяные манометры. Плот- |
|
ность воды при нормальных условияхΥ= |
|
= 103 êã/ì3, поэтому 1 мм вод. ст. | |
|
| 9,80665 Í/ì2. |
|
Схема манометра, в котором сила давле- |
|
ния уравновешена упругостью твердого тела, |
|
äàíà íà ðèñ. 3. |
|
Закрытая с одного конца изогнутая трубка |
|
с закрепленным открытым концом присоеди- |
|
няется к резервуару, в котором замеряется дав- |
|
ление. При повышении давления в резервуаре |
|
трубка стремится разогнуться. Ее свободный |
|
закрытый конец перемещается, передвигая |
|
стрелку по шкале. Этот манометр также за- |
|
меряет избыточное давление или разряжение. |
Ð |
|
|
Параметром состояния всегда является абсо- |
Ðèñ. 3 |
|
Ð
Á
7

лютное давление, а не избыточное или разряжение.
С физической стороны давление объясняется тем, что молекулы газа или жидкости, находясь в движении, ударяются о стенки. При ударе молекулы изменяется количество ее движения, что вызывает соответственный импульс силы. Величина давления связана с количеством молекул, ударяющихся в единицу времени об единицу площади, и скоростьюпоступательногодвижениямолекул.Дляидеальногогаза,когдамежду молекулами нет взаимодействия, величина давления
2 |
§ mC2 |
mC2 |
· |
|
|||
P |
|
¨ |
1 |
... |
n |
¸, |
(2.1) |
|
|
|
|||||
3 |
© |
2 |
|
2 |
¹ |
|
|
где m – масса молекулы газа; C – скорость поступательного движения
i
i-ой молекулы; n – число молекул в единице объема.
Абсолютная температура вещества, обозначаемая Т, является мерой интенсивности хаотического движения его молекул и измеряется в градусах.
Средняя величина кинетической энергии поступательного движения молекул
|
|
|
|
|
|
mC2 |
|
mC2 |
|
|
MC2 |
... |
|
|
|||||||
|
|
|
|
|
|
1 |
n |
, |
(2.2) |
|
2 |
|
2 |
2 |
|||||||
|
|
|
||||||||
|
|
|
|
|||||||
где n – число молекул в единице объема.
MC2
Температура газа пропорциональна |
2 |
. Удобно принять |
||||||||
2 |
|
|
|
|
|
|
|
|
||
|
|
MC2 |
|
|||||||
|
|
|
|
|
|
|
|
kT, |
(2.3) |
|
3 |
2 |
|
||||||||
|
|
|
|
|||||||
ãäå k = 1.38 10-23 Дж/град – постоянная Больцмана; Т – абсолютная температура.
Учитывая два предыдущих соотношения, получим
P nkT. |
(2.4) |
Выражение (2.3) показывает, что абсолютная температура всегда положительна, а нулевое значение ее соответствует состоянию полного покоя молекул. Шкала, в которой температура отсчитывается от этого состояния,называетсяшкалой Кельвина.Измереннаяпоэтойшкалетемпература обозначается Т К.
8

Принцип построения абсолютной (термодинамической) шкалы впервые предложил в 1848 г. английский физик У. Томсон (Кельвин).
В технике же принята международная стоградусная шкала (шкала Цельсия), в которой отсчет ведется от состояния тающего льда при физической атмосфере (соответствующего абсолютной температуре
Т = 273,15 К). Измеренная по этой шкале температура обозначается че- рез t°С. Величина градуса в обеих шкалах одинакова, поэтому пересчет с одной шкалы в другую производится по формуле
T Ê = tîÑ + 273,15 | tîÑ + 273.
Значение каждого из термических параметров определяется одними и теми же факторами, а именно, скоростью движения молекул и средним расстоянием между ними, которые для каждого конкретного состояния вещества имеют вполне определенную величину, поэтому они связаны зависимостью
f (P, V, T) = 0, |
(2.5) |
которая называется термическим уравнением состояния.
Для идеальных газов уравнение состояния может быть получено теоретически из уравнения (2.4):
Pnm kT, m
где m – масса молекулы; nm – масса кубического метра газа, т.е. плотность;
|
nm |
Υ |
1 |
èëè Pv |
k |
T. |
||
v |
||||||||
|
|
|
|
|
m |
|||
Назовем значение |
k |
R газовой постоянной, тогда |
||||||
|
|
|||||||
|
|
|||||||
m
(2.6) Выражение (2.6) представляет собой термическое уравнение состо-
яния идеального газа.
Кроме основных (термических) параметров состояния большое зна- чение имеют калорические параметры состояния. Примером калорического параметра состояния является внутренняя энергия рабочего тела U. Обычно для экспериментального определения калорического параметра приходится учитывать количество тепла, т.е. проводить опыт
9

в калориметре. Уравнение состояния, в которое входит внутренняя энергия (или какой-либо другой калорический параметр),
U f P,V
(2.7)
называется калорическим уравнением состояния.
3. Общие свойства параметров состояния
Если из уравнения состояния простого химически однородного тела вычислить удельный объем, то получится
v Μ P,T . |
(3.1) |
Пусть из начального состояния 1, в котором Р = Р и Т = Т , рабочее
1 1
тело, совершая какой-то процесс, перешло в состояние 2, где Р = Р и
2
Ò = Ò .
2
Из уравнения состояния можно считать
v2 v1 Μ(P2 ,T2 ) Μ(P1,T1).
Но переход из состояния 1 в 2 возможно осуществить по-разному. В процессах I-I сначала меняется давление рабочего тела, а его температура остается постоянной, а затем меняется температура рабочего тела. В процессах II-II, сначала меняется температура, а потом давление. Но в обоих случаях изменение объема рабочего тела будет одинаково. Аналогичные рассуждения применимы к любому параметру состояния, следовательно, изменение параметра состояния определяется изменением его состояния и не зависит от характера процесса.
С математических позиций это означает, что дифференциал параметра состояния является полным дифференциалом. Но этим же свойством обладает, очевидно, любая однозначная функция от параметров состояния
|
P , T |
|
I |
P , T |
|
2 |
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
||||
|
2 |
|
1 |
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|||
|
I |
|
|
|
|
|
|||
|
|
|
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1 |
P , T |
|
|
|
P , T |
|
|
||
|
|
|
|
|
|||||
1 |
|
1 |
|
|
1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
Ðèñ. 4
10
