
Белозеров В.И. Учебное пособие по курсу Техническая термодинамика (исправлено)
.pdfX f P,T . |
(3.2) |
Поскольку dx – полный дифференциал, то его изменение определяется изменением состояния тела, независимо от характера процесса между начальным и конечным состояниями. Это позволяет рассматривать величину Х как новый параметр состояния, т.е. вводить при необходимости новые параметры состояния. Этот прием широко используется при рассмотрении ряда вопросов.
С другой стороны, если x, y, z – параметры состояния, то они связаны между собой уравнением состояния
|
|
|
|
|
|
|
|
z f x, y , |
|
§ w |
z |
· |
§ |
z · |
|
||
откуда dz |
|
dx ¨ |
w |
dy. |
||||
¨ |
|
|
¸ |
|
¸ |
|||
|
|
|
||||||
|
© wx ¹y |
© wy ¹x |
|
|||||
Если параметр состояния dz не изменяется, то dz = 0:
§ wz · |
§ wz · |
|
||||
¨ |
|
¸ |
dx ¨ |
|
¸ |
dy 0 . |
|
|
|||||
© wx ¹y |
© wy ¹x |
|
||||
Несложные преобразования дают
§ wy · |
§ wz · |
§ wx · |
1. |
||||||
¨ |
|
¸ |
¨ |
|
¸ |
¨ |
|
¸ |
|
|
|
|
|||||||
© wz ¹x © wx ¹y © wy ¹z |
|
||||||||
(3.3)
(3.4)
Это равенство используется при установлении законов изменения параметров состояния.
4.Процесс. Цикл
Âрезультате воздействия на рабочее тело (газ, пар) внешней среды (сжатие, расширение, теплообмен) происходит процесс изменения его состояния.
Последовательность изменения термодинамического состояния си-
стемы носит название термодинамического процесса.
Все процессы, происходящие в термодинамической системе, можно разделить на равновесные и неравновесные. Равновесными называются процессы, представляющие собой непрерывную последователь-
11
ность равновесных состояний системы (например, все части системы имеют одинаковую температуру и одинаковое давление). Неравновесным называется процесс, при протекании которого система не находится в состоянии равновесия (например, различные температуры, давления, плотности, концентрации и т.д.).
Линия, изображающая изменение параметров в процессе, называется кривой процесса, каждая точка которой характеризует равновесное состояние системы. Графически могут быть изображены лишь процессы, представляющие собой непрерывную последовательность равновесных состояний системы, т.е. равновесные процессы.
Замкнутый процесс, в результате которого рабочее тело возвращается в начальное работоспособное состояние, называется циклом. Замкнутые термодинамические процессы имеют очень большое практи- ческое значение, т.к. они позволяют непрерывно использовать теплоту для совершения работы, а также передавать теплоту с низшего температурного уровня на высший.
Эффективность превращения теплоты в работу в цикле характери-
зуется термическим к.п.д. цикла Κ , который представляет собой отно-
t
шение работы цикла l к подведенному к системе количеству теплоты q :
ö |
1 |
Κ |
lö |
1 |
q2 |
. |
|
|
|||
t |
q |
|
q |
|
|
|
|||
|
1 |
1 |
|
|
12
Глава 1
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
1.1. Равновесные и неравновесные процессы
Любой процесс совершается под механическим (при расширении или сжатии рабочего тела) или термическим (при нагревании или охлаждении рабочего тела) воздействием на тело со стороны внешней среды, состояние которой при этом также меняется.
Чем медленнее изменяется состояние внешней среды, тем медленнее совершается процесс, тем больше успевают выравниваться температура и давление среды и рабочего тела, тем ближе находятся они к состоянию равновесия в каждый момент времени. При бесконечно малой скорости протекания такой процесс будет равновесным, т.к. внешняя среда и рабочее тело будут медленно переходить из одного состояния равновесия в другое. Таким образом, весь процесс можно представить как последовательный ряд равновесных состояний.
Действительные (реальные) процессы неравновесны, потому что протекают они с конечной скоростью, при значительной разности температур и давлений между внешней средой и рабочим телом.
После протекания равновесного процесса в одном направлении его можно провести в обратном направлении через ту же последовательность равновесных состояний. При этом, в результате протекания прямого и обратного равновесных процессов никаких изменений в окружающих телах не произойдет, а рабочее тело возвратится в первоначальное состояние, поэтому равновесный процесс называется также обратимым.
Все реальные процессы необратимы. Примерами необратимых процессов являются процессы горения топлива, передача тепла от горячих тел к менее нагретым, дросселирование жидкости или газа и т.д.
В термодинамике изучаются, главным образом, обратимые процессы. Изучение необратимых процессов, протекающих в тепловых двигателях, является весьма сложным. Кроме того, изучение обратимых процессов дает возможность наметить более выгодные условия для осуществления действительных процессов в тепловых двигателях. Перенесение результатов изучения обратимых процессов
13
на необратимые осуществляется с помощью опытных коэффициентов, учитывающих влияние факторов, отличающих обратимые процессы от необратимых.
1.2. Внутренняя энергия и энтальпия рабочего тела
как функции состояния
Внутренняя энергия (U) тела складывается из энергий поступательного и вращательного движений молекул, составляющих тело, энергии внутримолекулярных колебаний, потенциальной энергии сил сцепления между молекулами, внутримолекулярной энергии, внутриатомной (энергия электронных оболочек атомов) и внутриядерной энергии.
Внутренняя энергия U является экстенсивным свойством газа, т.е. зависит от его массы (в противоположность свойствам, не зависящим от массы и называемым интенсивными). Поэтому для большей определенности внутреннюю энергию газа (вещества) обычно относят к единице массы (1 кг). Такая удельная энергия обознача- ется буквой u. Таким образом, если масса рассматриваемого вещества равна М кг, то
|
|
|
U |
, |
Äæ . |
|
|
|
u |
|
|
|
|
|
M |
|
êã |
Из самого определения внутренней энергии вытекает, что каж- |
|||||
дому состоянию вещества соответствует одно значение внутренней |
|||||
энергии. Это означает, что внутренняя энергия представляет собой |
|||||
|
|
|
однозначную функцию любых двух неза- |
||
P |
|
|
висимых параметров, определяющих |
||
|
|
|
это состояние. Поэтому изменение внут- |
||
1 |
|
|
ренней энергии в каком-либо процессе не |
||
a |
|
|
|||
|
|
|
зависит от характера процесса, а одно- |
||
|
|
|
значно определяется заданными началь- |
||
b |
|
|
ным и конечным состояниями вещества. |
||
|
|
|
|||
|
|
|
Так, в процессах а, b и c (рис. 1.2.1), |
||
c |
|
|
в которых начальные и конечные состо- |
||
|
2 |
v |
|
|
|
|
|
яния вещества одинаковы, одинаковыми |
|||
|
|
|
|||
|
|
|
будут и изменения значения внутренней |
||
Ðèñ. 1.2.1 |
|
|
энергии U = f (P, V): |
||
|
|
|
|||
14

'Ua 'Ub 'Uc U2 U1
U2
³dU f P2 ,V2 f P1,V1 .
U1
Математически это означает, что дифференциал dU является пол-
ным дифференциалом функции f (P, V) и может быть представлен
равенством
§ wU · dU ¨ ¸ © wP ¹V
§ wU · |
|
'u u2 u1 |
cv t2 t1 , |
Äæ |
|
||
dP ¨ |
|
¸ |
dV ; |
|
. |
||
|
|
||||||
© wV ¹P |
|
|
|
êã |
|
||
Очевидно, что если процесс замкнут, т.е. если по завершении его вещество возвращается в исходное состояние (такие процессы называются циклами), то изменение внутренней энергии в нем будет равно нулю:
'U ѳdU 0 .
Аналогичными свойствами обладают все рассмотренные выше параметры (P, v, T), следовательно, и внутренняя энергия может служить параметром состояния вещества.
Наряду с внутренней энергией важную роль играет величина h =
= u + Pv, Дж/кг, называемая энтальпией вещества. Будучи составленной из функций состояния, энтальпия сама является функцией состояния и играет роль одного из калорических параметров состояния, например, если задана зависимость h = f (P, V), то
§ wh · dh ¨ ¸ © wP ¹T
§ wh ·
dP ¨ ¸ dT , 'h h2 h1 cP (t2 t1 ) ,
© wT ¹P
т.е. дифференциал энтальпии является полным дифференциалом.
Таким образом, для цикла |
'h |
ѳdh 0 |
, а для незамкнутых про- |
|
|
цессов 'h = h – h = (u +P v ) – (u +P v ), независимо от пути, по которому протекает процесс. Физический смысл этой функции обнаруживается при анализе конкретных явлений.
Поскольку h и u взаимосвязаны, то в точке, принятой за начало отсчета, u = 0, h = Pv, например, для воды t = 0,01îÑ, Ð = 610,8 Ïà, v = 0,0010002 ì3/êã, h = Pv = 0,611 Äæ/êã.
15

1.3. Работа изменения объема рабочего тела
Всякое изменение объема вещества сопровождается совершением работы. При расширении вещество совершает работу против внешних сил, при сжатии внешние силы совершают работу над веществом.
Положим, что 1 кг газа, расширяясь в цилиндре двигателя, перемещает поршень из положения А в положение В, причем процесс изменения состояния газа на Pv–диаграмме изображается линией 1–2 (рис. 1.3.1).
На элементарном отрезке пути поршня a–b, равном dS, изменением давления можно пренебречь, поэтому элементарная работа газа на этом участке составляет dl= PFdS, где F – площадь поршня и, следовательно, PF – сила, действующая на поршень. С другой стороны, FdS = dv, следовательно,
dl Pdv, |
Äæ |
|
|
. |
|||
|
|||
|
êã |
|
|
Очевидно, что суммарная работа, совершаемая газом в процессе 1–2, составляет
A |
a |
b |
B |
P
|
dS |
1 |
|
dl |
2 |
|
|
P |
|
4 |
3 |
|
|
dv |
v |
Ðèñ. 1.3.1 |
|
v2 |
|
|
l ³Pdv, |
Äæ |
|
êã |
. |
|
v1 |
|
|
При расширении газа dv>0 и l>0, т.е. работа расширения газа есть величина положительная; при сжатии dv<0 и l<0, т.е. работа сжатия газа есть величина отрицательная.
Из Pv–диаграммы видно, что элементарная работа dl графи- чески изображается площадью прямоугольника с основанием dv
и высотой P (заштрихованная на графике), следовательно, полная работа изменения объема в процессе 1–2 изображается площадью 1–2–3–4.
16

Графическая интерпретация работы |
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
на Pv–диаграмме наглядно показывает, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
что ее величина зависит от того, каким |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
путем газ переходит из начального со- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
стояния в конечное. Поэтому можно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сказать, что работа является функци- |
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ей процесса и при одинаковых началь- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ных и конечных состояниях газа может |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
быть различной в зависимости от того, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
по какому пути совершается этот процесс. Отсюда же вытекает, что работа l не является функцией состояния, а ее
дифференциал dl не является полным дифференциалом.
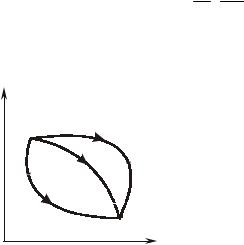
Работа газа за цикл в целом будет положительной (рис. 1.3.2), если линия расширения расположена выше линии сжатия (т.е. линия цикла направлена по часовой стрелке), ибо в этом случае положительная работа расширения по абсолютной величине больше отрицательной работы сжатия, и, наоборот, работа отрицательна, если линия расширения расположения ниже линии сжатия (т.е. линия цикла направлена против часовой стрелки). В первом случае цикл называется прямым, а во втором – обратным, причем в обоих случаях работа газа за цикл измеряется площадью, ограниченной линией цикла.
1.4. Первый закон термодинамики
По исторически сложившимся традициям первый закон термодинамики часто трактуют как приложение всеобщего закона сохранения и превращения энергии к тепломеханическим процессам. Фактически же никакого различия между этими двумя законами нет, ибо первый закон термодинамики применяется не только при анализе тепломеханических процессов, но и в других случаях, например, в термохимии, поэтому наиболее полно его сформулировать можно так:
энергия изолированной термодинамической системы остается неизменной, независимо от того, какие процессы в ней протекают.
Для тепломеханических процессов это означает, что если в тепловом двигателе совершается прямой цикл, то сообщенное в этом
17
цикле рабочему телу тепло q0 ѳdq должно быть в точности рав-
но совершаемой им работе l ѳdl. Если бы оказалось, что q <l ,
0 0 0
то можно было бы создать так называемый вечный двигатель первого рода, т.е. двигатель, совершающий работу без затраты внеш-
ней энергии. Равным образом, если q >l , то имело бы место бес-
0 0
следное исчезновение энергии. Оба предположения противоречат первому закону термодинамики, а из этого следует, что в данном случае q = l .
00
Ñпомощью аналогичного рассуждения можно показать, что в об-
ратном цикле затраченная работа в точности равна полученному за
ååсчет теплу.
Рассмотрим теперь произвольный незамкнутый процесс 1–2. В
общем случае для этого процесса u = u – u ζ 0, поэтому уравне-
2 1
ние баланса энергии, выражающее неизменность общего запаса ее в термодинамически изолированной системе (состоящей в данном случае из источника тепла, рабочего тела и объекта работы), принимает вид
q12 u l12 . |
(1.4.1) |
В правую часть этого равенства, называемого аналитическим выражением первого закона термодинамики, входят алгебраические величины: если внутренняя энергия увеличивается, то u > 0, в противном случае u < 0. Равным образом, если работа совершается рабочим телом, то l > 0, если она совершается над рабочим телом, то l < 0, поэтому и тепло q, находящееся в левой части равенства, является алгебраической величиной: если оно подводится к рабочему телу, то q > 0, в противном случае q < 0.
В развернутой форме аналитическое выражение первого закона термодинамики для процесса 1–2 принимает вид
v2 |
|
q u2 u1 ³Pdv, |
(1.4.2) |
v1 |
|
а в дифференциальной форме, соответствующей элементарному участку процесса,
dq du Pdv |
(1.4.3) |
èëè
18

dq du dl. |
(1.4.4) |
В это выражение для внутренней энергии u может быть введена энтальпия h. Поскольку d(Pv) = Pdv + vdP, то
Pdv |
d(Pv) vdP |
|
||
и тогда |
|
|
|
|
dq du d(Pv) vdP |
d(u Pv) vdP |
|
||
èëè |
|
|
|
|
dq |
dh vdP, |
(1.4.5) |
||
а в конечном виде |
|
|
|
|
q |
h2 |
h1 |
P2 |
|
³vdP. |
(1.4.6) |
|||
|
|
|
P1 |
|
P2
Интеграл ³vdP, как и энтальпия, представляет собой в общем
P1
случае чисто математическую величину и приобретает конкретное физическое содержание лишь при рассмотрении процессов, протекающих в потоке рабочего тела.
1.5. Уравнение первого закона термодинамики для
потока
Первый закон термодинамики имеет общий характер и справедлив для любых систем – и неподвижных, и движущихся.
Рассмотрим течение жидкости или газа в канале произвольной формы.
Для движущегося потока следует учитывать кинетическую энергию потока
E Gw2 ,
êèí 2
где G – масса некоторого фиксированного количества вещества в потоке, а w – скорость потока. Поскольку скорость потока меняется между сечениями 1 и 2 по длине канала (рис. 1.5.1), то и кинетическая энергия потока изменяется на величину
19

1
2
P
1
S 
 P S
P S
1 |
|
2, |
2 |
z |
Q |
z |
|
1 |
|
2 |
|
Ðèñ. 1.5.1
'Eêèí |
§ w2 |
w2 |
· |
|
|||
G¨ |
2 |
|
1 |
¸ . |
(1.5.1) |
||
2 |
2 |
||||||
|
© |
|
¹ |
|
|||
Рассмотрим уравнение первого закона термодинамики |
|
||||||
Q12 |
U2 U1 L12 . |
|
|||||
Выясним, какие виды работ производит движущийся поток газа
(жидкости).
Между сечениями 1 и 2 может быть подведено некоторое коли-
чество тепла Q .
1-2
Площадь сечения и давление в сечении 1 обозначим через S и
1
P , в сечении 2 – S и P . Количество вещества, проходящего через
1 2 2
поперечное сечение потока в единицу времени (массовый расход), обозначим через G. В соответствии с уравнением неразрывности стационарного потока G одинаково для любого сечения канала (G = = const).
Обозначим через x длину пути, проходимого за единицу времени
1
через сечение S рассматриваемой порции газа (жидкости). Чтобы
1
переместить эту порцию на расстояние x , нужно совершить работу,
1
равную произведению силы (эта сила равна произведению давления на площадь сечения S ) на x :
11
L1 P1S1x1,
S1 x1 V1.
Очевидно, что
V1 v1G.
Таким образом,
20
