
- •Аминокислоталар, пептидлар, оқсиллар
- •Оқсилларнинг аминокислота таркибини аниқлаш
- •Оқсилларнинг тузилиши
- •Оқсил ва пептидларнинг кимёвий синтези
- •Оқсиллар ва пептидларнинг кимёвий модификацияси
- •40000 Марта катталаштирилган
- •Ферментлар
- •Ферментларнинг каталитик фаоллиги сабаблари
- •Ҳимоя оқсиллари
- •2. Антитаналарнинг изотиплари. Улар константа қисмининг типи орқали аниқланади. Баъзи изотиплар бириктирувчи занжир ёрдамида димерларни (IgA), ёки пентамерларни (IgM) ҳосил қилади.
- •Иммун жавоб медиаторлари - цитокинлар
- •Яллиғланиш медиаторларининг классификацияси
- •Тўқима лизокиназалари, стрептокиназа
- •Плазминоген (фибринолизиноген, профибринолизин)
- •Оқсил ва пептид гормонлар
- •Оқсил ва пептид гормонлар биосинтези
- •Нейропептидлар
- •Қилувчи гипоталамус гормонлари
- •Гастроинтестинал пептид-гормонлар ва уларнинг биологик функциялари
- •Пептид токсинлар
- •Предмет кўрсаткичи
- •Номлар кўрсаткичи
- •Фойдаланилган адабиётлар
- •Интернет ресурслари
- •Мундарижа
Ферментларнинг каталитик фаоллиги сабаблари
Ферментларнинг таъсир механизми, лизоцим, рибонуклеаза, химотрипсин, карбоксипептидаза А.
1. Ферментларнинг таъсир механизми. Ферментларнинг структураси ва таъсир механизми жуда кўп халқаро конгресс ва симпозиумларда муҳокама қилинади. Бунда бутун фермент молекуласининг структурасига ва актив марказларига, турли тип ферментларнинг таъсир механизмларига, ферментатив катализнинг умумий назариясига алоҳида ўрин ажратилади. Шундай бўлишига қарамасдан, энзимологиянинг иккита кардинал муаммосини ҳал этишда ҳозиргача тўлиқ аниқлик йўқ: ферментларнинг ўзига хос – специфик таъсирига, ва уларнинг юқори каталитик эффективлигига сабаб нима?
Ферментларнинг кимёвий табиати аниқлангунга қадар уларнинг таъсир механизми ҳақидаги гипотезалар кинетика бўйича олиб борилган тадқиқотларга ва гомоген катализ бўйича ўтказилган модель экспериментларга асосланган эди. Ферментлар таъсирида кимёвий реакциялар тезлигининг ортишини қуйидагича тушунтирар эдилар:
А) қайтар диссоциацияланадиган адсорбцион ёки молекуляр фермент-субстрат комплексларининг ҳосил бўлиши
Б) радикаллар ёки кўзғалган молекулалар иштирокидаги реакцияларнинг занжир механизми ёрдамида.
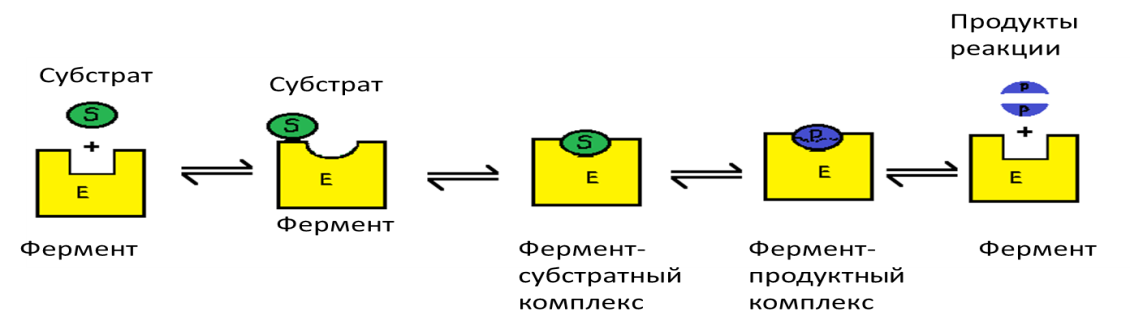
Реакцияларнинг занжирли механизми биологик катализда катта аҳамиятга эга эмаслиги кейин аниқланди. Ферментларнинг кимёвий табиати аниқлангандан кейин, ферментатив катализда фермент (Е) ўзининг субстрати (S) билан беқарор «фермент-субстрат» (ES) оралиқ комплексини (қайтар) ҳосил қилиши, ва реакция охирида бу комплекс парчаланиб эркин фермент ва маҳсулот (Р) ҳосил бўлиши мумкин деган В. Анри, Л. Михаэлис ва М. Ментен тарафидан илгари сурилган тасаввур ўз тасдиқини топди. Боғланишга бўлган юқори мойиллик ва ES-комплексининг ҳосил бўла олиши туфайли реакцияга киришувчи субстратлар сони кескин ортади. Бу тасввурлар Э.Фишернинг баъзан «мустаҳкам матрица» деб аталадиган «қулф-калит» назариясининг асосини ташкил этди. Шундай қилиб, актив марказнинг мустаҳкам структураси субстратнинг молекуляр структурасига комплементар экан, бу эса ўз навбатида ферментнинг юқори специфик эканлигини белгилайди.
Л. Михаэлис нафақат ES-фермент-субстрат оралиқ комплексининг ҳосил бўлишини постулатлаган, балки субстрат концентрациясининг реакция тезлигига таъсирини ҳам ҳисоблаб чиққан. Реакция жараёнида бир нечта босқич кўрсатилади: субстрат молекуласининг ферментга бирикиши, бирламчи оралиқ модданинг бир ёки бир неча босқичда ўтувчи бир ёки бир нечта кетма-кет оралиқ моддаларга айланиши, бир ёки бир нечта босқичда ўтувчи охирги маҳсулотнинг ферментдан ажралиши. Буни қуйидаги мисолларда кўрсатиш мумкин:
![]()
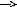 Анаболизм
реакцияларида масалан, А
+ В АВ, фермент битта субстрат билан
ҳам, иккинчиси билан ҳам, ёки иккаласи
билан ҳам бирикиши мумкин:
Анаболизм
реакцияларида масалан, А
+ В АВ, фермент битта субстрат билан
ҳам, иккинчиси билан ҳам, ёки иккаласи
билан ҳам бирикиши мумкин:
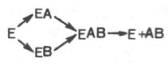
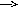 Катаболизм
реакцияларида, масалан, а) АВ А+В:
Катаболизм
реакцияларида, масалан, а) АВ А+В:
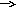 б)
АВ + Е АВЕ
б)
АВ + Е АВЕ
 в)
АВЕ А + ВЕ
в)
АВЕ А + ВЕ
 г)
ВЕ В + Е
г)
ВЕ В + Е
Оралиқ
фермент-субстрат комплексининг ҳосил
бўлиши қуйидаги схемада кўрсатилган
(70-расм): 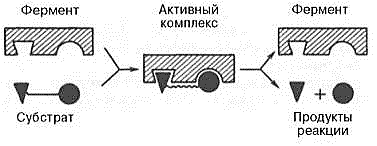
70-расм. «Фермент-субстрат» оралиқ комплексининг ҳосил бўлиши схемаси
Агар
ферментнинг актив марказида кофермент
мавжуд бўлса, учламчи (тройной) комплекс
ҳосил бўлиши тахмин этилади (71-расм):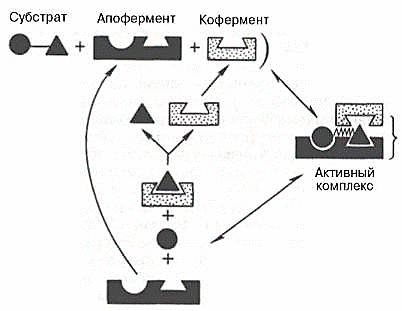
71-расм. Коферментнинг функцияси
Фермент субстрат билан қисқа вақтда ўзаро таъсирга киришади, шунинг учун узоқ вақт давомида мана шундай комплексининг ҳосил бўлишини кўрсатиш имкони бўлмаган. Фермент-субстрат комплексининг мавжудлиги ҳақидаги тўғридан-тўғри исботлар Д. Кейлин ва Б. Чанс лабораторияларида олинган. Ҳозирги вақтда кимёвий реакцияларнинг кинетик, термодинамик ва статик механика бўйича экспериментал ва математик усуллари қатор ферментатив реакциялар учун кинетик ва термодинамик кўрсаткичларни аниқлашга имкон беради, хусусан, фермент-субстрат оралиқ комплексларининг диссоциация константаларини, тезлик константаларини, уларнинг ҳосил бўлиш мувозанатларини аниқлаш имконияти бор.
Фермент-субстрат
комплексларининг ҳосил бўлишида водород
боғлар, электростатик ва гидрофоб ўзаро
таъсирлар, баъзи қатор ҳолларда эса
ковалент ва координацион боғлар иштирок
этади (72-расм):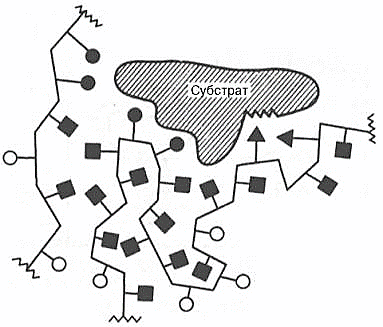
72-расм. Фермент ва субстрат орасида ноковалент боғларнинг ҳосил бўлиш схемаси
Ферментнинг актив маркази ва субстрат орасидаги боғларнинг табиати ҳақидаги маълумот электрон парамагнит резонанс спектроскопияси (ЭПР), ядро магнит резонанс спектроскопияси (ЯМР), ультрабинафша ва инфрақизил спектроскопия усуллари ёрдамида олиниши мумкин.
Ферментнинг каталитик активлиги учун унинг α-спираль мустаҳкам бўлаклари эластик букилувчан чизиқли бўлаклар билан олдинма-кетин келган ва ферментнинг оқсил молекуласининг динамик ўзгаришларини таъминлаб берадиган фазовий тузилиши муҳим аҳамиятга эга. Бу ўзгаришларга ферментатив катализда катта аҳамият берилади.
Масалан, Эмиль Фишернинг «қулф-калит» моделига (73-расм) қарама-қарши ўлароқ Дениел Кошленд тарафидан «индуцирланган мослашув» (индуцированное соответствие), «қўл-қўлкоп» (рука-перчатка, 74-расм) назарияси ишлаб чиқилган. Бу назария оқсил-фермент молекуласининг юқори даражада лабиллигини (мослашувчанлигини) ва актив марказнинг мослашувчан ва ҳаракатчанлигини қабул қилади.

73-расм. Фишернинг «қулф-калит» модели

74-расм. Кошланднинг индуцирланган мослашув - «қўл-қўлқоп» модели
Бу назария субстрат фермент молекуласининг шундай конформацион ўзгаришларини келтириб чиқарадики (индуцирлайдики), унинг актив маркази субстратни бириктириб олиши учун зарур бўлган фазовий ориентацияга эга бўлиб қолиши ҳақидаги жуда ишонарли экспериментларга асосланган эди. Бошқа сўз билан айтганда, фермент субстратни бириктириб олиш моментида ноактив R-шаклидан фарқли равишда, актив (кучланган) Т-шаклда бўлади (75-расм):
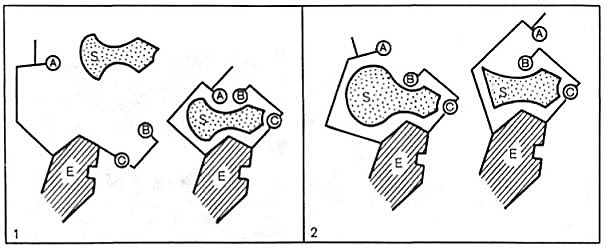
75-расм. Индуцирланган мослашув моделига кўра фермент актив марказининг субстрат таъсири келтириб чиқарган ўзгариши. А, В, С – актив марказнинг функционал группалари. 1 – актив комплекс, 2 – ноактив комплекс
75-расмдан кўриниб турибдики, S-субстратнинг Е ферментга бирикиши унинг актив маркази конформациясида тегишли ўзгаришларни келтириб чиқариб, бир ҳолатларда актив комплекс ҳосил бўлишига олиб келса, бошқа ҳолатларда оралиқ комплекс функционал группаларининг фазовий жойлашишидаги бузилишлар оқибатида ноактив комплекс ҳосил бўлишига олиб келади. Кошланд назариясига кўра субстрат ва ферментнинг индуцирланган мослашуви ўзгаришлар ҳисобига ҳосил бўлиши мажбурий эмас. Тарихга назар ташлайдиган бўлсак, Эмиль Фишер концепциясига кўра, молекулалар (субстратлар) – қаттиқ жисмлар ва улар ферментларга идеал мос келади, худди калит қулфга мос келганидек. Кошланд бу ўзаро таъсирни бутунлай бошқача тасаввур этган эди, ферментни қўлқопга ўхшатди, қўлқоп эзилган, букилган бўлиши мумкин, лекин у қўлга (субстратга) кийилганда шакл бўйича унга идеал мос келади. Ўхшаш равишда оқсил (қўлқоп) ва субстрат (қўл) орасида ўзаро таъсир бўлаётганида фермент-оқсил ўз шаклини ўзгартириши мумкин, субстрат эса кучланган (таранг) ҳолатда бўлади. Бундай тасаввур остида тушуниш мумкинки, нега сув молекуласи глюкозанинг ўрнини боса олмайди, чунки сув молекуласи кичкина ва катта оқсил молекуласида керакли конформацион ўзгаришларни келтириб чиқара олмайди. Шунинг учун ҳам бу концепция индуцирланган мослашув (қўл-қўлқоп) номини олган. 1958 йилда Кошланд назарияси таклиф этилди, 60-йилларда эса рентген кристаллографияси усуллари ёрдамида гексокиназа ва карбоксипептидаза фермент-субстрат комплекларининг тузилиши тасдиқланди. Ҳозирги вақтга келиб фермент-субстрат комплекси ҳосил бўлишининг механизмини Кошланд назарияси аниқ тасвирлаши тан олинган.
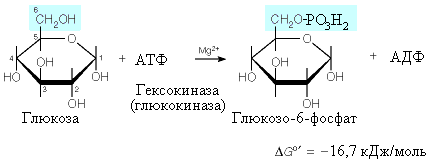
Гексокиназа фермент-субстрат комплексларининг тузилиши
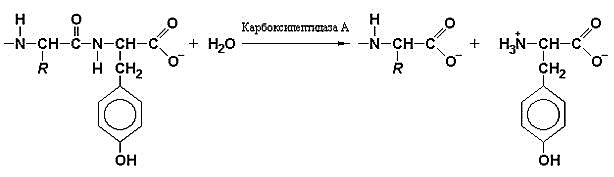
Карбоксипептидаза фермент-субстрат комплексларининг тузилиши
Каталитик жараёнда фермент ва субстрат ўртасидаги мослашув жуда муҳим, шу билан бирга ушбу мослашувнинг термодинамик ва каталитик тарафлари ҳам жуда муҳим ҳисобланади. Индуцирланган мослашув назарияси фермент ва субстрат ўртасида нафақат фазовий мослашув ёки геометрик комплементарликни, балки субстрат ва ферментнинг актив марказидаги қарама-қарши зарядланган группаларнинг бирикиши асосида ётган электростатик мослашувни ҳам кўзда тутади. Аниқ мослашув субстрат ва фермент ўртасида эффектив комплекс ҳосил бўлишини таъминлайди.
Бошқа катализаторлар каби ферментлар ҳам, термодинамик нуқтаи назардан кимёвий реакцияларни активация энергиясини пасайтириш ҳисобига тезлаштиради. Активация энергияси модданинг барча молекулаларини берилган температурада актив ҳолатга ўтказиш учун керак бўладиган энергиядир. Бошқа сўз билан айтилганда кимёвий реакция бошланиб кетиши учун керак бўладиган энергиядир, бу энергиясиз, термодинамик жиҳатдан эҳтимоллиги мавжуд бўлса ҳам, кимёвий реакция бошланмайди. Фермент энергетик даража анча паст бўлганда реакцион актив бўлиб қоладиган актив молекулаларнинг сонини орттириш ҳисобига активация энергиясини пасайтиради (76-расм):
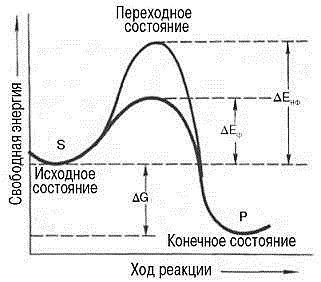
76-расм. Ферментатив ва ноферментатив кимёвий реакцияларнинг энергетик механизми: S –дастлабки модда – субстрат, Р – маҳсулот, ΔЕнф – ноферментатив реакциянинг активация энергияси, ΔЕф - ферментатив реакциянинг активация энергияси, ΔG – эркин энергиянинг стандарт ўзгариши
76-расмдан кўриниб турибдики, ферментатив реакциянинг активация энергияси анча паст. Таъкидлаш лозимки, фермент ёрдамида катализ қилинаётган реакция ҳам, катализ қилинмаётган реакция ҳам, уларнинг ўтиш йўлига боғлиқ бўлмаган ҳолда, бир хил эркин энергиянинг стандарт ўзаришини (ΔG) намоён қиладилар.
Реакция тезлигига таъсир эта туриб, ферментлар қайтар ва қайтмас реакциялар ўртасидаги мувозанатни ўзгартирмайди, шунингдек реакциянинг эркин энергиясига ҳам таъсир ўтказмайди, улар фақат кимёвий реакцияда мувозанат ҳолати бўлишини тезлаштиради.
Мувозанат константаси ва реакцияга киришаётган моддаларнинг эркин энергияси орасидаги боғлиқликни қуйидаги тенглама билан ифода этиш қабул қилинган:
ΔG = -R∙T∙lnK
бу ерда R – газ доимийси, Т – абсолют температура, Кельвин, lnK – мувозанат константасининг логарифми, ΔG – эркин энергиянинг стандарт ўзгариши, Дж/моль.
Тенгламадан кўриниб турибдики, К нинг юқори қийматларида ΔG манфий қийматга эга бўлади. Бундай реакциялар эркин энергиянинг пасайиши билан ўтади. К нинг қиймати кичик бўлганида эса ΔG мусбат қийматларга эга бўлади. Агар мувозанат константаси 1 га тенг бўлса, эркин энергия ўзгариши 0 га тенг бўлади ва реакция осон қайтар реакция бўлади.
Бирор
кимёвий реакциянинг мувозанат
константасини ёки эркин энергияси
қийматини ўлчаш учун, масалан,
фосфоглюкомутаза ферменти катализ
қилаётган глюкозо-1-фосфатни
глюкозо-6-фосфатга айланиши реакциясида
кимёвий мувозанат моментида
глюкозо-1-фосфат- ва глюкозо-6-фосфатнинг
миқдори аниқланади. Мувозанат даврида
глюкозо-6-фосфатнинг миқдори
глюкозо-1-фосфат миқдоридан 19 марта кўп
чиқди. Демак, мувозанат константаси К
= 19. 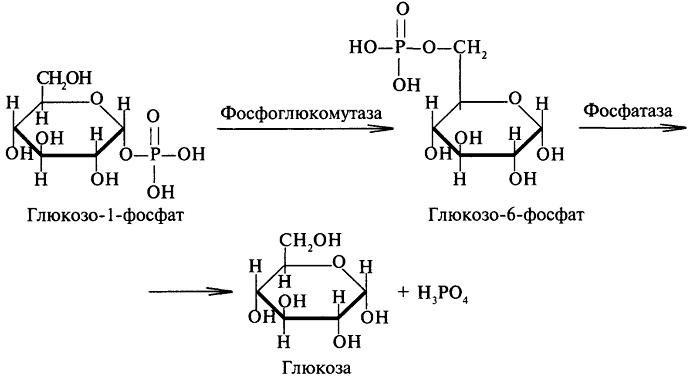
Глюкозо-1-фосфатни глюкозо-6-фосфатга айланиши
Бу рақамни юқоридаги тенгламага қўйиб ΔG = -7329 Дж/моль ни оламиз. Бу дегани, 25°С да 1 моль глюкозо-1-фосфат 1 моль глюкозо-6-фосфатга айланишида системанинг эркин энергияси 7329 Дж га камаяди.
Шундай қилиб, ферментатив катализ механизмида ҳосил бўлиши актив марказнинг нозик учламчи структураси орқали белгиланадиган оралиқ фермент-субстрат комплекслари, шунингдек, биокатализаторнинг юқори каталитик активлигини ва таъсирининг ўзига хослигини (спецификлигини) таъминлаб берувчи фермент молекуласининг уникал структуравий ташкил этилганлиги етакчи рольни ўйнайди.
2. Лизоцим. Лизоцим (ингл. lysozyme, КФ 3.2.1.17, лизис - эриш), мурамидаза – гидролазалар синфига кирувчи фермент, антибактериал агент ҳисобланади, муреина бактерияларининг ҳужайра деворлари пептидогликанларини гидролиз йўли билан парчаловчи фермент.
Лизоцим биринчи навбатда организмнинг ташқи муҳит билан контакда бўладиган жойларида мавжуд – ошқозон-ичак трактининг яллиқ қаватларида, кўз ёш суюқликларида, сўлакда, бурун-томоқ яллиқ қаватларида, бу билан унинг антибактериал хоссалари тушунтирилади. Лизоцим 1922 йилда Александр Флеминг тарафидан очилган. Озиқ-овқат саноатида Е1105 озиқ-овқат қўшимчаси сифатида регистрацияланган.
Лизис механизми. Лизоцим бактериялар ҳужайра девори таркибига кирувчи пептидогликанларга (хусусан, муреин) ҳужум қилувчи фермент. Лизоцим N-ацетилмурам кислотаси ва N-ацетилглюкозамин орасидаги 1,4-гликозид боғини гидролизлайди:
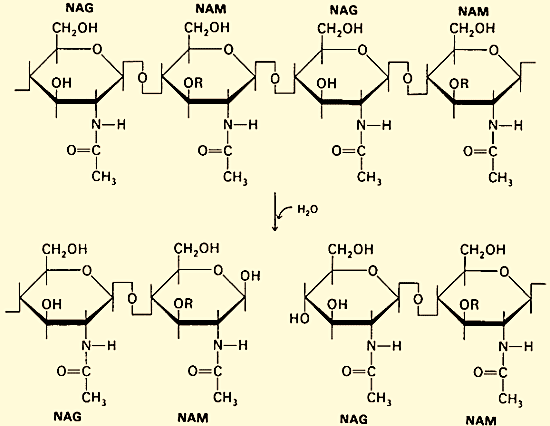
NAG - N-ацетилглюкозамин, NAM - N-ацетилмурам кислотаси гидролизи
Бунда
пептидогликан ферментнинг иккита
структуравий доменлари орасида жойлашган
(чўнтак шаклида) актив маркази билан
бирикади. Актив марказда субстрат
молекуласи оралиқ ҳолат конформациясига
яқин конформацияни эгаллайди. Филлипс
механизмига кўра, лизоцим аввал
гексасахарид билан бирикади, сўнгра
занжирдаги 4-қолдиқни твист-кресло
конформациясига ўтказади. Бундай
кучланган ҳолатда гликозид боғи осон
узилади (77-расм).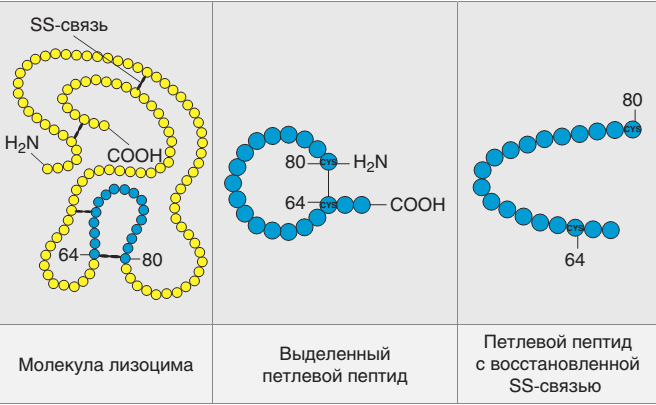
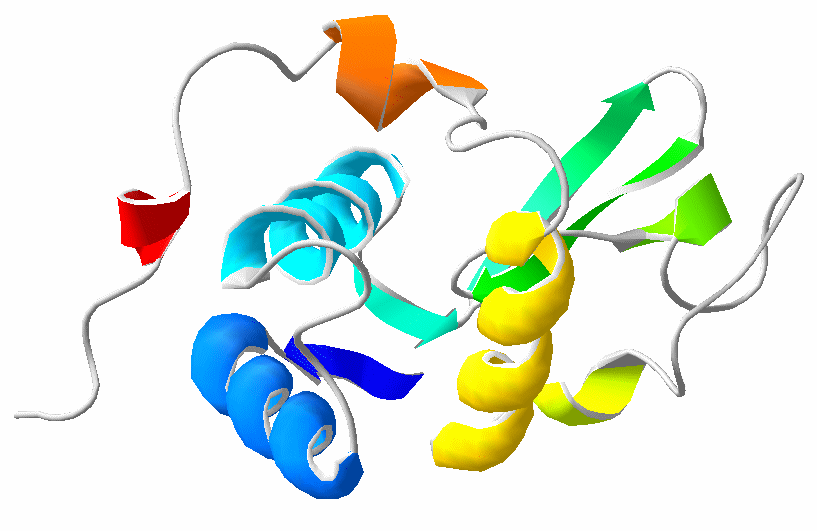
77-расм. Лизоцим
Глутамин кислотаси (Glu35) ва аспарагин кислотаси (Asp52) фермент амал қилиши учун критик (бўлиши шарт) ҳисобланади. Glu35 протоннинг донори сифатида субстратнинг гликозид боғини узишда амал қилади, Asp52 эса оралиқ модда – гликозил-фермент ҳосил бўлишида нуклеофил вазифасини бажаради. Кейинчалик гликозил-фермент сув молекуласи билан таъсирлашади, ва натижада фермент ўзининг дастлабки ҳолатига қайтади ва гидролиз маҳсулоти ҳосил бўлади.
Турли манбаълардан 50 дан ортиқ лизоцимлар ажратиб олинган. Уларнинг барчаси битта полипептид занжиридан иборат ва асослилиги юқори бўлган оқсиллардир (рI 10,5-11,0). Энг кўп ўрганилган лизоцим тухум оқидан ажратиб олинган бўлиб унинг молекуляр массаси 14306 Да га тенг. Бу ферментнинг тузилиши, жумладан учламчи тузилиши тўлиқ ўрганилган.
3.
Рибонуклеазалар (РНКазалар) – гидролазалар
синфига кирувчи ферментлар бўлиб, РНК
нуклеозидлари орасидаги фосфодиэфир
боғларининг узилишини катализ қилади.
Маълум бўлган рибонуклеазаларнинг
кўпчилиги РНК гидролизини дастлабки
ички молекуляр трансфосфориллаш йўли
билан узилган занжир 3'-охирида
нуклеозид-2',3'-циклофосфатни ҳосил қилиб
амалга оширади: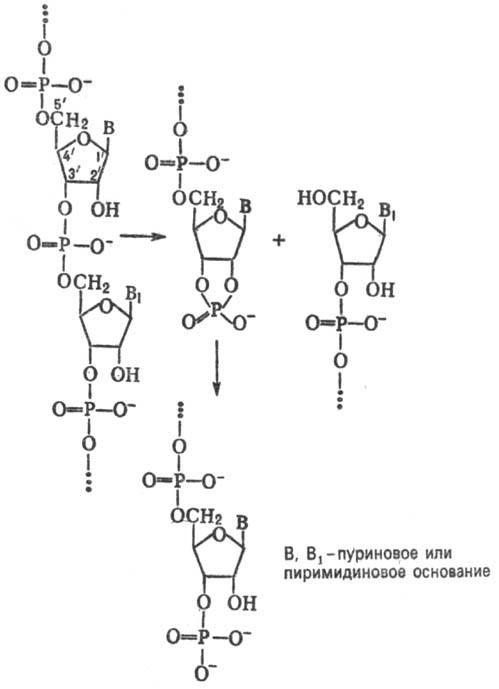
РНКнинг рибонуклеза ёрдамида гидролизланиши
Рибонуклеаза
ўлчами унча катта бўлмаган глобуляр
оқсил бўлиб, ошқозон
ости бези ингичка ичакка ишлаб чиқарадиган
ферментдир. Рибонуклеазанинг рентген
структуравий анализ ёрдамида аниқланган
учламчи структураси шу билан
характерланадики, унинг полипептид
занжири таркибида α-спираль бўлаклар
кам, аммо β-конформациядаги сегментлар
жуда кўп (78-расм):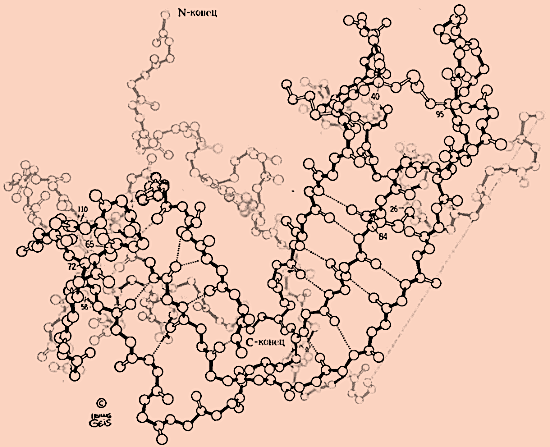
78-расм. Рибонуклеаза молекуласининг конформацияси рентген структура анализи ёрдамида аниқланган. Пунктир чизиқлар билан β-бурма қават полипептид занжирлари орасидаги водород боғлар кўрсатилган. Юқори қисмдаги бўшлиқ субстратни бириктириб олиш марказидир
Рибонуклеаза шуниси билан миоглобин, цитохром С ва лизоцимдан фарқ қилади. Бироқ, лизоцимга ўхшаш, рибонуклеаза молекуласида ҳам цистеиннинг 4 та қолдиғи бор, улар полипептид занжирлари ҳосил қилган илгак ўртасида дисульфид боғларини ҳосил қиладилар. Бу натив молекулага мустаҳкамлик бағишлайди.
79-расм.
Рибонуклеаза А нинг актив марказининг
тузилиши – рентген структуравий анализ
ёрдамида олинган: субстрат -
уридилил-(3'→5')-аденозин – қора рангда
кўрсатилган. Водород боғлар пунктир
билан кўрсатилган.
Гли
11, Тир 45 ва Сер 123 аминокислоталарининг
қолдиқлари мононуклеотид билан водород
боғ орқали бирикади ва шу билан субстратни
фиксациялайди. Актив марказни
шакллантирувчи аминокислоталар ва Гис
119. Бу икки аминокислота катализда
иштирок этади, Гис 12 рибозанинг ОН
группаси билан боғланади, Гис 119 эса
қўшни фосфат билан таъсирлашади. Бунда
рибозанинг ОН группаси ва фосфат кислота
қолдиғи ўртасидаги боғ узилади.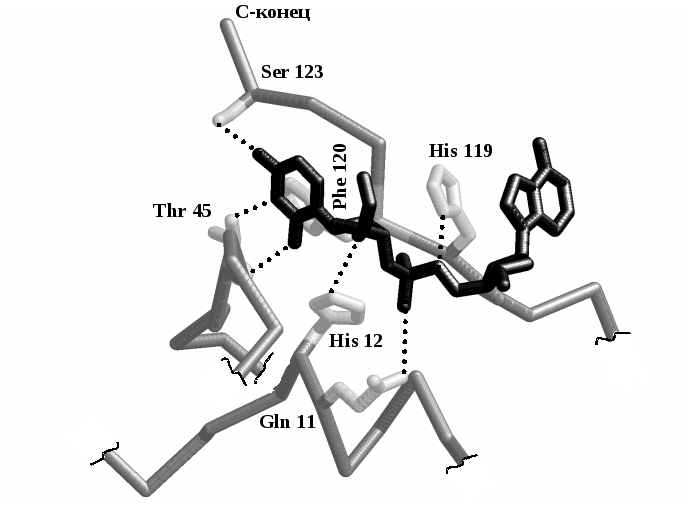
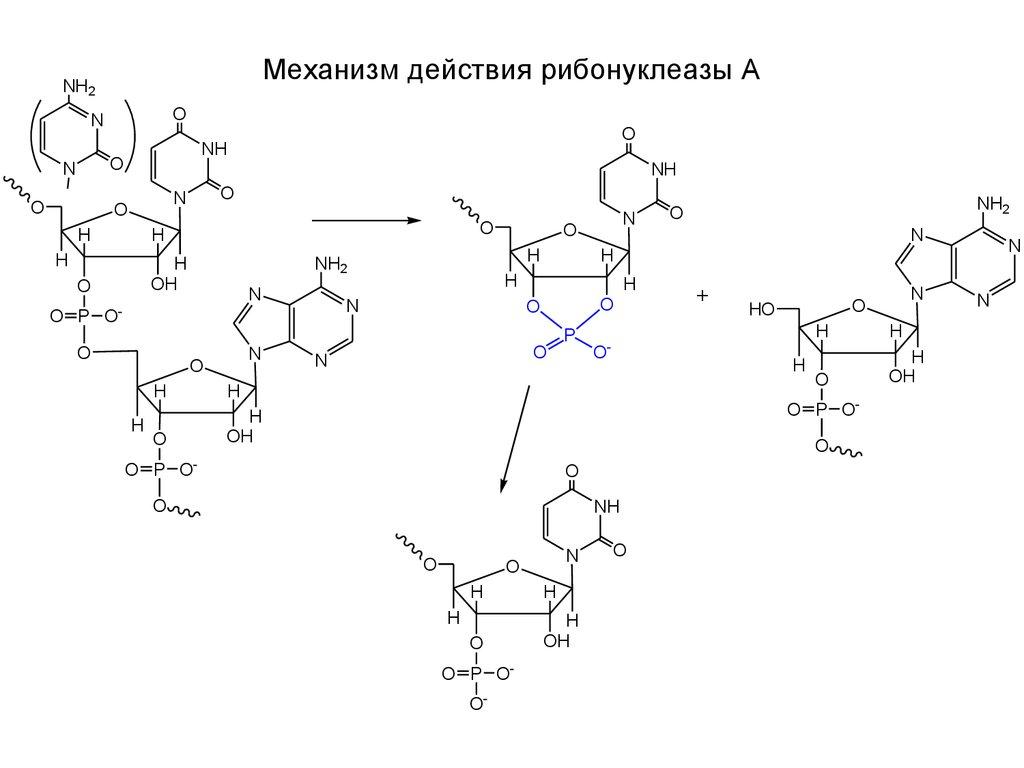
80-расм. Рибонуклеза А ферментининг таъсир механизми
-
Химотрипсин – гидролазалар синфига кирувчи фермент. Химотрипсин оқсил молекуласининг учларидан узоқроқда бўлган пептид боғларининг гидролизини катализлайди, шунинг учун у эндопептидазалар сирасига киритилган. Гидрофоб аминокислотар ҳосил қилган пептид боғларини каттароқ тезликда гидролизланишини бошқаради. Бундан ташқари, шу аминокислоталарнинг мураккаб эфирларини, амидларини ҳам гидролизлайди. Химотрипсин – кўпчилик умуртқали организмлар ошқозон ости бези ноактив шаклда – химотрипсиноген шаклида - ишлаб чиқарадиган фермент бўлиб, ўн икки бармоқли ичакда трипсин таъсирида протеолизга учраб, химотрипсинга айланади.
Трипсин проферментда – химотрипсиногенда – 4 та пептид боғини гидролизлаб, молекуладан 14-15 ва 147-148 ҳолатлардаги иккита дипептидни йўқотади. Химотрипсиннинг ҳосил бўлган 3 та фрагменти дисульфид боғлар билан боғланиб қолади. Химотрипсин ва трипсин ингичка ичакда оқсилларни парчалашда иштирок этади.
Химотрипсиннинг учламчи структураси 1967 йилда Дэвид Блоу тарафидан аниқланган. Химотрипсин шарсимон молекула бўлиб, S-S боғлари ёрдамида боғланган 3 та полипептид занжиридан иборат (81-расм):
81-расм.
α-Химотрипсиннинг учламчи структураси.
Каталитик актив триада: Ser 195, His57,
Asp102
ажратиб кўрсатилган. Пептид субстратининг
фрагменти ҳам ажратиб кўрсатилган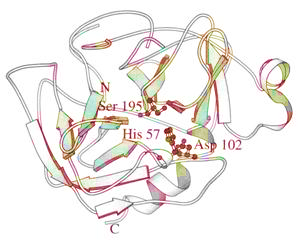
Химотрипсиннинг таъсир механизми. Химотрипсин пептид занжиридаги ароматик аминокислоталар (Trp, Phe, Tyr) бор бўлган пептид боғини гидролизланишини катализ қилади. Химотрипсин катализ қилаётган реакция оралиқ ҳолатнинг барқарорланиши принципини кўрсатади ва кислота-асос ва ковалент катализнинг классик мисоли бўла олади. Каталитик цикл икки фазадан иборат бўлиб, биринчи фазада субстратнинг пептид боғи узилади ва пептиднинг карбонил группаси ҳамда Ser195 нинг ОН группаси ўртасида эфир боғи ҳосил бўлади. Иккинчи фазада эса эфир боғининг гидролизи ҳамда эркин ферментнинг регенерацияси содир бўлади.
Химотрипсиннинг
актив марказида ковалент катализнинг
механизми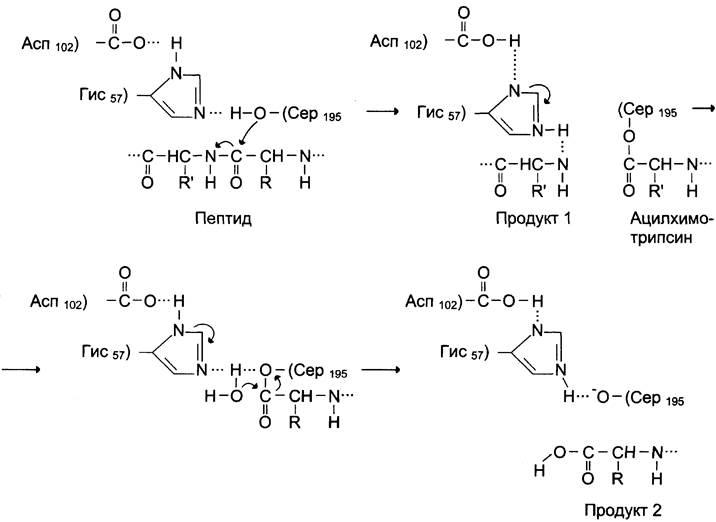
Асп102, Гис57 ва Сер195 радикаллари бевосита катализ актида иштирок этади. Субстратнинг пептид боғига нуклеофил ҳужум натижасида бу боғнинг ковалент модификацияланган серин - ацил-химотрипсин ҳосил қилиб, узилиши содир бўлади. Бошқа пептид фрагменти пептид фрагменти ва химотрипсиннинг актив марказидаги Гис57 ўртасидаги водород боғнинг узилиши натижасида ажралиб чиқади. Оқсил пептид боғининг гидролизланишининг якуний этапида – сув молекуласи иштирокида химотрипсин деацилланади ва гидролизланаётган оқсилнинг ва фермент дастлабки шаклининг иккинчи фрагменти ажралиб чиқади.
Химотрипсиннинг актив марказида гидрофоб «чўнтак» мавжуд бўлиб унда гистидин ва серин аминокислоталарининг қолдиқлари жойлашган.
82-расм.
Химотрипсиннинг 
актив маркази
Химотрипсиннинг
ингибиторлари – оғир металл ионлари,
борорганик кислоталар, диизопропилфторфосфат
ва бошқалардир. 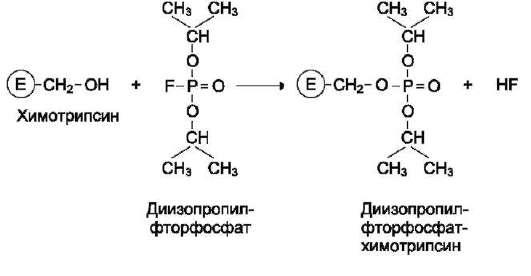
Химотрипсиннинг етишмаслиги ёки ортиқча бўлиши овқат ҳазм қилиш системасида билинади. Медицинада химотрипсин ферменти некрозга учраган тўқималарни парчалаш учун, балғамни суюқлантириш ва кўчиришни енгиллаштириш учун, тромбофлебитларда ва бошқа ҳолатларда қўлланилади.
-
Карбоксипептидазалар - гидролазалар синфига кирувчи ферментлардир, 83-расм.
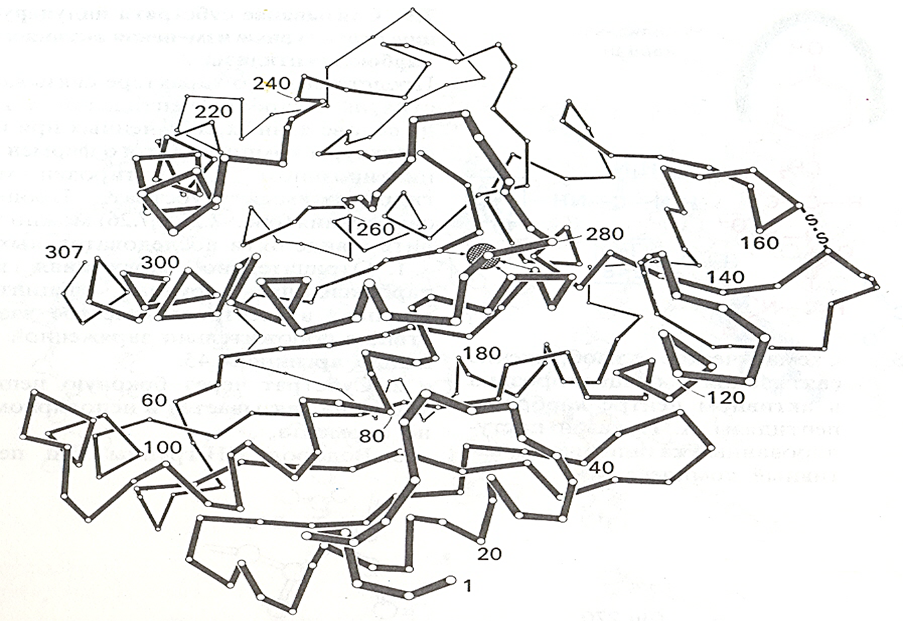
83-расм. Карбоксипептидаза А ферментининг учламчи структураси.
α-Углерод атомлари ва рух иони (марказда қора рангда) кўрсатилган
Кабоксипептидазалар оқсил ва пептидлар молекулаларидаги С-охирги аминокислоталарнинг гидролитик узилишини катализ қилувчи ферментлардир.

Карбоксипепдидазаларнинг иккита типи энг кўп ўрганилган, ва улар спецификлиги билан бир-биридан фарқ қилади: А типидаги карбоксипептидаза (ММ 34400, 307 та аминокислота қолдиғидан тузилган) аргинин, лизин, пролин ва гидроксипролиндан ташқари пептидларнинг барча С-охирги аминокислотасини узади. В типидаги карбоксипептидаза (ММ 34000, 300 та аминокислота қолдиғидан тузилган) фақат аргинин ва лизиннинг С-қолдиқларини узади. Бу иккала фермент рН 7,5 да максимал каталитик активликни кўрсатади.
Кабоксипептидазаларнинг актив маркази «чўнтак» шаклида, ва унинг бўшлиғида Zn атоми бор. Актив марказга яна глутамин кислотаси, тирозин ва аргинин қолдиқлари ҳам кирган. Катализ механизмида аргининнинг функцияси – С-охирги СООН группасини боғлаб олишдир. Рентген- структуравий анализ маълумотларига кўра Уильям Липскомб карбоксипептидаза А нинг каталитик таъсир механизмини таклиф этган:
Карбоксипептидазанинг
реакцион актив ЕS-комплекси (Липскомб)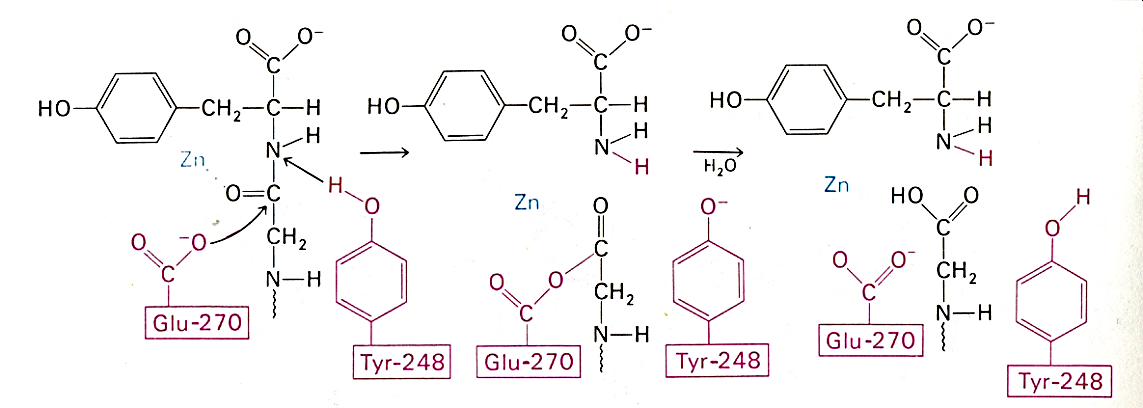
Карбоксипептидаза А нинг каталитик таъсир механизми - Glu-270 гидролизланаётган пептид боғи карбонил углерод атомига бевосита ҳужум қилади, Туr-248 шу пептиднинг NН-группасига протон беради. Натижада ҳосил бўлган ангидрид гидролизга учрайди.
Рентген-структуравий маълумотлар билан мос келадиган бошқа механизм бўлиши ҳам мумкин.
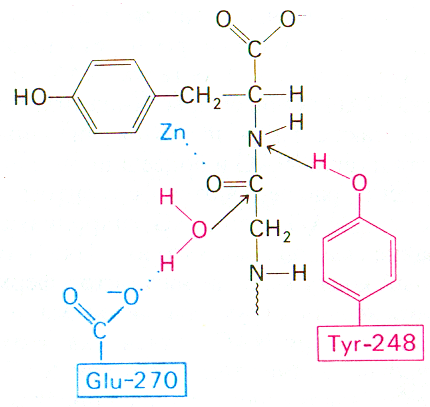
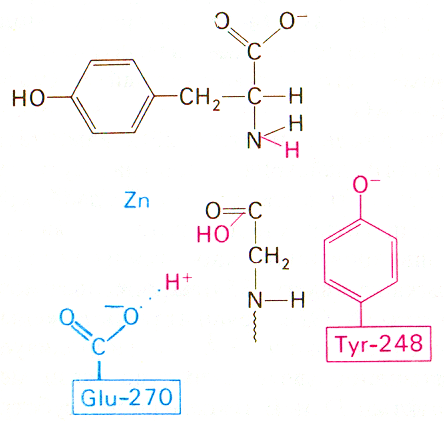
Карбоксипептидаза А каталитик таъсирининг иккинчи,
бўлиши мумкин бўлган, механизми схемаси
Туr248 биринчи механизмдаги функцияни бажаради. Glu270 парчаланаётган пептид боғи карбонил группаси углерод атомига ҳужум қилаётган сув молекуласини активлаштиради. Гидролиз тўғридан-тўғри, оралиқ ангидрид ҳосил бўлмасдан, амалга ошади.
Бу схемага кўра глутамат-270 сув молекуласини активлаштиради. Ҳосил бўлаётган ОН¯ парчаланаётган пептид боғи карбонил группаси углерод атомига ҳужум қилади. Бир вақтнинг ўзида тирозин-248 унинг NН-группасига протонни беради, натижада пептид боғи гидролизланади. Катализнинг бу механизми юқорида келтирилган биринчи механизмдан шуниси билан фарқ қиладики, сув таъсирида ҳосил бўлган оралиқ ангидрид эмас, бевосита субстратнинг пептид боғи гидролизланади. Охирги вақтларда олиб борилган кимёвий ва спектроскопик тадқиқотлар шуни кўрсатдики, пептид субстратларнинг гидролизи тўғридан-тўғри механизм бўйича амалга ошар экан, эфирларнинг гидролизи эса глутамат-270 билан оралиқ ангидридни ҳосил қилиб амалга ошар экан.
Ушбу
катализ схемаларида Zn
ионининг роли нимадан иборат?
Парчаланаётган пептид боғи карбонил
группаси рух ионига нисбатан шундай
жойлашганки,
С=О боғи одатдагидан кўпроқ
қутбланган бўлади. Бу углерод атомини
нуклеофил ҳужумга сезгир қилиб қўяди.
Рух ионининг қутбсиз атрофи унинг
эффектив зарядини орттиради ва шу билан
диполь ҳосил бўлишига олиб келади.
Карбонил группасининг кучли қутбланишига
глутамат-270 даги манфий заряднинг
яқинлиги ҳам таъсир ўтказади. Демак,
карбоксипептидаза А субстратнинг ўзида
катализ тезлигининг ортишига сабаб
бўлувчи электронлар силжишини келтириб
чиқаради.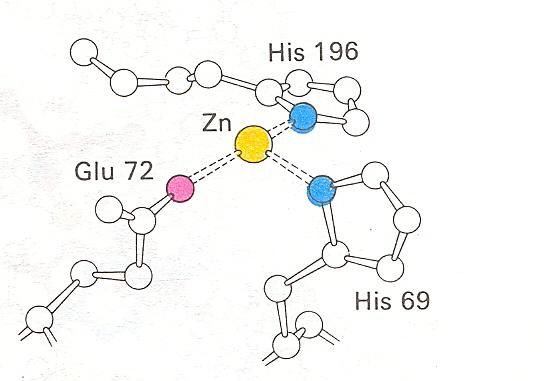
84-расм. Карбоксипептидаза А актив марказидаги рух иони иккита гистидин ва глутамат аминокислота қолдиқларининг ён занжирлари билан координацион
боғ ҳосил қилади
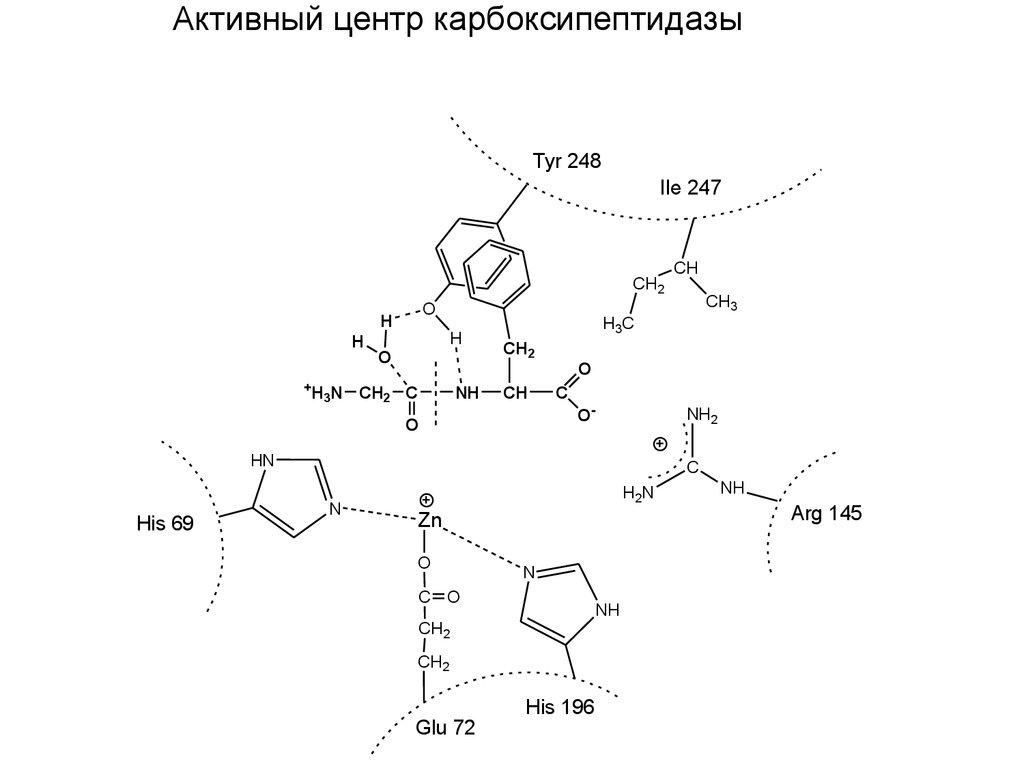
85-расм. Карбоксипептидаза ферментининг актив маркази
Иккала карбоксипептидазаларнинг қайтмас ингибиторлари – металлар билан комплекс бирикмалар ҳосил қилувчи моддалардир, масалан, 1,10-фенантролин, 8-гидроксихинолин, конкурент ингибиторлари – ферментдан субстрат тарафидан сиқиб чиқариладиган ингибиторлар - фенилпропион ва ε-аминокапрон кислоталаридир.
А ва В типидаги карбоксипептидазаларни одам ва ҳайвонларнинг ошқозон ости бези ишлаб чиқаради. Ўн икки бармоқли ичакда бу проферментлар трипсин таъсирида карбоксипептидазанинг актив шаклларини ҳосил қилади.
С-типидаги карбоксипептидаза ҳам маълум, у С-охиридаги ҳар қандай аминокислота қолдиғини узади. Бу фермент цитрус ўсимликларининг мевалари ва баргларидан ажратиб олинган.
Одамнинг қони плазмаси таркибида N-типидаги карбоксипептидаза мавжуд, унинг каталитик активлиги рН7 га тўғри келади, субстрат спецификлиги бўйича у карбоксипептидаза В га ўхшаш. Бу фермент қон таркибидаги брадикинин оқсилининг С-охиридаги аргинин аминокислотасини узади, натижада брадикинин активлигини йўқотади, яъни қон босимини пасайтириш хусусиятини йўқотади.
Карбоксипептидазалардан оқсил ва пептидлар занжиридаги С-охирги аминокислотани аниқлашда фойдаланилади.
Мавзуни қайтариш учун саволлар:
-
Ферментларнинг таъсир механизмини тушунтиришда Э.Фишернинг «қулф-калит» назариясининг моҳияти нимадан иборат?
-
Ферментларнинг таъсир механизмини тушунтиришда Кошланднинг «қўл-қўлқоп» моделининг моҳияти нимадан иборат?
-
Индуцирланган мослашув назарияси фермент ва субстрат ўртасида қандай мослашувларни кўзда тутади?
-
Лизоцим ферменти ва лизис механизми ҳақида маълумот беринг
-
Рибоеуклеазалар ҳақида маълумот беринг
-
Химотрипсин ва трипсин ҳақида маълумот беринг
-
Химотрипсиннинг таъсир механизми остида қандай реакциялар ётади?
-
Гидролазалар синфига кирувчи карбоксипептидазалар қандай жараёнларни катализ қилади?
-
Карбоксипептидазанинг актив маркази қандай тузилган?
-
Карбоксипептидазанинг катализ схемаларида Zn ионининг роли нимадан иборат?
-
Рибонуклеазанинг рентген структуравий анализ ёрдамида аниқланган учламчи структурасига кўра унинг полипептид занжири таркибида α-спираль ва β-конформациядаги сегментлар нисбати қандай?
-
Ҳозирги вақтга келиб фермент-субстрат комплекси ҳосил бўлишининг механизмини қайси назария аниқ тасвирлаб беради?
-
Одамнинг қони плазмаси таркибида кандай типидаги карбоксипептидаза бор, унинг каталитик активлиги киймати канча?
-
Карбоксипептидазаларнинг қайси ингибиторларини биласиз?
-
Карбоксипептидаза А субстратнинг ўзида катализ тезлигининг ортишига сабаб бўлувчи қандай факторни келтириб чиқаради?
-
Химотрипсиннинг актив марказида гидрофоб «чўнтак» мавжуд, унда қайси аминокислоталарининг қолдиқлари жойлашган?
-
Химотрипсиннинг ингибиторлари қандай моддалар?
-
Бактериялар ҳужайра девори таркибига кирувчи пептидогликанларга ҳужум қилувчи ферментнинг номи нима?
-
Лизоцим N-ацетилмурам кислотаси ва N-ацетилглюкозамин орасидаги қандай боғини гидролизлайди?
-
Лизис механизмининг моҳияти нимадан иборат?
