
- •Аминокислоталар, пептидлар, оқсиллар
- •Оқсилларнинг аминокислота таркибини аниқлаш
- •Оқсилларнинг тузилиши
- •Оқсил ва пептидларнинг кимёвий синтези
- •Оқсиллар ва пептидларнинг кимёвий модификацияси
- •40000 Марта катталаштирилган
- •Ферментлар
- •Ферментларнинг каталитик фаоллиги сабаблари
- •Ҳимоя оқсиллари
- •2. Антитаналарнинг изотиплари. Улар константа қисмининг типи орқали аниқланади. Баъзи изотиплар бириктирувчи занжир ёрдамида димерларни (IgA), ёки пентамерларни (IgM) ҳосил қилади.
- •Иммун жавоб медиаторлари - цитокинлар
- •Яллиғланиш медиаторларининг классификацияси
- •Тўқима лизокиназалари, стрептокиназа
- •Плазминоген (фибринолизиноген, профибринолизин)
- •Оқсил ва пептид гормонлар
- •Оқсил ва пептид гормонлар биосинтези
- •Нейропептидлар
- •Қилувчи гипоталамус гормонлари
- •Гастроинтестинал пептид-гормонлар ва уларнинг биологик функциялари
- •Пептид токсинлар
- •Предмет кўрсаткичи
- •Номлар кўрсаткичи
- •Фойдаланилган адабиётлар
- •Интернет ресурслари
- •Мундарижа
Оқсилларнинг тузилиши
Оқсилларнинг бирламчи тузилиши, оқсилларнинг иккиламчи тузилиши, оқсилларнинг учламчи тузилиши, оқсилларнинг тўртламчи тузилиши
оқсил ва пептидларнинг фазовий тузилиши
Кириш. Оқсилларнинг тузилиши жуда мураккаб, Линдерстрём-Ланг тавсиясига кўра уларнинг структуравий ташкил этилганлигини белгилаш учун бирламчи, иккиламчи, учламчи структуралар каби терминлар қабул қилинган. Оқсилларнинг бирламчи структураси бир бири билан пептид боғлар орқали боғланган аминокислота қолдиқларининг сони ва кетма-кетлиги ҳақида маълумот беради. Оқсилларнинг иккиламчи структураси карбоксил группасининг кислород атомлари ва амид группасининг азот атомлари орасида ҳосил бўлган водород кўприклари натижасида вужудга келган полипептид занжирининг конформацияси ҳақида маълумот беради. Оқсилларнинг учламчи структураси деганда ён занжирларининг ички молекуляр ўзаро таъсири натижасида полипептид занжирининг уч ўлчамли (фазовий) жойланишини тушуниш керак. 1958 йилда Бернал тарафидан киритилган тўртламчи структура термини қатор оқсилларда кузатиладиган интакт полипептид занжирларининг маълум молекуляр комплексга (суббирлик) бирлашишини кўрсатади. Оқсилларнинг иккиламчи, учламчи ва агар бор бўлса тўртламчи структуралари қўшилиб оқсилнинг конформациясини беради.
-
Оқсилларнинг бирламчи структураси деганда уларнинг молекулаларидаги аминокислоталар кетма-кетлигини тушуниш керак. Маълумки, аминокислоталар орасидаги боғ – пептид боғлардан иборат. «Бирламчи структура» ва «аминокислота кетма-кетлиги» терминлари бир-бирининг ўрнини боса олувчи терминлардир. Оқсил молекуласининг бирламчи структурасини N-охирги аминокислотадан бошлаб С-охирги аминокислота тарафга йўналган ҳолда ёзиш қабул қилинган. Демак, полипептид занжири векторликни намоён қилади, яъни N-охиридан С-охиригача. Занжирнинг N-охирида эркин α-аминогруппа бор, С-охирида эса эркин СООН группаси бор. Аминокислоталар кетма-кетлиги N-охиридан бошлаб аминокислоталарнинг уч ҳарфдан иборат қисқартирилган номлари билан белгиланади, масалан гли-ала-цис-про.
Полипептид
занжирининг «скелети», яъни асоси
регуляр қайтариладиган структура
элементларидан иборат: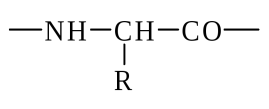
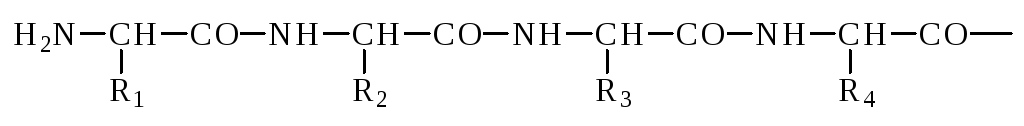
Оқсиллар таркибидаги N- ва C-охирлар модификацияланган бўлиши мумкин, масалан N-охиридаги аминокислота ацетилланган, формилланган ёки метилланган бўлиши мумкин. С-охиридаги аминокислота амидланган бўлиши мумкин. С-охиридаги аминокислотанинг модификацияланиши N-охиридаги аминокислотанинг модификацияланишига қараганда камроқ учрайди.
Ҳар бир индивидуал оқсил уникал бирламчи структурага эга. Бирламчи структураси аниқланган биринчи оқсил 51 та аминокислота қолдиғидан иборат бўлган (30+21) инсулин эди (Сенгер). У дастлаб иккита полипептид занжирини ажратиб олади. Сўнгра уларни специфик ферментатив парчалаб, кичикроқ пептидларни олади. 1-фтор-2,4-динитробензол билан пептидларга ишлов бериб уларниг N-охирги кислотасини аниқлайди. У барча ажратиб олинган пептидларнинг аминокислота қолдиқларини, улардаги ўхшаш кетма-кетликларни солиштирган ҳолда, аниқлайди. Натижада инсулин молекуласининг бирламчи структураси аниқланади (1958 йил Нобель мукофоти), 9-расм.
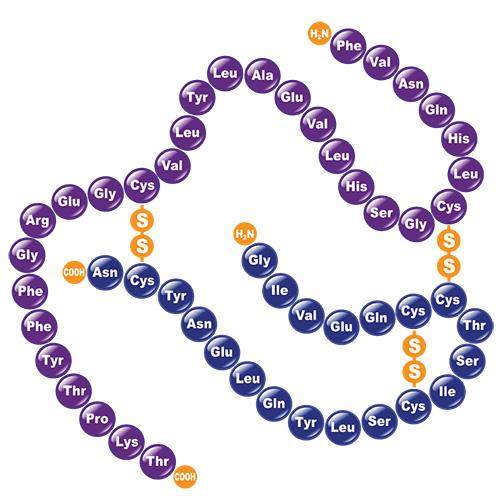
9-расм. Инсулин молекуласи модели
Инсулин
(лот. insula «орол») – оқсил табиатига эга
бўлган гормон, ошқозон ости безининг
Лангерганс оролчаларининг бета-ҳужайраларида
ҳосил бўлади (10-расм). Деярли барча
тўқималарда модда алмашинуви жараёнига
кўп факторли таъсир ўтказади. Инсулиннинг
асосий таъсири қонда глюкоза
концентрациясини пасайтиришдан иборат.
Энг кўп ўрганилган гормон ҳисобланади.
Бета-ҳужайраларнинг деструкцияси
натижасида инсулиннинг секрецияси
бузилади – бунда инсулиннинг абсолют
етишмовчилиги юзага келади – бу 1-тип
қандли диабет касаллигидир. Инсулиннинг
тўқималарга таъсирининг бузилиши –
нисбий инсулин етишмовчилиги – 2- тип
қандли диабетни келтириб чиқаради.
10-расм. Ошқозон ости бези Лангерганс оролчаларининг тузилиши
Ҳозирги вақтга келиб ўн минглаб турли оқсилларнинг бирламчи структураси аниқланган, ва бу факт кимё ва биоқимё фанларининг ютуқларидан биридир. Аммо, бу рақам жуда кичик кўрсаткичдир, чунки табиатда тахминан 1012 га тенг бўлган турли-туман оқсиллар бор ва улар ҳали ўрганилмаган.
Шундай қилиб, оқсилларнинг бирламчи структураси полипептид занжирида аминокислота қолдиқларининг жойлашиш тартиби, кетма-кетлигини билдиради. Бирламчи структурани, ҳар бир аминокислотанинг жойлашган ўрнини билган ҳолда оқсил молекуласининг структура формуласини аниқ ёзиб бериш мумкин.
Оқсилларнинг бирламчи структураси генетик белгилангандир, яъни оқсил молекуласидаги аминокислоталар кетма-кетлиги ДНК молекуласидаги нуклеотидлар кетма-кетлиги билан белгиланади (ҳар учта нуклеотид битта аминокислота синтезини билдиради). Нуклеотидлар кетма-кетлигининг бузилиши оқсил синтезининг, ва оқибатда унинг структурасининг бузилишига олиб келади. Натижада биологик хусусиятлари аномал бўлган оқсиллар синтез бўлиб қолади. Масалан, ўроқсимон ҳужайра анемиясининг (серповидноклеточная анемия, 11-расм) сабаби гемоглобин оқсилининг α-занжирини назорат қилувчи геннинг айниши – мутацияга учраши билан боғлиқ.
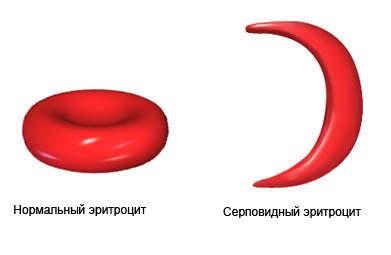
11-расм. Ўроқсимон ҳужайра анемиясида эритроцитлар шаклининг ўзгариши
Бунда α-занжирдаги 6-ўриндаги глутамат ўрнини валин эгаллаган бўлади. Бундай ўзгариш иккала α-занжирдаги манфий заряднинг йўқотилишига олиб келади, бу эса гемоглобин конформациясини ўзгартириб юборади, ва оқибатда унинг биологик функциясининг йўқотилишига сабаб бўлади.
Оқсилларнинг бирламчи структураси, структуравий ташкил этилганликнинг энг оддий даражаси бўлгани учун, кейинги юқори даражаларни қандай ташкил этилиши мумкинлигини белгилайди.
-
Оқсилларнинг иккиламчи структураси – аминокислоталар қолдиқларидан тузилган занжирлар водород боғлари орқали боғланиб, кай тарзда фазовий структураларни (ҳалқа, барг, сфероидлар) ҳосил қилиши билан белгиланади.
Полипептид
занжирининг альфа-спираль (12-расм) ёки
β-структурани ҳосил қилишига оқсилларнинг
иккиламчи структураси дейилади.
Полипетид занжирининг ҳамма қисми бир
хилда спиралланган бўлмай оз қисми
тўғри аморф ҳолда бўлиши мумкин.
Оқсилларнинг иккиламчи структураси
полипептид молекуласининг фазодаги
конфигурациясини (жойлашувини)
белгилайди.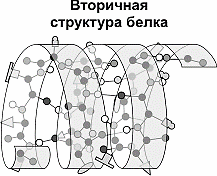
12-расм. Оқсил молекуласининг иккиламчи структураси - α-спираль
Оқсил молекуласининг иккиламчи структураси ҳосил бўлишида карбонил группанинг кислороди ва имин гуруҳлари ўртасида водород боғларининг ҳосил бўлиши аҳамиятлидир. Водород боғлари ковалент боғга нисбатан кучсиз бўлиб, лекин, улар сонининг кўп бўлиши натижасида ҳосил бўлган спираль пружинадек мустаҳкам бўлади (13-расм).

13-расм. Иккиламчи структура ҳосил бўлишида водород боғларининг иштироки
Спираль ҳосил бўлишига пролин ва гидроксипролин аминокислоталари ҳалал беради. Улар ўзларининг циклик тузилишлари оқибатида занжирнинг «синишига», ёки «бурилишига» сабаб бўладилар. Спиральнинг бир ўрамининг баландлиги 0,54 нм ни ташкил этади ва 3,6 аминокислота қолдиғига тўғри келади. Бешта тўлик ўрам спиральда 18 та аминокислотага тўғри келади ва 2,7 нм ни ташкил этади.
α-Спираль
(14-расм) полипептид занжирининг жуда
зич жойланиши (упаковка) билан
характерланади. Полипептид зпнжирининг
зич ўралган тизмаси стержень – ўқ ҳосил
қилади. Аминокислоталарнинг қолдиқлари
ташқарига қараган бўлиб, стерженьдан
ҳар тарафда жойлашган бўлади. Оқсиллар
қуйидаги иккиламчи структураларни
намоён қила олади: α - спираль, β - бурма
қаватлар (15-расм), β-бурилиш. α-Спираль
ўнг ва чап томонга буралган ҳолда бўлиши
мумкин.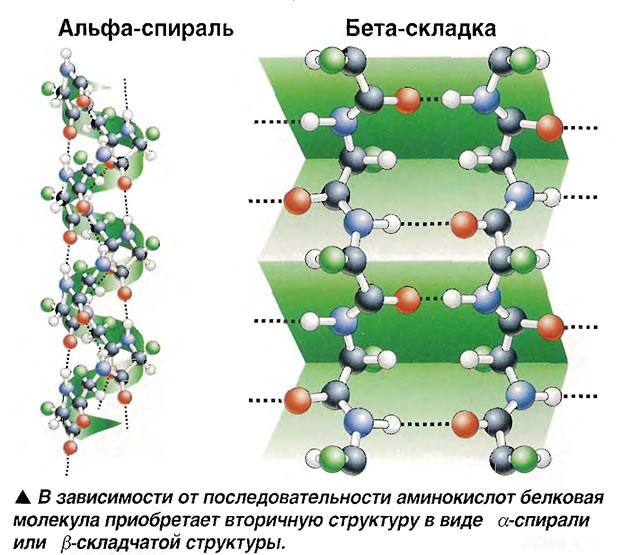
14-расм. Аминокислоталар кетма-кетлигига қараб оқсил молекуласи
α-спираль ёки β-бурма қаватли структурага эга бўлади
Лайнус Полинг в Элайас Кори оқсилларнинг β-бурма қаватли структурага эга бўлишини исботлаганлар. Иккиламчи структуранинг бу варианти ўзининг ясси тузилиши билан фарқ қилади ва полипептид занжирлари ёнма-ён жойланиши натижасида ҳосил бўлади. Водород боғлари параллел ёки антипараллел ҳолда жойлашган полипептид занжирининг пептид боғлари ўртасида ҳосил бўлади (15-расм). Натижада полипептид занжирлари такрорланиб қаватма-қават бўлиб жойлашиб «бурма»ларни ёки ленталарни ҳосил қилади:
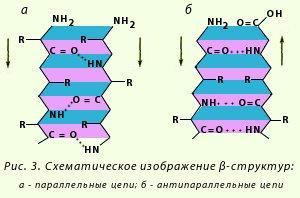
15-расм. β-бурма қаватли структуранинг схематик тасвирланиши: а – параллел занжирлар, б – антипараллел занжирлар
Полипептид занжирнинг α-спиралланишида спиральнинг ҳар бир айланишига 3,6 та аминокислота қолдиғи тўғри келади. Спираль қисмининг тўлиқ такрорланиши 18 та аминокислота қолдиғидан кейин рўй беради. Уларнинг узунлиги 0,5 нм ва 2,7 нм га тенг ва ҳар бир аминокислота қолдиғига тўғри келадиган масофа 0,15 нм га тенг.
Оқсиллар α-структурадан β-структурага ўтиши мумкин ва у ҳолда водород боғлари қайта тузилади. Бу ҳолат сочдаги кератин оқсилида кўзатилган. Сочлар ишқорий эритмалар билан ювилганда оқсилнинг спираль структураси бузилади. β-кератин α-кератинга айланади. Оқсилнинг иккиламчи структураси (α-спираль ва β-структура) киздириш натижасида бузилади бунда полипептидлар ўртасидаги водород боғлари узилади, полипептид занжири эса тартибсиз ҳолатга келади.
Кератинларда
пептид занжирининг бир қисми ўнгга
буралган α-спиральдан иборат. Иккита
пептид занжири ягона чапга буралган
α-спиральни ташкил этади. Кератиннинг
суперспиралланган димерлари тетрамерларга
бирлашади, улар эса ўз навбатида диаметри
3 нм бўлган протофибриллаларгача
агрегатланади. Ва, ниҳоят, саккизта
протофибрилла диаметри 10 нм бўлган
микрофибриллани ташкил этади (16-расм).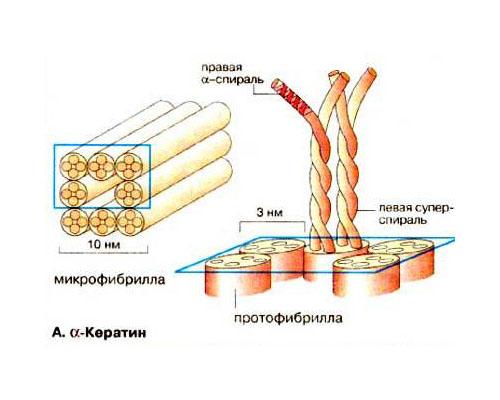
16-расм. α-Кератиннинг тузилиши
Шундай қилиб, оқсилларнинг иккиламчи структураси – полипептид занжири алоҳида қисмларининг фазода тартибли жойлашиши, яъни конформациясидир. Оқсилларнинг иккиламчи структурасининг турғунлиги полипептид ва водород боғлари ёрдамида таъминланади. Бундан бошқа боғлар (дисульфид боғидан ташқари) иштирок этмайди. Кўпчилик оқсилларда бир вақтда α-спираль ва β-структура қисмлари бўлади. Полипептид занжирининг баъзи қисмлари тартибли тузилишга эга бўлмаслиги мумкин, бундай қисмларга аморф ёки структурасиз қисмлар дейилади. Иккиламчи структуранинг у ёки бу кўринишда бўлиши бирламчи структура билан белгиланади ва берилган биологик шароитларда термодинамик жиҳатдан энг қулай (фойдали) бўлгани учун мавжуд бўла олади.
Аминокислота қолдиқларининг қутбсиз радикаллари спиральнинг бир тарафида гуруҳланган бўлади, бу ўз навбатида қутбсиз ёйларнинг ҳосил бўлишига ва спиральнинг турли қисмларининг бир-бирига яқинлашишига олиб келади.
Табиий оқсилларда фақат ўнгга буралган α-спираллар мавжуд, бу уларнинг таркибида фақат L-аминокислоталарнинг қолдиқлари борлигининг натижасидир.
α-Спираль структурасида барча водород боғлар спираль ўкига таҳминан параллел жойлашган. α-Спираль ҳосил бўлишига глу, ала, лей аминокислоталари ёрдам беради. Оқсилларда спираллашган участкаларнинг нисбий қисми ҳар хил. Масалан, миоглобиннинг (17-расм) полипептид занжирлари 80% га спираллашган, инсулинда спираль қисм 50% ни ташкил этади, химотрипсинда эса спираль қисм умуман йўқ.
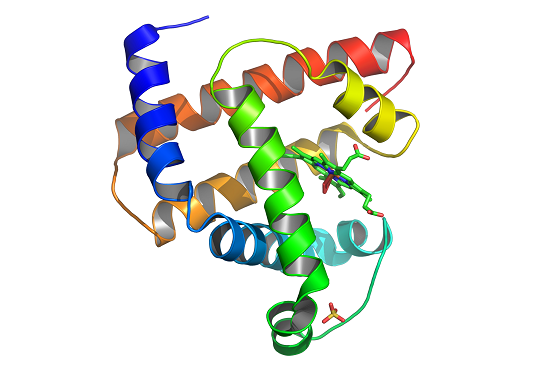
17-расм. Миоглобин модели
Бурма қаватли структуралар (β-структура) 6 ва ундан кам қаватлардан иборат бўлади. Бурма қаватдаги полипептид занжирининг қисмлари бир хил векторга (йўналганликка) эга бўлиши мумкин - параллель β-қават, ёки карама-қарши векторланган бўлиши ҳам мумкин - антипараллель β-қават. Бунда аминокислоталарнинг радикаллари қаватларнинг текислигига перпендикуляр жойлашган бўлади. β-структуранинг шаклланишига мет, вал, гли, про аминокислоталари ёрдам беради.
β-Бурилиш – полипептид занжирининг 180°га бурилиши – аминокислоталар ўртасидаги водород боғлари ҳосил бўлиши натижасида келиб чиқади (18-расм). Глобуляр оқсиллар компакт шарсимон конформацияга эга бўлишининг сабаби ҳам полипептид занжирининг жуда кўп β-бурилиш ясашининг оқибатидир. β-Бурилиш ҳосил бўлиши пролин қолдиқлари кўп бўлганда кузатилади.
18-расм.
β-Бурилиш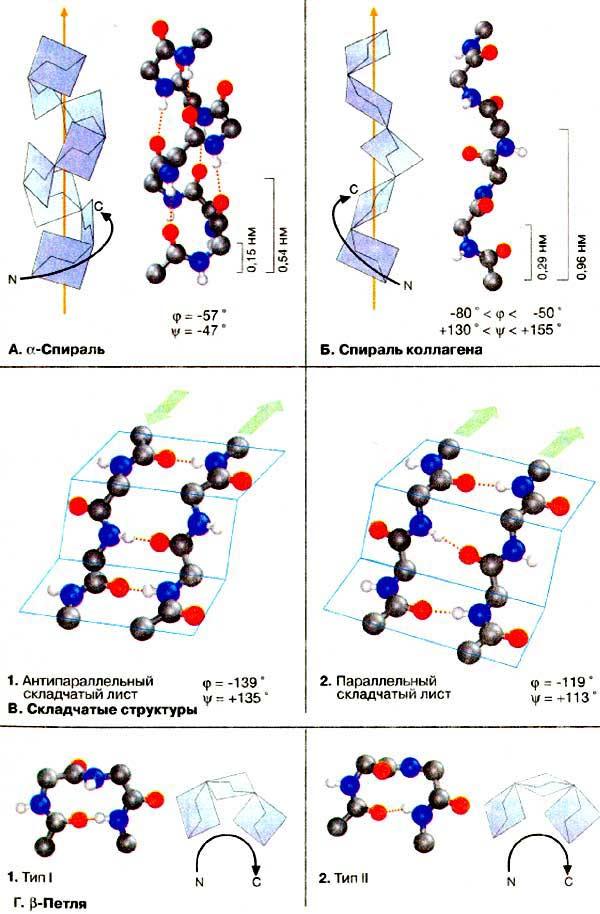
Коллаген оқсили – бирлаштирувчи тўқималарнинг энг муҳим оқсили -ҳам спираль тузилишга эга, фақат унинг спирали чапга буралган (19-расм). Унинг спираль ўрами 0,96 нм га тенг, ҳар бир ўрам, 3,3 та аминокислота қолдиғига тўғри келади, α-спиральга нисбатан «қия» тузилган. α-Спиральдан фарқли равишда бу структурада водород кўприкларининг ҳосил бўлиши мумкин эмас. Учта пептид занжирларининг ўралиб ўнгга буралган спираль ҳосил қилиши билан барқарорлашган молекула.
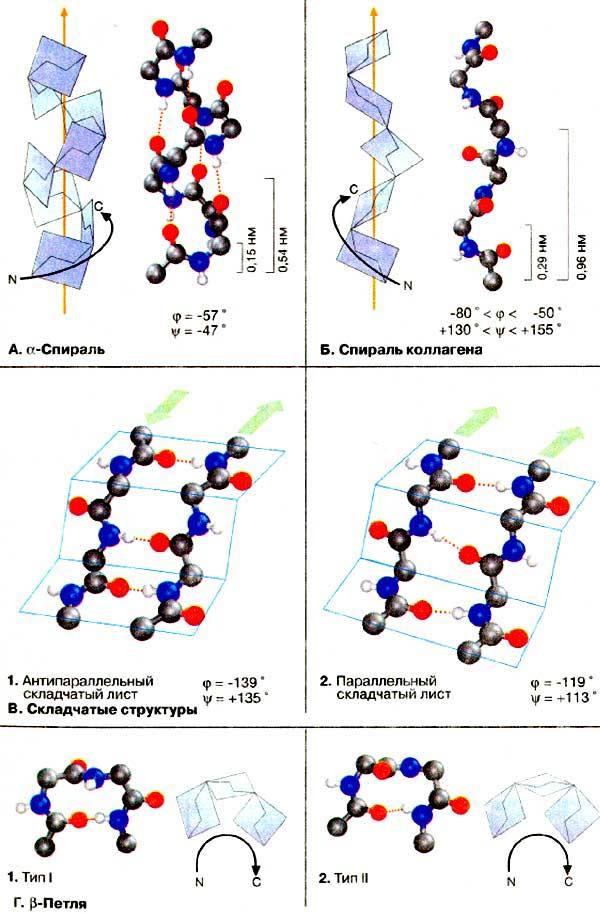
α-спираль β-спираль
19-расм. Коллаген молекуласининг спираль тузилиши
-
Оқсилларнинг учламчи структураси – полипептид занжирининг фазовий тузилиши билан белгиланади. Бу структуранинг барқарор бўлишида водород боғлардан ташқари ковалент ва ион боғлар, гидрофоб ўзаро таъсирлар ҳам иштирок этади. Оқсилларнинг учламчи структураси - спираль кўринишидаги полипептид занжирининг фазода глобуляр (шарсимон) ёки фибрилляр (ипсимон) структура ҳосил қилиши билан белгиланади.
Оксилларнинг учламчи структураси деганда маълум ҳажмда полипептид спиралининг фазовий ориентациясини ёки полипептид занжирининг жойлашиш (укладка) усулини тушуниш керак. Бирламчи структура ҳам, полипептид занжирларининг турлари ҳам, спирал ва чизиқли участкаларнинг ўзаро нисбати ҳам молекуланинг фазовий тузилиши ҳақида, «ҳажми» ҳақида тасаввур бера олмайди. Шунинг учун тадқиқотчи олдида ҳар доим оқсилнинг учламчи (уч ўлчовли) ёки фазовий конфигурациясини аниқлаш вазифаси туради. Бу вазифаларни ечишда юқори самарали рентгеноструктура анализи асосий рольни ўйнаган. Бу усул оқсиллар кимёсидаги 2 та асосий муаммонинг ечимини беради: полипептид занжиридаги аминокислоталар қолдиқларининг кетма-кетлигидаги қонуниятлар ва оқсил молекуласининг қонуниятли конфигурацияси. Органик моддаларда атомлар орасидаги масофа 0,1-0,2 нм ни ташкил этади, замонавий анализаторларнинг ҳал қилиш қобилияти эса 0,2 нм га тенг. Шунинг учун, ҳар бир атомнинг ўрнини аниқ айтиш мумкин эмас, лекин, атомларнинг алоҳида гуруҳларининг ўрнини аниқласа бўлади, айниқса оқсил молекуласи таркибига оғир металларнинг атомлари киритилганда.
Глобуляр
оқсилларнинг учламчи структурасини
ўрганишдаги дастлабки муваффақиятлар
50-йилларда Джон Кендрью (Англия) тарафидан
миоглобин оқсилининг тузилишини
рентгенструктуравий тадқиқ этиш
натижасида олинган, 20-расм: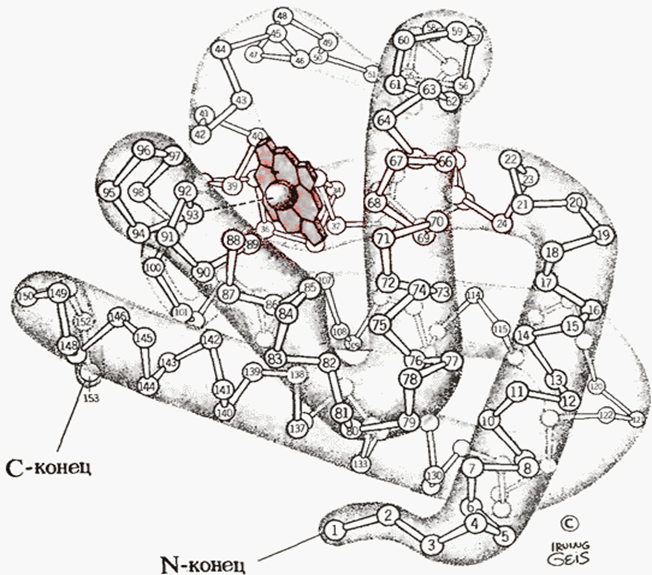
20-расм. Миоглобин молекуласи учламчи структурасининг модели (Дж. Кендрью)
Учламчи структура полипептид занжирининг тартибли ва аморф соҳаларининг жойлашишини характерлайди, яъни оқсил молекуласининг фазовий жойлашиши - конформациясини тасвирлаб беради, агар у 1 та полипептид занжиридан иборат бўлса.
Глобуляр оқсиллар полипептид занжирининг компакт укладкаси билан характерланади. Бунда аминокислота қолдиқларининг сувга мойиллиги бўлмаган қутбсиз радикаллари асосан глобула ичида жойлашади ва оқсил глобуласининг марказида бир ёки бир нечта гидрофоб соҳаларни (ядроларни) шакллантиради. Кўпчилик қутбли радикаллар глобула юзасида гидратланган ҳолда жойлашади ва сувли атрофга бурилган бўлади. Глобула юзасида кам миқдорда қутбсиз радикаллар ҳам жойлаша олади, ва улар тўпланиб гидрофоб кластерларни ёки «ёпишқоқ» зоналарни ҳосил қилади. Шундай қилиб, оқсил глобуласининг юзаси мозаикасимон – асосан гидрофиль, аммо, қутбсиз соҳаларга ҳам эгадир.
Оқсилларнинг учламчи структурасини қуйидаги тур боғлар барқарорлаштиради, 21-расм:
1. Ковалент боғлар (дисульфид боғлар)
2. Ковалент бўлмаган боғлар
а) гидрофоб боғлар
б) водород боғлар
в)
ион боғлар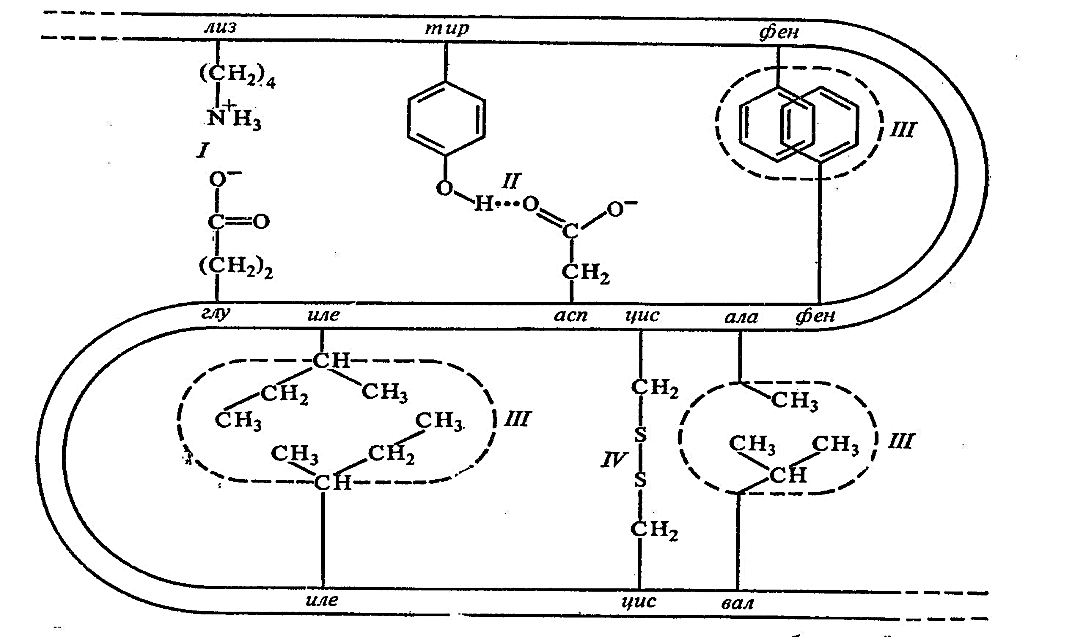
21-расм. Оқсилларнинг учламчи структурасини барқарорлаштирувчи боғлар:
I – ионли боғ, II - водород боғ, III- гидрофоб боғлар, IV- дисульфид боғлар
Оқсилларнинг натив (табиий) конформацияси энергетик жиҳатдан фойдали ҳолатдир. Учламчи структура бирламчи структура билан белгиланади, ва демак, генетик жиҳатдан ҳам белгиланган деб хулоса қилса бўлади.
-
Оқсилларнинг тўртламчи структураси – бир нечта полипептид занжирларининг бир-бирига нисбатан ўзаро жойлашиши билан белгиланади.
Тўртламчи структура икки ёки ундан ортиқ, бир-биридан мустақил равишда синтезланган полипептид занжирларининг ўзаро ориентациясини тасвирлайди.
Тўртламчи структурага эга бўлган оқсиллар – олигомерлар деб аталади, уларни ташкил этувчи полипептид занжирлари эса протомерлар ёки суббирликлар дейилади. Суббирликлар бир хил ёки ҳар хил бўлиши мумкин. Уларни ҳарфлар билан белгилаш қабул қилинган, кўпинча олигомерлар таркибига жуфт сондаги суббирликлар киради. Тўртламчи структура уни ташкил этувчи суббирликларнинг бирламчи, иккиламчи ва учламчи структураларига боғлиқ. Тўртламчи структуранинг шаклланиши ферментлар иштирокисиз мустақил ўз -ўзини йиғиш (самосборка) типида амалга ошади.
Тўртламчи структура суббирликлар юзасида жойлашган гидрофоб, «ёпишқоқ» зоналар борлиги туфайли, асосан гидрофоб боғлар ёрдамида барқарорлашган бўлади. Тўртламчи структурали оқсилларга гемоглобин (4 та суббирлик), иммуноглобулинлар (4 та суббирлик – 2 та оғир ва 2 та енгил), миозин (6 та суббирлик – 2 та оғир, 4 та енгил) кабилар киради. Тўртламчи структурали ферментлар алоҳида регулятор функцияни бажарадилар.
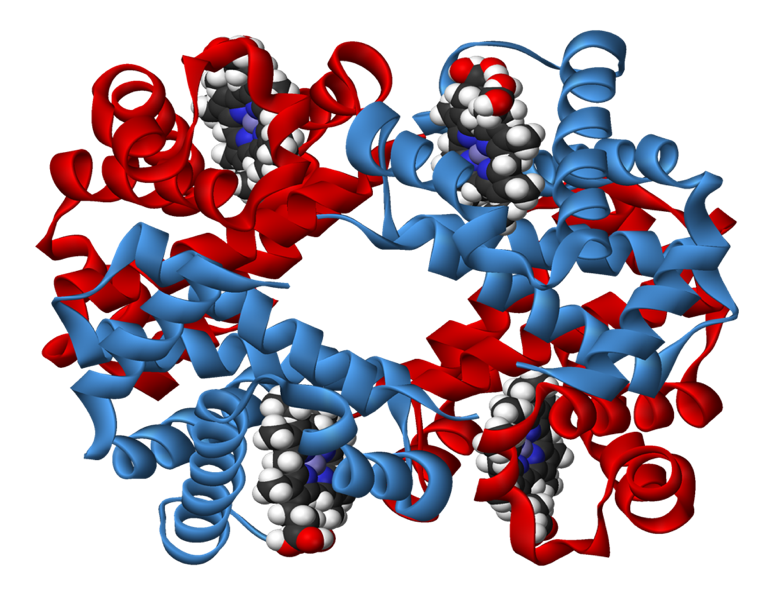
22-расм. Гемоглобин молекуласининг модели
Ҳужайра таркибида кўп сондаги турли олигомер оқсилларнинг мавжудлиги ундаги осмотик босимни ва қовушқоқликни пасайтиради. Олигомер оқсиллар турли эффекторлар тарафидан яхши бошқарилади. Оқсилларнинг олигомер тузилишининг биологик мазмуни уларни кодлашда генетик материалнинг камроқ сарф бўлиши билан ҳам боғлиқ, агар улардаги баъзи суббирликлар бир хил бўлса. Олигомер оқсилларда дефектли молекулаларнинг ҳосил бўлиш эҳтимоли ҳам камроқдир.
Тўртламчи структурага эга бўлган оқсиллардан энг кўп ўрганилгани – гемоглобин (22-расм). Гемоглобин 2 та α-суббирлик (141 та аминокислота қолдиғи) ва 2 та β-суббирликдан (146 та аминокислота қолдиғи) иборат. Ҳар бир суббирлик ўзида темир сақлаган гем молекуласи билан боғланган.
Мавзуни қайтариш учун саволлар
-
Оқсилларнинг бирламчи структурасига таъриф беринг.
-
Оқсил молекуласининг бирламчи структурасини қандай ҳолда ёзиш қабул қилинган?
-
Оқсилларнинг бирламчи структураси генетик белгилангандир, деган тасдиқ нимани билдиради?
-
Оқсилларнинг иккиламчи структурасини қайси факторлар белгилайди?
-
Полипептид занжирининг альфа-спираль ёки β-структурани ҳосил қилишига оқсилларнинг қайси структураси жавоб беради?
-
Полипептид молекуласининг фазодаги конфигурациясини (жойлашувини) оқсилларнинг қайси структураси белгилайди?
-
Оқсил молекуласининг иккиламчи структураси ҳосил бўлишида қайси гуруҳлар ўртасида водород боғларининг ҳосил бўлиши аҳамиятли?
-
Оқсиллар қандай иккиламчи структураларни намоён қила олади?
-
Оқсилларнинг β-бурма қаватли структурага эга бўлишини қайси олимлар исботлаган?
-
Оқсилларнинг иккиламчи структурасининг турғунлигини қайси кимёвий боғлар таъминлайди?
-
Табиий оқсилларда фақат ўнгга буралган α-спиралларнинг мавжудлиги ниманинг натижасидир?
-
α-Спираль ҳосил бўлишига қайси аминокислоталари ёрдам беради?
-
β-структуранинг шаклланишига қайси аминокислоталари ёрдам беради.
-
Оқсилларнинг учламчи структурасини қайси тур боғлар барқарорлаштиради?
-
Оқсилларнинг тўртламчи структурасига таъриф беринг.
