
- •Аминокислоталар, пептидлар, оқсиллар
- •Оқсилларнинг аминокислота таркибини аниқлаш
- •Оқсилларнинг тузилиши
- •Оқсил ва пептидларнинг кимёвий синтези
- •Оқсиллар ва пептидларнинг кимёвий модификацияси
- •40000 Марта катталаштирилган
- •Ферментлар
- •Ферментларнинг каталитик фаоллиги сабаблари
- •Ҳимоя оқсиллари
- •2. Антитаналарнинг изотиплари. Улар константа қисмининг типи орқали аниқланади. Баъзи изотиплар бириктирувчи занжир ёрдамида димерларни (IgA), ёки пентамерларни (IgM) ҳосил қилади.
- •Иммун жавоб медиаторлари - цитокинлар
- •Яллиғланиш медиаторларининг классификацияси
- •Тўқима лизокиназалари, стрептокиназа
- •Плазминоген (фибринолизиноген, профибринолизин)
- •Оқсил ва пептид гормонлар
- •Оқсил ва пептид гормонлар биосинтези
- •Нейропептидлар
- •Қилувчи гипоталамус гормонлари
- •Гастроинтестинал пептид-гормонлар ва уларнинг биологик функциялари
- •Пептид токсинлар
- •Предмет кўрсаткичи
- •Номлар кўрсаткичи
- •Фойдаланилган адабиётлар
- •Интернет ресурслари
- •Мундарижа
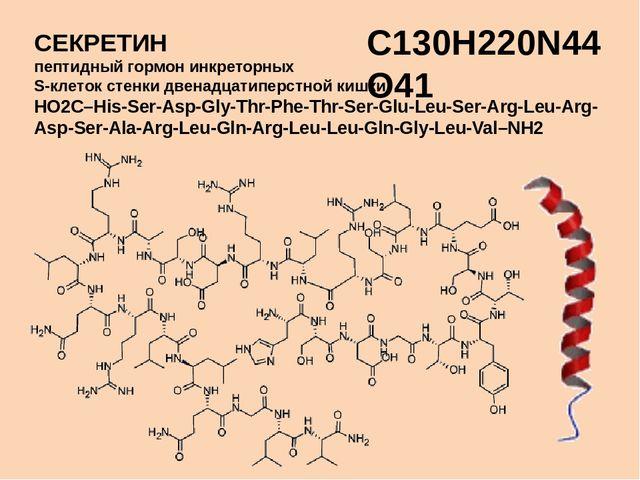
Гастроинтестинал пептид-гормонлар ва уларнинг биологик функциялари
Гастроинтестинал пептид-гормонлар, гастроэнтеропанкреатик эндокрин система, глюкагон, гастрин, секретин, бомбезин, мотилин, глюкагонга ўхшаш пептид 1, грелин, кальцитонин.
1. Гастроинтестинал пептид-гормонлар (gaster – ошқозон, intestinum – ичаклар) – умуртқалиларнинг ошқозон-ичак трактининг шиллиқ қатламида ишлаб чиқариладиган пептид табиатли гормонлар, улар 17 – 43та аминокислота қолдиқларидан тузилгандир.
Гастроэнтеропанкреатик эндокрин система – овқат ҳазм қилиш системасининг турли органларида тарқоқ жойлашган эндокрин ҳужайраларидан ва пептид гормонларни ишлаб чиқарувчи пептидергик нейронлардан иборат бўлган эндокрин системанинг бўлимидир. Гастроэнтеропанкреатик эндокрин система – диффуз эндокрин системанинг энг яхши ўрганилган қисми бўлиб, унинг ҳужайраларининг тахминан ярмини ўз ичига олади. Шунинг учун гастроэнтеропанкреатик эндокрин системани «одам организмидаги энг катта ва мураккаб эндокрин орган» деб ҳисоблаш қабул қилинган. Бу система ишлаб чиқарадиган пептид гормонларга гастроинтестинал гормонлар дейилади.
Гастроинтестинал гормонлар ошқозон-ичак трактининг яллиқ қаватида ишлаб чиқарилади ва қонга сўрилади. Улар ошқозон ва ичакларнинг секретор фаолиятида иштирок этади, ичакларнинг ва қон томирларининг силлиқ мушакларининг тонусига таъсир қилади, ошқозон-ичак трактининг моторикасини бошқаради ва бошқа физиологик функцияларни бажаради.
Гастроинтестинал гормонлар 17 – 43 та аминокислота қолдиқларидан тузилган петидлардир. Уларнинг қаторига хлорид кислотасини ишлаб чиқарилишини стимулловчи пептид-гормон гастрин, ошқозон ширасининг ажралиб чиқишини стимулловчи секретин, ошқозон ва ичакларнинг ҳаракат активлигини кучайтирувчи, пепсиннинг ажралиб чиқишини назорат қилувчи мотилин, ошқозон ости бези овқат ҳазм қилдирувчи ферментларининг секрецияланишига ёрдам берувчи холецистокинин, биологик активлиги бўйича холецистокининга ўхшаш бўлган бомбезин гормонлари киритилган.
Бундан ташқари, ошқозон-ичак трактида қон томирларини кенгайтирувчи ва ошқозон ости бези тарафидан сув ва электролитларнинг секрецияланишини, ўт (желчь) секрецияланишини кучайтирувчи вазоактив интестинал полипептид (ВИП); ошқозонда кислота ишлаб чиқарилишини бостирувчи гастроингибирловчи полипептид (ГИП); проглюкагондан унинг протеолизи натижасида ҳосил бўлувчи, инсулиннинг физиологик антагонисти – глюкагонга ўхшаш пептид 1 (глюкагоноподобный пептид 1, ГПП1) ишлаб чиқарилади.
ГПП1 ҳам, ошқозон ҳужайралари ишлаб чиқарадиган YY пептидга ўхшаб, гипоталамус нейронларидаги тегишли рецепторларга таъсир этиб иштаҳанинг пасайишига олиб келади ва шу билан семизликнинг олдини олади. Бундан ташқари, ГПП1 ошқозон ости бези тарафидан инсулиннинг секрецияланишини стимуллайди ва шу билан углеводлар алмашинувини бошқаради, YY пептид эса инсулин таъсирининг эффективлигини оширади, ёши катта одамларда қандли диабет келиб чиқишининг олдини олади.
Гастроинтестинал гормонлардан бўлган грелин, гипофизда ўзининг рецепторлари билан боғлангандан сўнг, ўсиш гормони – соматотропин, пролактин ва адренокортикотроп гормонлар секрециясини стимуллайди. ГПП1 ва YY пептиддан фарқли равишда грелин иштаҳанинг очилишига ёрдам берувчи фактор.
Гастринтестинал гормонлар кимёвий структурасининг ўхшашлиги бўйича группаларни ташкил қилади, масалан, секретин, глюкагон, ВИП, ГИП каби. Бу уларнинг эволюция давомида битта умумий ўтмишдошдан келиб чиққанлигини кўрсатади. Бундан ташқари, бундай гастроинтестинал гормонлар нафақат ошқозон-ичак тракти эндокрин ҳужайралари тарафидан, балки, бошқа орган ва тўкималарнинг ҳужайралари тарафидан ҳам синтезланади, масалан марказий ва периферик асаб системаси ҳужайраларида холецистокинин, ВИП, гастрин ва бомбезин пептидлари ишлаб чиқарилади. Ичакларнинг турли қисмларида синтезланадиган соматостатин эса гипоталамусда ҳам ишлаб чиқарилиб, гипофиз тарафидан ўсиш гормони соматотропиннинг ҳосил бўлишини тормозлашда иштирок этади. Ўз навбатида марказий асаб системасининг баъзи нейрорегуляторлари ошқозон-ичак трактида ҳам топилган, масалан «Р» моддаси, энкефалинлар, тиреолиберинлар ва бошқалар.
-
Глюкагон - ошқозон ости бези Лангерганс оролчаларининг альфа-ҳужайраларининг гормони. Кимёвий тузилиши бўйича пептид гормон. Унинг молекуласи 29 та аминокислота қолдиғидан иборат, ММ 3485 Да.
Глюкагон 1923-йилда Кимбелл ва Мерлин тарафидан очилган. Унинг бирламчи тузилиши қуйидагича:
NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-COOH
111-расм. Глюкагон молекуласининг бирламчи структураси
Глюкагон таъсирининг механизми унинг жигардаги глюкагон учун специфик бўлган рецепторлар билан боғланишидан келиб чиқади. Бундай боғланиш G-оқсиллар орқали аденилатциклаза активлигининг ортишига ва цАМФ ҳосил бўлишига олиб келади. Натижада жигарда тўпланган гликогеннинг катаболизми (гликогенолиз) кучаяди. Глюкагон, гепатоцитлар учун гликогеннинг парчаланиши ҳисобига қонга глюкоза чиқариш кераклиги, ёки бошқа моддалардан глюкоза синтез қилиниши (гюконеогенез) кераклиги ҳақида ташқи сигналдир. Шундай қилиб, глюкагон жигарда гликогеннинг парчаланишини стимуллаш натижасида қонда глюкоза миқдорини бир хил ушлаб туришга ёрдам беради. Глюкагон шунингдек жигарда глюконеогенез, липолиз ва кетогенез жараёнларини активлаштиради.
Глюкагон скелет мушакларининг гликогенига деярли таъсир ўтказмайди, бунга сабаб уларда глюкагон рецепторларининг йўқлигидир. Глюкагон ошқозон ости бези соғлом β-ҳужайраларидан инсулиннинг секрецияси ортишини келтириб чиқаради ва инсулиназа активлигининг тормозланишига олиб келади. Бу глюкагон туфайли вужудга келувчи гипергликемияга қарши физиологик механизмлардан биридир.
Одам ва ҳайвонлар глюкагонининг бирламчи структураси идентик бўлиб чикди, фақат курка глюкагонида 28 ҳолатда аспарагин ўрнида серин жойлашган. Глюкагон тузилишининг ўзига хослиги – унинг молекуласида дисульфид боғларининг йўқлигидир. Глюкагон С-охирида қўшимча октапептид тутган ўзининг ўтмишдоши - проглюкагондан ҳосил бўлади. Проглюкагоннинг ҳам проинсулинга ўхшаш, ўтмишдоши бор – препроглюкагон, ММ 9000 Да, лекин, унинг структураси ҳозирча ўрганилмаган.
Биологик таъсирига кўра глюкагон, адреналин каби, гипергликемик факторлар қаторига киритилади, у қонда глюкоза миқдорини жигарда гликоген парчаланиши ҳисобига кўпайтиради.
-
Гастрин – хлорид кислотасини ишлаб чиқарилишини стимулловчи пептид. Гастриннинг 3 та асосий табиий шакли мавжуд: «катта гастрин» ёки гастрин-34 – 34 та аминокислота қолдиғидан тузилган пептид; «кичик гастрин» ёки гастрин-17 – 17 та аминокислота қолдиғидан тузилган пептид; ва «мини-гастрин» ёки гастрин-13 – 13 та аминокислота қолдиғидан тузилган пептид. Кимёвий тузилиши бўйича бу гастринлар бир-бирига гомологик. Улар молекуласининг махсус рецепторлар билан боғланувчи актив қисми 5 та аминокислотадан иборат қисмдир. Гастринларнинг синтетик аналоги бўлган пентагастрин айнан мана шу 5 та аминокислотадан тузилган. Гастрин-17 гастрин-34 нинг С-охири фрагментини ташкил этади. Минигастрин гастрин-17 молекуласининг 5-17 аминокислоталарни ўз ичига олган фрагменти билан мос.
Гастрин-34 ошқозон ости безида ишлаб чиқарилади, гастрин-17 ва гастрин-14 асосан ошқозоннинг ўзида синтезланади. Гастрин молекулалари чизиқли тузилишга эга. Турли организмлар гастринлари орасидаги фарқ 5-, 8- ва 10-ҳолатдаги аминокислоталарда бўлади. Молекуласи таркибида 5 та глутамин кислотаси қолдиғи (Glu) бўлгани учун гастрин кучли кислота хоссаларига эга. Гастрин 12-ҳолатдаги сульфогруппаси бўлмаганида ҳам мавжуд бўла олади. Гастриннинг тўлиқ биологик активлигини унинг 6-17 аминокислоталарни ўз ичига олган фрагменти сақлаб туради.
![]()
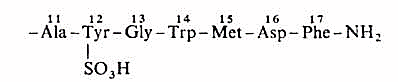
Одам гастринининг бирламчи структураси – гастрин-17

Гастрин-34 молекуласининг тузилиши
-
Секретин - ошқозон ширасининг ажралиб чиқишини стимулловчи пептид гормон. Одам ва ҳайвонлар организмидаги секретин 27 та аминокислота қолдиғидан иборат ва бирламчи структураси бўйича озроқ фарқ қилади.

Одам секретинининг бирламчи структураси
Кимёвий структураси бўйича секретин ошқозон ости бези гормони глюкагон билан ўхшаш, лекин, унга ўхшаб қондаги глюкозанинг миқдорига таъсир ўтказмайди. Секретинни, ошқозондан ичакка тушаётган хлорид кислотаси таъсирида, ингичка ичак юқори қисмининг яллиқ қавати ҳужайралари ишлаб чиқаради. Секретин 12 бармоқли ичакда рН~4,5 да тўлиқ ажралиб чиқади, ва рН қийматининг пасайиши давомида унинг ажралиб чиқиши ортаверади.
112-расм. Секретин молекуласининг тузилиши
-
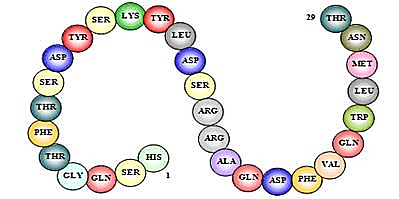
Мотилин - ошқозон ва ичакларнинг ҳаракат активлигини кучайтирувчи, пепсиннинг ажралиб чиқишини назорат қилувчи пептид-гормон. Мотилинни ингичка ичакнинг эпителиал қавати эндокрин М-ҳужайралари ишлаб чиқаради. Унинг таркибида 22 та аминокислота колдиғи бор. Секретинни тозалаш вақтида Браун (J.C. Brown) тарафидан биринчи бор аниқланган (1973). Мотилин асосан ошқозон-ичак трактининг моторикасига таъсир этади – пастки сфинктернинг тонусига таъсир этади, ошқозоннинг ва йўғон ичакнинг бўшалишини стимуллайди. Бундан ташқари, мотилин ошқозон ости бези тарафидан инсулин ва соматостатин ишлаб чиқарилишини ҳам стимуллайди. Унинг ўтмишдоши – препромотилин.
Мотилиннинг молекуляр массаси 2698 Да. Унинг бирламчи структураси қуйидагича:
Phe-Val-Pro-Ile-Phe-Thr-Tyr-Gly-Glu-Leu-Gln-Arg-Met-Gln-Glu-Lys-Glu-Arg-Asn-Lys-Gly-Gln
Мотилиннинг ЯМР-спектроскопияси натижасида унинг молекуласи Glu9 ва Lys20 оралиғида α-спираль, N-охири эса β-бурма қават тузилишга эга эканлиги аниқланган (113-расм).
Мотилин молекуласининг тузилиши
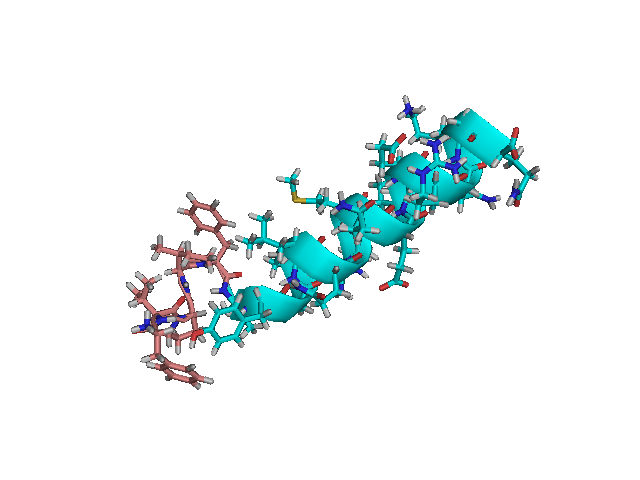
113-расм. Мотилиннинг учламчи структураси
Мотилин ва грелиннинг ўтмишдошлари аминокислота кетма-кетликлари тахминан 50% бир-бирига ўхшаш, улар асосида синтезланган етилган гормон молекулалар эса аминокислота кетма-кетлиги бўйича 36% га бир-бирига мосдир. Шунинг учун мотилин ва грелин бир оила – мотилин оиласига бирлаштирилган.
-
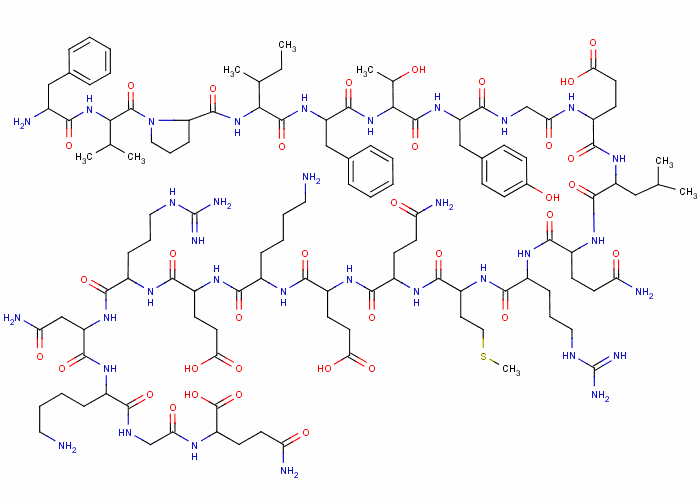
Холецистокинин - ошқозон ости бези овқат ҳазм қилдирувчи ферментларининг секрецияланишига ёрдам берувчи нейропептид-гормон. Холецистокининни ўн икки бармоқли ичак яллиқ қаватининг I-ҳужайралари ва ингичка ичакнинг проксимал қисми ишлаб чиқаради. Ингичка ичакнинг яллиқ қаватида холецистокининнинг аминокислоталар кетма-кетлиги бўйича фарқланадиган 3 та молекуляр шакли аниқланган - холецистокинин-8, холецистокинин-12 и холецистокинин-33. Буларнинг орасида холецистокинин-8 миқдор бўйича 60-70% ни ташкил этади. Булардан ташқари қатор холецистокининлар ҳам аниқланганки, улар холецистокинин-58 (CCK58), холецистокинин-58-дезнонопептид (1-49-CCK58), холецистокинин-З9 (CCK39), холецистокинин-25 (CCK25), холецистокинин-18 (CCK18), холецистокинин-7 (CCK7), холецистокинин-5 (CCK5), CCK-4 каби молекулалардан иборат.
Холецистокинин-33 молекуласидаги аминокислоталар кетма-кетлиги қуйидагича:
H-Lys-Ala-Pro-Ser-Gly-Arg-Val-Ser-Met-lle-Lys-Asn-Leu-GIn-Ser-Leu-Asp-Pro-Ser-His-Arg-lle-Ser-Asp-Arg-Asp-Tyr- Met-Gly-Trp-Met-Asp-Phe-OH.

114-расм. Холецистокинин-8 молекуласининг модели
Э.К.Айви ва Е.Олдберг (E. Oldberg) 1928 йилда яллиқ қаватининг экстрактида ўт қопининг қисқаришини чақирувчи ва ўн икки бармоқли ичакка ўт чиқарилишини бошқарувчи пептидни аниқлашди ва уни мана шу хоссаларига кўра «холецистокинин» (юнонча choly — ўт, kуstis — қоп ва kieō — ҳаракатлантириш) деб номлашди. А.А. Харпер (А.А. Harper) ва Х.С. Рапер (H.S. Raper) 1943 йилда ингичка ичакнинг яллиқ қаватидан панкреатик секрецияни стимулловчи пептидни ажратиб олишди ва уни панкреозимин деб номлашди. 1960-йилларда холецистокинин ва панкреозиминнинг битта модда эканлиги аниқланган
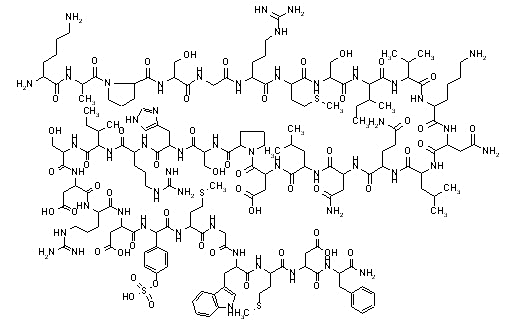
Холецистокинин-33 молекуласининг тузилиши
-
Бомбезин – функциялари бўйича холецистокининга ўхшаш, 14 та аминокислота қолдиғидан тузилган пептид-гормон. Биринчи бор бомбезин Bombina турига мансуб қорни катта бақанинг терисидан ажратиб олинган, номи шундан келиб чиқади. Сут эмизувчиларда унинг иккита гомологи мавжуд бўлиб, нейромедин-В ва гастринни-ажратувчи пептид дейилади. Бомбезин G-ҳужайралардан гастриннинг ажралишини стимуллайди. Бомбезиннинг бирламчи тузилиши қуйидагича:
Glp-Gln-Arg-Leu-Gly-Asn-Gln-Trp-Ala-Val-Gly-His-Leu-Met-NH2
Бомбезин гипоталамус-гипофиз-буйрак усти безлари ўқини кучли активлаштирувчи фактор ҳисобланади, организмнинг стресс-реакциясини бошқаришда иштирок этади, хотирада сақлаб қолиш жараёнларига таъсир этади. Бундан ташқари, бомбезин организмга алкогольни (этанолни) қабул қилишни бошқаради. Унинг физиологик эффектлари – тана ҳароратининг пасайишида, ошқозон-ичак трактидаги секретор жараёнларни бошқаришда намоён бўлади.
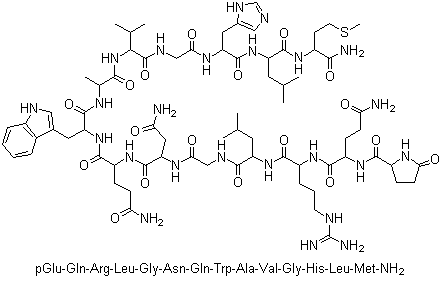
Бомбезин молекуласининг тузилиши
-
Вазоактив интестинал полипептид (ВИП) - ошқозон-ичак трактида қон томирларини кенгайтирувчи ва ошқозон ости бези тарафидан сув ва электролитларнинг секрецияланишини, ўт (желчь) секрецияланишини кучайтирувчи нейропептид-гормон. Вазоактив интестинал полипептид – нейропептид бўлиб, кўп органларда – ичаклар, бош ва орқа мия, ошқозон ости безида аниқланган. Вазоактив интестинал полипептид 28 та аминокислота қолдиғидан тузилган, унинг бирламчи структураси қуйидагича:
H-His-Ser-Asp-Ala-Val-Phe-Thr-Asp-Asn-Tyr-Thr-Arg-Leu-Arg-Lys-GIn-Met-Ala-Val-Lys-Lys-Tyr-Leu-Asn-Ser-lle-Leu-Asn-NH2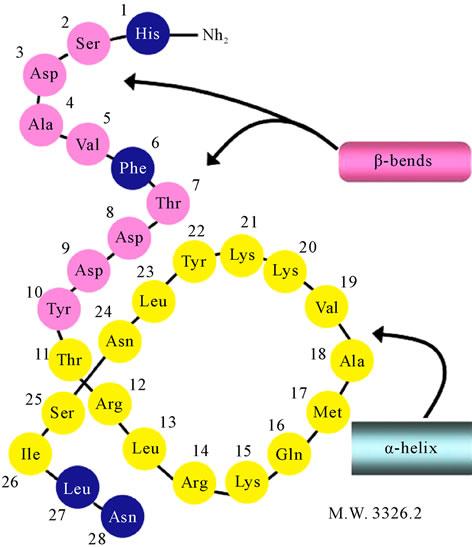
115-расм. Вазоактив интестинал пептиднинг тузилиши
Структураси бўйича ВИП секретинга ва қатор пептид гормонларга масалан, гипофизни активлаштирувчи пептид (РАСАР), глюкозага боғлиқ инсулинотроп гормон, гастроингибирловчи пептид (ГИП), глюкагон, глюкагонга ўхшаш пептид-1, кальцитонин, кальцитонин ген-боғловчи пептид, парат-гормон, кортикотропин-рилизинг фактор, ўсиш гормонининг рилизинг-факторига гомологик тузилган. Шунинг учун, ВИП юқорида келтирилган гормонлар қатори секретин оиласига киритилган.

Вазоактив интестинал пептиднинг 1-12 аминокислота кетма-кетлиги фрагменти
-
Гастроингибирловчи полипептид, глюкозага боғлиқ инсулинотроп гормон – ўн икки бармоқли ичак ва ингичка ичакнинг проксимал қисмидаги К-ҳужайралар ишлаб чиқарадиган пептид-гормон. Ошқозонда кислота ишлаб чиқарилишини бостирувчи пептид.

116-расм. Гастроингибирловчи полипептиднинг тузилиши
Одамнинг глюкозага боғлиқ инсулинотроп гормони 42 та аминокислота кетма-кетлигидан тузилган бўлиб, молекуласининг бир қисми секретин молекуласи билан, иккинчи қисми глюкагон молекуласи билан тузилиши бўйича мос. Унинг бирламчи тузилиши қуйидагича:
H-Tyr-Ala-Glu-Gly-Thr-Phe-lle-Ser-Asp-Tyr-Ser-lle-Ala-Met-Asp-Lys-lle-His-Gla-Glii-Asp-Phe-Val-Asn-Trp-Leu-Leu-Ala-GIn-Lys-Gly-Lys-Lys-Asn-Asp-Trp-Lys-His-Asii-lle-Thr-GiD-OH
-
Глюкагонга ўхшаш пептид-1 (ГПП1) – проглюкагондан, унинг протеолизи натижасида ҳосил бўлувчи пептид, инсулиннинг физиологик антагонисти. Глюкагонга ўхшаш пептид-1нинг ярим парчаланиш даври икки минутдан кам. Одамнинг овқатланишлари орасидаги даврда қон плазмасида ГПП-1 нинг миқдори 5-10 пико-моль бўлса, овқатлангандан сўнг унинг миқдори 50 пико-мольгача ортади. Глюкагонга ўхшаш пептид-1нинг бирламчи структураси қуйидагича:

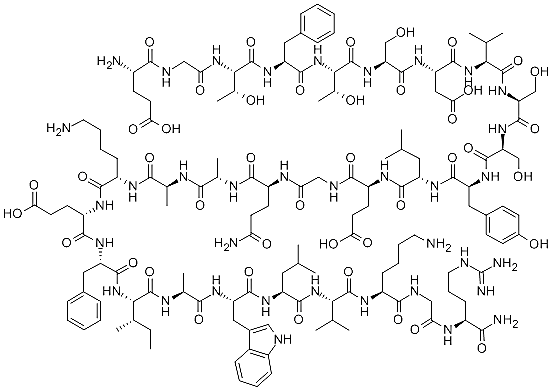
Глюкагонга ўхшаш пептид 1 структураси
-
Грелин – ошқозон-ичак трактида ишлаб чиқариладиган, гонадолибериннинг хоссаларига ўхшаш хоссаларга эга бўлган ва бошқа метаболик ва эндокрин функцияларга эга бўлган пептид-гормон.
Овқатланишдан олдин грелиннинг миқдори ортади, овқатлангандан сўнг эса камаяди. Грелин катта концентрацияларда - ёғ тўқималарида ишлаб чиқариладиган ва «тўқлик, тўйиниш» ҳиссини чақирувчи лептин гормонини ўз функциялари билан тўлдириб туради, деб ҳисоблашади. Грелин 1999 йилда Масаясу Коидзима ва унинг ҳамкасблари тарафидан очилган.
Грелин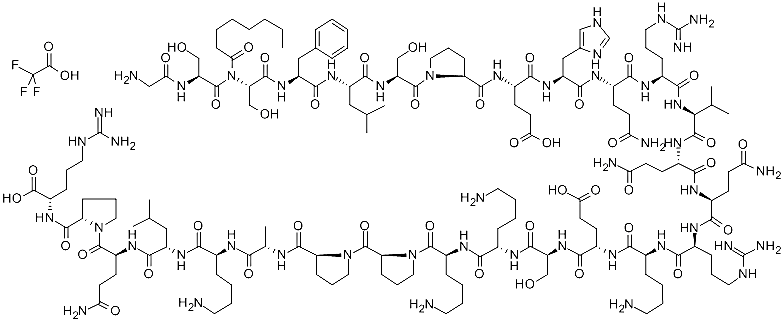

117-расм. Грелиннинг бирламчи структураси ва шар-стержень модели
Грелин ошқозон ости безидаги ўз рецепторига таъсир этиб, глюкоза билан стимулланувчи инсулин секрецияланишини тормозлайди. Грелинни ишлаб чиқарувчи ҳужайралар ўпкада, буйракларда, ошқозон ости безида, ўн икки бармоқли ичакда, ингичка ичакда, гонадаларда ва плацентада мавжуд.
-
Кальцитонин – 32 та аминокислота қолдиғидан иборат пептид гормон, ММ 3,6 кДа. Кальцитонин (тиреокальцитонин) сут эмизувчилар ва одамнинг қалқонсимон безидаги парафолликуляр ҳужайралар ишлаб чиқарадиган гормон. Кўпчилик ҳайвонларда, масалан, балиқларда аналогик функцияларни бажарувчи гормон қалқонсимон безда эмас (ваҳоланки, қалқонсимон без умуртқали ҳайвонларнинг ҳаммасида бор) балки, ультимабранхиал таначаларда ишлаб чиқарилади, шунинг учун унинг номи кальцитонин деб аталган.
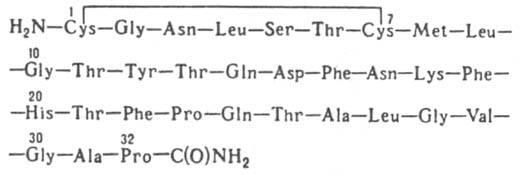
Одам кальцитонинининг бирламчи структураси
Тиреокальцитонин организмда кальций-фосфор аламашинувининг бошқарилишида, остеокласт ва остеобластларнинг балансида иштирок этади, у паратгормоннинг функционал антагонисти ҳисобланади.
Тиреокальцитонин қон плазмасида остеобластлар тарафидан кальций ва фосфатларни бириктириб олиш ҳисобига кальций ва фосфатларнинг миқдорини пасайтиради (паратгормоннинг анатагонисти бўлгани учун). Шунингдек, у остеобластларнинг кўпайишини ва функционал активлигини стимуллайди. Бир вақтнинг ўзида тиреокальцитонин остеокластларнинг кўпайишини ва функционал активлигини, суякларнинг резорбциясини тормозлайди.
Тиреокальцитонин биологик активлигини намоён қилиши учун унинг молекуласи N-охирида, цистеинлар ўртасида кўприк ҳосил бўлишидан вужудга келган, 7 аъзоли кичик ҳалқа билан бирга, молекуласининг ҳаммаси керак. Кальцитонинларнинг аминокислота қолдиқлари кетма-кетлигида турлараро вариабеллик жуда катта. Масалан, одам ва чўчқа кальцитонинлари фақат 14 та умумий аминокислоталарга эга (32 тадан). Аммо, бундай фарқлар бўлишига қарамасдан, улар жуда яхши биологик активликни кўрсата олади. Бир турдан ажратиб олинган кальцитонин иккинчи турга юборилганда активлигини йўқотмайди. Табиий кальцитонинлардан энг активи лосось балиғидан ажратиб олинган.

118-расм. Одам кальцитонинининг структураси

119-расм. Кальцитониннинг иккиламчи тузилиши
Кальцитонин организмда тўғри минерал балансни ушлаб турувчи гормон, бундан ташқари у онкомаркер ролини ҳам ўйнайди. Кальцитонин организмдаги кальций миқдорининг даражасига энг кўп таъсир ўтказади, унинг номи ҳам шундан келиб чиққан. Бу гормоннинг асосий қисми қалқонсимон безда ишлаб чиқарилади, қолган қисми эса ўпка, ошқозон-ичак трактида ва бошқа органларда ишлаб чиқарилади.
Гормон миқдорининг нормадан ортиб кетиши онкологик касалликлар ёки шамоллаш (яллиғланиш) жараёнлари ҳақида хабар беради. Гормон миқдорининг нормадан пасайиб кетиши суяк тўқималаридан кальцийнинг ювилиб чиқиб кетаётгани (остеопороз) ҳақида, қалқонсимон безнинг етарли актив эмаслиги (кретинизм) ҳақида, парақалқонсимон без гормонларининг дефицити (гипопаратиреоз) ҳақида хабар беради.
Мавзуни қайтариш учун саволлар:
-
Кальцитониннинг организмдаги функциялари нимадан иборат?
-
Тиреокальцитонин биологик активлигини намоён қилиши учун унинг тузилишида қандай ўзига хос тараф мавжуд бўлиши керак?
-
Организмда кальцитонин миқдорининг нормадан ортиб кетиши қандай жараёнлар ҳақида хабар беради?
-
Гастроинтестинал гормонлар организмнинг қайси органлари тарафидан ишлаб чиқарилади?
-
Глюкагон гормони таъсирининг механизми нима билан боғлиқ?
-
Глюкагон тузилишининг ўзига хослиги нимада?
-
Одам организмидаги энг катта ва мураккаб «эндокрин орган» деб қабул қилинган система ишлаб чиқарадиган гормонлар қандай аталади?
-
Гастроинтестинал гормонлар қаторига қайси пептид гормонлар киритилган?
-
Гастрин, секретин, мотилин, холецистокинин ва бомбезин пептид гормонларининг функцияси нимадан иборат?
-
Вазоактив интестинал полипептид, гастроингибирловчи полипептид, глюкагонга ўхшаш пептид 1 ларнинг функцияси нимадан иборат?
-
Грелиннинг биологик функцияси нимадан иборат?
-
Хлорид кислотасини ишлаб чиқарилишини стимулловчи пептид гастриннинг 3 та асосий табиий шакли мавжуд, уларни тавсифланг.
-
Турли организмлар гастринлари орасидаги фарқ нимадан иборат?
-
Секретин пептид гормонининг биологик функцияси нимадан иборат?
-
Мотилин пептид гормонининг биологик функцияси нимадан иборат?
-
Холецистокининнинг биологик функцияси нимадан иборат?
-
Ингичка ичакнинг яллиқ қаватида холецистокининнинг 3 та молекуляр шакли аниқланган, уларни тавсифланг.
-
Бомбезиннинг биологик функцияси нимадан иборат?
-
Вазоактив интестинал полипептид гормонининг биологик функцияси нимадан иборат?
-
Гастроингибирловчи полипептиднинг биологик функцияси нимадан иборат?
-
Гастроингибирловчи полипептиднинг тузилишидаги ўзига хослик нимадан иборат?
-
Биологик функцияси бўйича глюкагонга ўхшаш пептид 1 қайси пептид-гормоннинг антагонисти ҳисобланади?
-
Ошқозон-ичак трактида ишлаб чиқариладиган пептид гормонларни санаб ўтинг.
