
- •Аминокислоталар, пептидлар, оқсиллар
- •Оқсилларнинг аминокислота таркибини аниқлаш
- •Оқсилларнинг тузилиши
- •Оқсил ва пептидларнинг кимёвий синтези
- •Оқсиллар ва пептидларнинг кимёвий модификацияси
- •40000 Марта катталаштирилган
- •Ферментлар
- •Ферментларнинг каталитик фаоллиги сабаблари
- •Ҳимоя оқсиллари
- •2. Антитаналарнинг изотиплари. Улар константа қисмининг типи орқали аниқланади. Баъзи изотиплар бириктирувчи занжир ёрдамида димерларни (IgA), ёки пентамерларни (IgM) ҳосил қилади.
- •Иммун жавоб медиаторлари - цитокинлар
- •Яллиғланиш медиаторларининг классификацияси
- •Тўқима лизокиназалари, стрептокиназа
- •Плазминоген (фибринолизиноген, профибринолизин)
- •Оқсил ва пептид гормонлар
- •Оқсил ва пептид гормонлар биосинтези
- •Нейропептидлар
- •Қилувчи гипоталамус гормонлари
- •Гастроинтестинал пептид-гормонлар ва уларнинг биологик функциялари
- •Пептид токсинлар
- •Предмет кўрсаткичи
- •Номлар кўрсаткичи
- •Фойдаланилган адабиётлар
- •Интернет ресурслари
- •Мундарижа
Оқсилларнинг аминокислота таркибини аниқлаш
Оқсилларнинг аминокислота таркибини аниқлаш, оқсилларда N- ва C- охирги аминокислота қолдиғини аниқлаш, Эдман усули, ферментатив усуллар, дисульфид боғларининг ўрнини аниқлаш.
-
Оқсилларнинг аминокислота таркибини аниқлаш. Аминокислоталарни ажратиб олиш усуллари. Аминокислоталарни ажратиб олиш ва анализ қилиш оқсилларнинг аминокислота таркибини ўрганишда, пептидларни секвенлашда («қирқиш»да), ҳамда аминокислота ва оқсил алмашинуви бузилишини аниқлаш керак бўлганда бажарилади.
Аминокислоталарни ажратиб олишнинг энг муҳим усуллари қуйидагилардир: ион-алмашинув хроматографияси, аминокислоталарнинг фенилизотиоцианат (ФТЦ) ҳосилаларининг тақсимланувчи хроматографияси, электрофорез, қоғоз хроматографияси.
Ион-алмашинув хроматографияси – қарама-қарши зарядланган ионлар орасидаги электростатик ўзаро таъсирга асосланган. Бунда асосий шарт, зарядлардан бири инерт ташувчига ковалент боғланган бўлиши керак. Бундай ион-алмаштиргич қарама-қарши зарядли ионларни боғлай олади. Ион-алмаштиргич ион кучи баландроқ бўлган эритма билан ювилганда сорбцияланган ионларни эритмага ўтказиб олиш (элюция қилиш) мумкин.
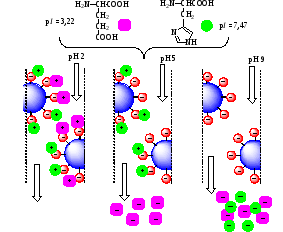
4-расм. Аминокислоталарнинг ион-алмашинув хроматографияси
Аминокислоталарни ион-алмашинув хроматографияси усули ёрдамида ажратиб олишда ҳаракатсиз фаза сифатида сульфогруппалар (-SО3-) сақлаган синтетик полимер гранулаларидан фойдаланилади. Ушбу группалар рН нинг барча диапазонида ионланган бўлиб, манфий зарядга эгадирлар. Ишни бошлашдан олдин колонкага гранулалардан солинади ва Na+ли буфер эритма (рН2) билан ювилади. Бунда сульфогруппалар (расмда кўк рангли) натрий ионларини (расмда қизил ранг) боғлаб олади. Колонкага аминокислоталар эритмаси юборилганда, мусбат зарядланган аминокислоталар молекулалари (пушти ва яшил ранг) манфий зарядли натрий иони билан боғланади, ва ионитда сорбцияланиб қолади. рН қийматини ўзгартирган ҳолда аминокислоталарни ажратиб олиш мумкин (4-расм).
Хулоса қилиб айтадиган бўлсак, аминокислоталар изоэлектрик нуқталарининг қийматидан анча паст қийматларда ювиб олинади (элюция қилинади), чунки ионит билан боғланиш учун бу жараёнда буфер эритманинг Na+ ионлари рақобатлашиб туради.
Аминокислоталар ФТЦ-ҳосилаларининг тақсимловчи (колонкали) хроматографияси – ажратилувчи моддалар қутблилигининг турли эканлигига асосланган. Агар инерт ташувчига кучсиз қутбли бўлган ҳаракатсиз фаза киритилса, ва сўнгра кучсиз қутбли моддалар юборилса улар ташувчида гидрофоб ўзаро таъсир ёрдамида ушлаб қолинади (5-расм). Агар бундай колонкани қутбли эритувчилар аралашмаси (ҳаракатли фаза) билан ювилса, у ҳолда моддалар аралашмаси қутблилик даражасига қараб турли тезлик билан силжий бошлайди. Бунда дастлаб ҳаракатсиз фаза билан кучсиз таъсирга эга бўлган гидрофиль моддалар, сўнгра гидрофоб моддалар элюцияланади, яъни ювилади (ажратиб олинади). Бу усулнинг замонавий модификациясига «айлантирилган фазали хроматография» (обращенно-фазовая хроматография) дейилади.
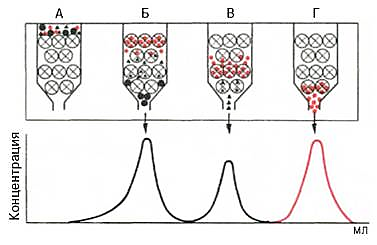
5-расм. Аминокислоталарнинг гель- хроматографияси
Фенилизотиоцианат билан ўзаро таъсирлашув натижасида аминокислоталарнинг ФТЦ ҳосилалари олинади. Бу ҳосилалар кам қутбланган бўлиб, спектрнинг УБ сохасида ютиши орқали уларни элюатда фотометрик усул билан аниқлаш мумкин.
Ҳаракатсиз фаза (ташувчи) сифатида силикагельнинг майда зарраларидан (диаметри 5 мкм) фойдаланилади. Зарралар қанча майда бўлса, ажратиш шунча сифатли бўлади, бироқ бунда колонканинг механиқ қаршилиги ошади. Шунинг учун юқори самарали суюқлик хроматографиясини зангламайдиган пулатдан ясалган капиллярларда ёки колонкаларда олиб борилади, элюент эса юқори босимли насослар ёрдамида берилади.
-
N-охирги аминокислотани аниқлаш усуллари. Алоҳида кимёвий жиҳатдан гомоген полипептид занжирининг бирламчи тузилишини аниқлаш учун биринчи навбатда гидролиз усули ёрдамида унинг аминокислота таркиби аниқланади, аниқроқ айтадиган бўлсак, гомоген полипептид намунасида 20 та аминокислоталар нисбати аниқланади. Шундан сўнггина полипептид занжирининг битта эркин NH2- ва битта эркин СООН- группаларини тутган охирги аминокислоталар табиатини аниқлашга ўтилади. N-охирги аминокислотани аниқлаш учун қатор усуллар таклиф этилган, жумладан полипептидни 2,4-динитрофторбензол (ДНФБ) билан ариллаш усули бўлган Сенгер усули қўлланилганда N-охирги аминокислотанинг сариқ рангдаги 2,4-динитрофенил ҳосиласи олинади (Сенгер буйича секвенлаш, лот. sequentum — кетма-кетлик).
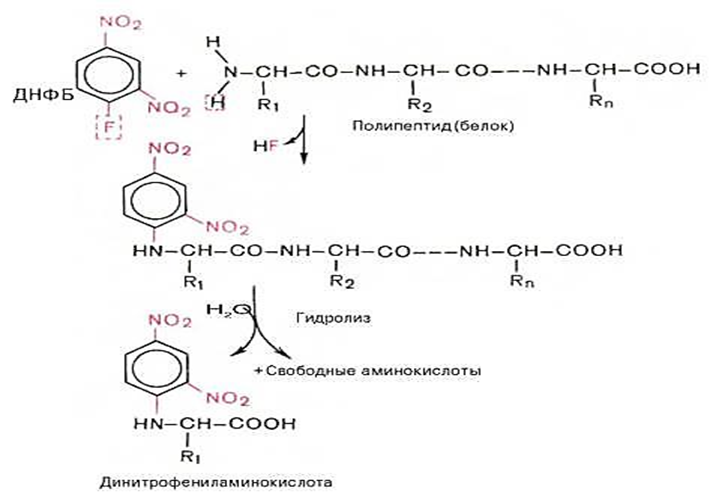
Сенгер усули бўйича N-охирги аминокислотани аниқлаш
Полипептид эритмаси ДНФБ билан қайта ишланганда у N-охирги аминокислотанинг NH2-группаси билан таъсирлашади. Реакция маҳсулотининг кислотали гидролизидан сўнг фақат битта N-охирги аминокислота реактив билан бириккан бўлади (ва у гидролизга чидамли маҳсулотдир). Гидролиз натижасида ҳосил бўлган эркин аминокислоталардан фарқли равишда бу кислота сариқ рангга эга бўлади. Уни хроматография усули билан аниқлаш мумкин. Бу усул ёрдамида британиялик олим Фредерик Сенгер инсулин молекуласининг аминокислота кетма-кетлигини аниқлаган, ва 1958 йилда бу тадқиқоти учун Нобель мукофотига сазовор бўлган.
N-охирги аминокислота қолдиғини аниқлашда ўзининг юқори сезгирлиги ва битта намуна учун кўп маротаба ишлатилиши мумкин бўлган Эдманнинг фенилтиогидантоин усули кенгрок кулланилади. Бу усулда фенлизотиоцианат N-охирги аминокислотанинг α-NH2-группаси билан фенилтиокарбамоилпептид ҳосил қилиб таъсирлашади:

N-охирги аминокислота қолдиғини аниқлаш - Эдман усули
Реакция маҳсулотини кислота билан қайта ишлаш N-охирги аминокислотанинг фенилтиогидантоин ҳосиласининг ажралишига олиб келади, ўз навбатида унинг табиатини хроматография усули ёрдамида аниқлаш мумкин бўлади. Битта аминокислотага қисқарган полипептид молекуласини яна шу усул билан тахлил қилиш давом эттирилади. Шу тарика пептид занжирини босқичма-босқич парчалаш натижасида аминокислота кетма-кетлигини аниқлаш имконияти пайдо бўлади.
Эдман усулидан оқсиллар ва пептидларнинг бирламчи структурасини аниқлашда кимёвий асос сифатида фойдаланилади. Бу усул автоматик тарзда ишлайдиган ва пептиднинг N-охирги қисмидан бошлаб 50-60 тагача аминокислота қолдиқларидан иборат бўлган аминокислота кетма-кетлигини аниқлаб бера оладиган махсус асбоб – секвенаторда реализация қилинган.
Юқорида тилга олинган реактивлардан ташқари аминокислоталар кетма-кетлигини аниқлашда бошқа реактивлар ҳам ишлатилади - калий цианат, 1-диметиламинонафтил-5-сульфонилхлорид – дансилхлорид ва дабсилхлорид.

Баъзан бу максадда ферментлар - экзопептидазалар ҳам ишлатилади, масалан, аланин- ва лейцинаминопептидаза. Бу ферментлар ҳам полипептид занжирини N-охирги қисмидан бошлаб узиш қобилиятига эга.
-
С-охирги аминокислотани аниқлаш усуллари. С-охирги аминокислотанинг табиатини аниқлаш учун кўпинча ферментатив усуллар қўлланилади. Полипептид занжирини карбоксипептидаза билан қайта ишлаш унинг эркин СООН группаси бўлган тарафидан узилишига олиб келади, узилган аминокислота хроматография йўли билан идентификация қилинади.
Акабори
усули.
С-охирги аминокислотани аниқлаш учун
полипептид занжири гидразинолизга
учратилади: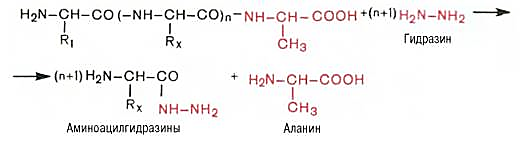
Аминоацилгидразинлар Аланин
Гидразинга сезгир бўлган пептид боғлари унинг таъсирида узилади ва гидразин С-охирги аминокислотадан ташқари ҳосил бўлган барча аминокислоталар билан ўзаро таъсирлашади. С-охирги кислотанинг СООН группаси пептид боғида иштирок этмагани учун у гидразина билан таъсирлашмайди. Натижада аминоацилгидразинлар ва эркин С-охирги аминокислота аралашмаси ҳосил бўлади. Бу аралашма ДНФБ билан қайта ишлангандан сўнг эркин аминокислота ажратиб олинади ва хроматографик усулда аниқланади.
С-охирги аминокислотани натрий боргидриди ёрдамида аниқлаш. Полипептид эритмасини қайтарувчи реагент - натрий боргидриди билан қайта ишланганда С-охирги аминокислота α-аминоспиртга айланади, уни осонликча хроматорграфик усулда аниқлаш мумкин:
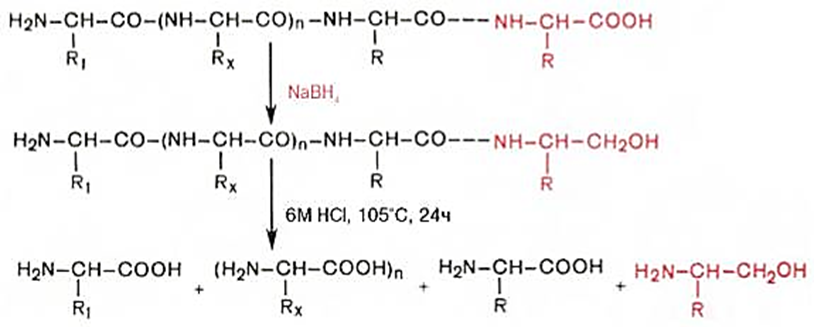
-
Ферментатив усуллар – пептид боғларини уза олувчи протеолитик ферментларнинг танловчанлигига асосланган. Жумладан пепсин ферменти фенилаланин, тирозин ва глутамин кислотаси, трипсин – аргинин ва лизин, химотрипсин – триптофан, тирозин ва фенилаланин қолдиқлари ҳосил қилган пептид боғларни уза олади. Қатор бошқа ферментлар, масалан, папаин, субтилизин, проназа ва бошқа бактериал протеиназалар оқсилларни қисман гидролиз қилишда ишлатилади. Натижада полипептид занжир баъзан бир нечта аминокислоталардан иборат бўлган майда пептидларга ажралади. Уларни бир-биридан электрофоретик ва хроматографик усуллар билан ажратиб олиш мумкин, ва шу тарзда пептид карталарини тузиш мумкин бўлади. Сўнгра ҳар бир ажратиб олинган пептиднинг аминокислота таркибини ўрганиш мумкиндир. Бундай тадқиқот полипептиднинг тўлиқ аминокислота кетма-кетлигини аниқлаш билан тугалланади.
-
Дисульфид боғларининг ўрнини аниқлаш. Оқсилларнинг молекулаларида мустаҳкам ковалент боғлар – пептид боғлари, дисульфид боғлари бор. Шу билан бирга кучсиз боғлар – водород боғлари, ионли боғлар, ван-дер-ваальс боғлари, гидрофоб таъсирлар ҳам мавжуд. Дисульфид боғлар оқсилларда 2 та молекула цистеин орасида ҳосил бўлиши мумкин. Дисульфид «кўприклар» битта полипептид занжири таркибида, ва алоҳида полипептид занжирлари ўртасида ҳам учрайди. Масалан, инсулин гормонини олсак, унинг таркибида иккала вариант дисульфид кўприклар мавжуд (6-расм). Дисульфид боғлар оқсил молекуласининг фазовий тузилишига, яъни учламчи структурага таъсир қилади. Дисульфид боғлар оқсилларга баъзи қайтарувчилар таъсир эттирилганда, ёки окслнинг денатурацияси давомида парчаланади. Кўпчилик ҳужайра ичидаги оқсилларда дисульфид боғлар йўқ. Бироқ, ҳужайрадан ташқарига чиқариладиган оқсилларда дисульфид боғ кўп тарқалган. Ушбу боғлар оқсилларнинг ҳужайрадан ташқаридаги конформациясини барқарорлаштиради ва уларнинг денатурациясининг олдини олади деб ҳисобланади. Бундай оқсилларга мисол тариқасида инсулин ва иммуноглобулинларни келтириш мумкин
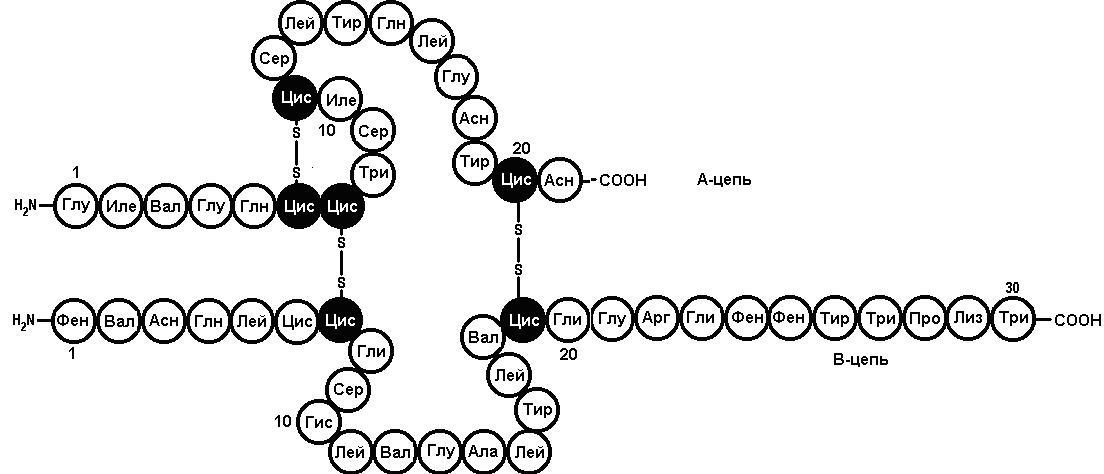
6-расм. Одам инсулини оқсилининг бирламчи структураси (Сенгер, 1944-1954)
Ҳамон оқсил молекуласи дисульфид боғлар билан барқарорлашган экан, денатурацияга ва протеолитик ферментлар таъсирига чидамли экан, тадқиқ этилаётган оқсилда дисульфид боғлар мавжуд бўлган тақдирда цистеиннинг барқарор ҳосилаларини олиш учун уларни қайтариш ва кейин модификациялаш ёки оксидлаш зарур бўлади. Дисульфид боғларининг сони оқсилдаги цистеин аминокислотаси қолдиқларининг суммар миқдори ва эркин сульфгидрил боғлар миқдорининг айирмасига тенг бўлади.
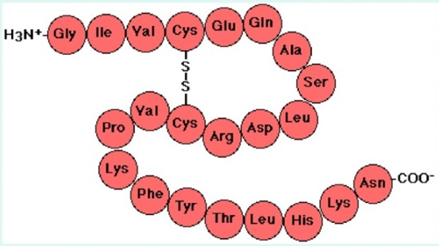
7-расм. Полипептид молекуласи моделидаги дисульфид кўприк
Кўпчилик
глиадинларнинг молекуласида ички
молекуляр дисульфид боғлар бўлади
(8-расм):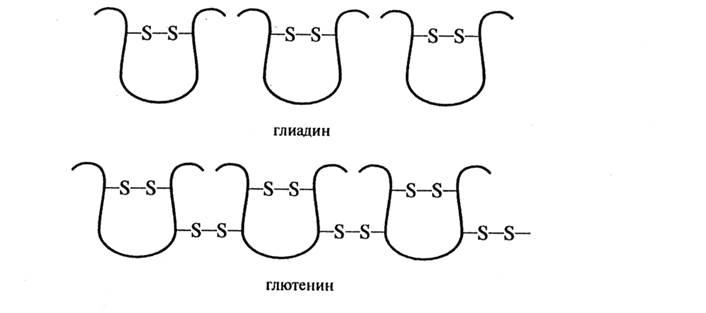
8-расм. Дисульфид боғлари бўлган оқсилларнинг схематик кўриниши
Қатор полипептид занжирларидан иборат бўлган глютенин оқсилининг ҳар бир занжирига қўшни занжирларни боғловчи 2-3 та дисульфид боғ тўғри келиши аниқланган.
Агар оқсил молекуласини дисульфид боғлар орқали ва бошқа ковалент бўлмаган боғлар орқали боғланган бир нечта полипептид занжирлар ташкил этган бўлса, занжирлардан бирида ички дисульфид боғлар мавжуд бўлса оқсилнинг бирламчи тузилишини ўрганиш масаласи мураккаблашади. Чунки, даставвал ушбу занжирларни ажратиш ва дисульфид боғларни ўзиш керак бўлади. Ковалент бўлмаган боғларни узувчи денатурация реактивлари – 8М мочевина ёки 6М гуанидингидрохлорид билан оқсил қайта ишланади. Надчумоли кислотаси билан қайтариш, ёки β-меркаптоэтанол билан оксидлаш реакцияларини олиб бориш натижасида дисульфид боғлари узилади. Бунда цистеин кислотаси ёки цистеин сақловчи эркин полипептидлар ҳосил бўлади.
Мавзуни қайтариш учун саволлар
-
Аминокислоталарни ажратиб олишнинг энг муҳим усулларини таърифланг.
-
Ион-алмашинув хроматографияси – қандай ўзаро таъсирга асосланган?
-
Аминокислоталарнинг ФТЦ-ҳосилаларининг тақсимловчи хроматографияси нимага асосланган?
-
N-охирги аминокислотани аниқлаш учун қандай усуллар таклиф этилган?
-
Полипептидни 2,4-динитрофторбензол (ДНФБ) билан ариллаш усули бўлган Сенгер усули қулланилганда N-охирги аминокислотанинг қандай ҳосиласи олинади?
-
N-охирги аминокислота қолдиғини аниқлашда ишлатиладиган Эдманнинг фенилтиогидантоин усули Сенгер усулидан нимаси билан фарқ қилади?
-
Аминокислота кетма-кетлигини автоматик аниқлаб бера оладиган махсус асбоб – секвенаторда аминокислота қолдиқларини аниқловчи қайси усул реализация қилинган?
-
С-охирги аминокислотанинг табиатини аниқлашда қайси усуллар кулланилади?
-
С-охирги аминокислотани аниқлаш учун полипептид занжирини гидразинолизга учратишни ким таклиф этган?
-
С-охирги аминокислотани натрий боргидриди ёрдамида аниқлаш қандай реакцияларга асосланган?
-
Аминокислота кетма-кетлигини аниқлашда кулланиладиган ферментатив усуллар нимага асосланган?
-
Оқсиллар ёки пептидлар таркибидаги дисульфид боғларининг ўрнини аниқлашда қандай усуллардан фойдаланилади?
-
Дисульфид боғлар оқсил молекуласининг тузилишига қандай таъсир қилади.
-
Эдманнинг фенилтиогидантоин усулида фенлизотиоцианат N-охирги аминокислотанинг α-NH2-группаси билан қандай модда ҳосил қилиб таъсирлашади?
