
- •Аминокислоталар, пептидлар, оқсиллар
- •Оқсилларнинг аминокислота таркибини аниқлаш
- •Оқсилларнинг тузилиши
- •Оқсил ва пептидларнинг кимёвий синтези
- •Оқсиллар ва пептидларнинг кимёвий модификацияси
- •40000 Марта катталаштирилган
- •Ферментлар
- •Ферментларнинг каталитик фаоллиги сабаблари
- •Ҳимоя оқсиллари
- •2. Антитаналарнинг изотиплари. Улар константа қисмининг типи орқали аниқланади. Баъзи изотиплар бириктирувчи занжир ёрдамида димерларни (IgA), ёки пентамерларни (IgM) ҳосил қилади.
- •Иммун жавоб медиаторлари - цитокинлар
- •Яллиғланиш медиаторларининг классификацияси
- •Тўқима лизокиназалари, стрептокиназа
- •Плазминоген (фибринолизиноген, профибринолизин)
- •Оқсил ва пептид гормонлар
- •Оқсил ва пептид гормонлар биосинтези
- •Нейропептидлар
- •Қилувчи гипоталамус гормонлари
- •Гастроинтестинал пептид-гормонлар ва уларнинг биологик функциялари
- •Пептид токсинлар
- •Предмет кўрсаткичи
- •Номлар кўрсаткичи
- •Фойдаланилган адабиётлар
- •Интернет ресурслари
- •Мундарижа
40000 Марта катталаштирилган
Амилоидоз (амилоид дистрофия) — оқсил алмашинувининг бузилиши, тўқималарда специфик оқсил-полисахарид комплекси – амилоиднинг тўпланиб бориши билан характерланади.
Мавзуни қайтариш учун саволлар
-
Полипептид занжирининг актив оқсилга айланишига нима дейилади?
-
Оқсилнинг активлиги учун нима зарур?
-
Оқсилларнинг биоспецифик модификацияларини санаб ўтинг.
-
Липидлар билан якорьланган оқсиллар, ёки ҳужайра мембранасининг липидлари билан ковалент боғланган ҳужайра мембранаси оқсилларининг функцияси нимадан иборат?
-
Оқсил молекуласининг гидрофоблиги ортишида қандай группалар роль ўйнайди?
-
Липидлар билан белгиланган оқсилларнинг уч типини ажратиб кўрсатинг.
-
N-миристоилланиш - миристин кислотасининг оқсилга боғланиши –қачон рўй беради ва бу боғланиш ниманинг натижасидир?
-
S-пальмитоиллаш - пальмитин кислотасининг оқсилларга бирикиши – қандай амалга ошади?
-
GPI-оқсиллар (гликозилфосфатидилинозитид оқсиллар) – GPI комплексига қайси охирги аминокислотанинг қандай группаси орқали бирикади?
-
Фосфоинозитидларнинг муҳим функцияси нимадан иборат?
-
Посттрансляцион модификация реакцияларига (процессинг реакцияларига) қайси реакциялар киритилган?
-
Ён занжир аминокислота қолдиқларига кимёвий группаларни бириктиришга мисоллар келтиринг
-
Оқсилларни метиллашда қайси ферментлари иштирок этади?
-
Гистонлар – оқсилларининг қандай синфи, ва қайси функцияларни бажаради?
-
Тиреоглобулинга йоднинг бирикиши қандай гормонларнинг ўтмишдошларининг ҳосил бўлиши учун керак?
-
Аминокислоталар молекуласига гидроксил группасини киритиш қандай оқсил молекуласининг етилиши учун зарур?
-
Гликопротеинлар – простетик группа сифатида аминокислоталар радикалларига қандай боғ орқали боғланган?
-
Оқсил молекуласига гемни киритиш – қайси оқсиллар синтезида кузатилади?
-
Оқсилларнинг фолдинги нима? Фолдингни таъминлаш учун қандай оқсиллардан фойдаланилади?
-
Шаперонлар қандай оқсиллар?
Ферментлар
Ферментларнинг синфлари, ферментатив кинетиканинг асослари, ферментларнинг актив бирикмалари, уларнинг активлаштирувчилари ва ингибиторлари, кооператив таъсирлар ва регулятор ферментлар таъсирига муҳит рН кўрсаткичининг ва температуранинг таъсири.
1. Ферментлар ҳақида тушунча. Ферментлар – кимёвий реакцияларни тезлаштирувчи табиий биокатализаторлардир. Организмдаги ташкил этилган моддалар алмашинуви ҳар бир ҳужайра генетик танлаб берилган ферментлар набори бўлсагина амалга оша олади. Фақат шу шарт бажарилганда бир-бири билан мос бўлган реакциялар амалга ошади. Ферментлар жуда кўп метаболик жараёнларда иштирок этади, шу билан бирга улар моддалар алмашинувини ўзгарилган шароитларга мослашишини таъминлаб беради. Барча ферментлар – оқсиллардир. Каталитик актив нуклеин кислоталар ҳам мавжуд – улар рибозимлар деб аталади.
Ҳозиргача аниқланган ферментлар сони бир неча мингни ташкил этади. Жонли организмда рўй берадиган барча кимёвий реакциялар ферментлар иштирокида ўтади. Ферментлар кимёвий реакцияларни 108-1020 мартагача тезлаштириб бера олади. Улар энг муҳим биологик жараёнларда ҳал қилувчи рольни ўйнайди: моддалар алмашинуви, мушакларнинг қисқариши, организмга тушган бегона моддаларни зарарсизлантириш, сигнал юбориш, моддаларни транспортлаш, қоннинг ивиши ва бошқалар. Ҳужайра учун ферментлар жуда зарур (абсолют зарур) уларсиз ҳужайра ва демак, ҳаёт ҳам мавжуд бўлмаган бўлар эди.
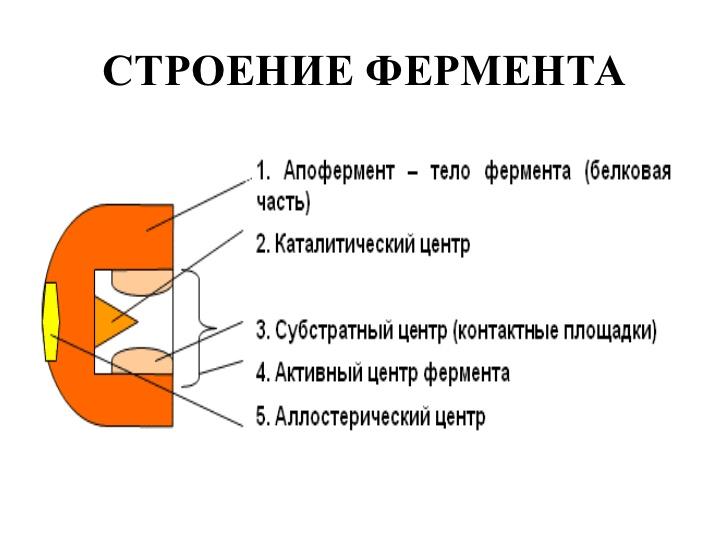
47-расм. Фермент тузилишининг схемаси
Фермент сўзи лотинча fermentum – ачитқи сўзидан келиб чиққан, энзим сўзи эса юнонча – дуражада деган маънони билдиради. Ферментлар ҳақида дастлабки маълумотлар 19-асрда олинган, лекин фақат 20-асрга келиб ферментларнинг таъсири ҳақидаги назариялар шаклланди, ва 1926-йилда Джеймс Самнер биринчи бор уреаза ферментини тоза кристалл ҳолда ажратиб олишга муваффақ бўлди. Уреаза мочевинанинг гидролитик парчаланишини катализ қилувчи фермент ҳисобланади:
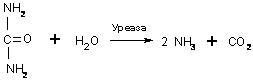
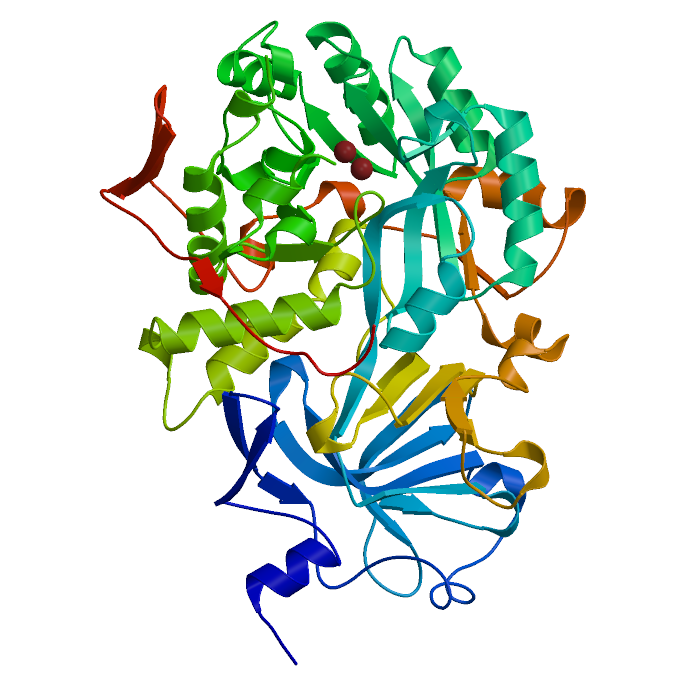
48-расм. Helicobacter pylori бактериясидан олинган уреаза ферментининг модели
Уреаза патоген бактерияларда топилган никель сақловчи оқсил, масалан, уробактерияларда, дуражаларда, ўсимликларда (соя – зиғир уруғида айниқса кўп), ҳамда қатор умуртқасиз организмларда ҳам топилган. Одам ва ҳайвон организмида уреаза бактериал флора тарафидан ҳосил қилинади.
Уреаза
димерга бириккан α ва β 2 та суббирликдан
иборат. Ўз навбатида бу димерлар
бир-бири билан бирикиб тримерларни
ҳосил қилади (αβ)3.
Тримерлар эса ўзига хос мураккаб
тузилмага бирлашади: [(αβ)3]4.
Helicobacter
pylori
бактерияларидан ўзига хос уреаза
ажратиб олинган, унинг 6 та суббирлигидан
4 таси 24та суббирликдан иборат бўлган
надмолекуляр комплексга бирлашган:
α12β12.
Мана шу надмолекуляр комплекс ошқозон
ширасидаги хлорид кислотани нейтраллаш
учун аммиак ишлаб чиқарадиган бактерия
ферментининг қўшимча барқарорлигини
таъминлайди. Уреаза ферменти активлигининг
юқори бўлиши патоген бактерия Helicobacter
pyloriни
аниқлашда
диагностик белги бўлиб ҳисобланади.
49-расм. Джеймс Самнер (1887-1955), америкалик биохимик, 1946 йил Нобель мукофоти лауреати
2. Ферментларнинг синфлари. Ферментларнинг замонавий классификацияси ва номенклатураси 1961 йилда Москвада бўлиб ўтган 5-Халқаро Биокимё Конгрессида «Халқаро Биокимё Иттифоқининг ферментлар бўйича комиссияси» тарафидан ишлаб чиқилган.
Янги очилган ва очилаётган ферментлар сонининг тез суръатлар билан ўсиши, уларга ҳар бир тадқиқотчи ўз қарашларига кўра ном бераётгани номенклатурани системалаштириш заруратини тақозо этар эди. Айнан бир ферментга кўпинча икки ёки бир нечта ном берилиши ҳам номенклатурага чалкашликларни олиб кираётган эди. Баъзи ферментларнинг номланиши катализ қилинаётган реакцияни акс эттирмас, ферментни номлашда фермент таъсир этаётган субстрат номидан келиб чиқиб, унинг охирига –аза қўшимчаси қўшилар эди. Масалан, амилазалар (углеводларни гидролизловчи ферментлар), липазалар (липидларга таъсир этувчи ферментлар), протеиназалар (оқсилларни гидролизловчи ферментлар) ва ҳ-зо.
Ферментларни системали номлашда катализ қилинаётган реакциянинг типи ва субстратнинг (субстратларнинг) номи асос қилиб олинган. Халқаро классификацияга кўра ферментлар 6 та синфга бўлинади, ва ҳар бир синфнинг бир нечта синф ости гуруҳлари бор:
-
оксидоредуктазалар
-
трансферазалар
-
гидролазалар
-
лиазалар
-
изомеразалар
-
лигазалар (синтетазалар)
3-жадвал. Ферментларнинг халқаро классификацияси
|
№ |
Синф |
Катализ қилинаётган реакция тури |
|
1 |
Оксидоредуктазалар |
Электрон ва протонларни кўчириш |
|
2 |
Трансферазалар |
Водород атомидан ташқари бошқа атомлар группаларини кўчириш |
|
3 |
Гидролазалар |
Сув молекуласи иштирокида турли боғларнинг гидролизи |
|
4 |
Лиазалар |
Группаларни йўқотиш ҳисобига қўш боғларнинг ҳосил бўлиши ёки қўшбоғнинг узилиши ҳисобига группаларнинг қўшилиши |
|
5 |
Изомеразалар |
Группаларни ички молекуляр кўчириш ҳисобига изомерларнинг ҳосил бўлиши |
|
6 |
Лигазалар (синтетазалар, синтазалар) |
АТФнинг пирофосфат боғи узилиши ҳисобига ҳосил бўлаётган энергия ёрдамида икки молекуланинг бирикиши ва С-С, С-О, С—N ва C-S боғларнинг ҳосил бўлиши |
Оксидоредуктазалар. Оксидоредуктазалар синфига иккита субстрат иштирокидаги, биологик оксидланишниг асосида ётувчи оксидланиш-қайтарилиш реакцияларини катализ қилувчи ферментлар киради. Уларнинг систематик номланишини қуйидаги шаклга кўра тузишади: «донор: акцептор оксидоредуктаза». Масалан, лактатдегидрогеназа (ЛДГ) учун «лактат: НАД+ оксидоредуктаза».
Қуйидаги асосий оксидоредуктазаларни ажратиб кўрсатиш мумкин:
- протонларни (электронларни) бевосита кислород атомига кўчириб ўтказишни катализ қилувчи аэроб дегидрогеназалар ёки оксидазалар;
- протонларни (электронларни) бевосита кислород атомига эмас, балки оралиқ субстратга кўчириб ўтказишни тезлаштирувчи анаэроб дегидрогеназалар;
- фақат электронларни кўчириб ўтказилишини катализ қилувчи цитохромлар. Бу синфга водород пероксиди иштирокида реакцияларни катализ қилувчи гем сақлаган ферментлар каталаза ва пероксидаза ҳам киритилади.
Оксидоредуктазалар синфига оксидланиш-қайтарилиш реакцияларини катализловчи ферментлар киритилади. Бу реакцияларнинг умумий схемаси қуйидагича:
![]() ,
,
бу ерда АН2 – водород донори, В –водород акцептори. Жонли организмларда оксидланиш асосан субстрат-донорлардан водород ёки электроннинг узилиши орқали амалга ошади. Водород атомининг акцепторлари сифатида турли моддалар – коферментлар (НАД, НАДФ, ФАД, ФМН, глутатион, липой кислотаси, убихинон), цитохромлар, темир ва олтингугурт тутган оқсиллар ва кислород хизмат қилади.
Оксидоредуктазалар водород (электрон) донори функционал группасининг табиатига қараб шаклланади. Бу синфда 19 та синф ости группалари бор, асосийлари қуйидагилар:
Донорларнинг СН-ОН группасига таъсир қилувчи оксидоредуктазалар. Бу синф ости группасига кирувчи ферментлар спирт группаларини альдегид ёки кетон группаларигача оксидлайди. Масалан, тўқималардаги этанол метаболизмида иштирок қилувчи фермент алькогольдегидрогеназани (алкоголь: НАД-оксидоредуктаза; КФ 1.1.1.1) келтириш мумкин
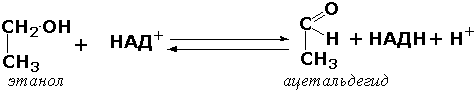
Спиртларни оксидлашдан ташқари ушбу синф ферментлари ОН группасини тутган оксикислоталарнинг (сут, олма, изолимон), моносахаридларнинг ва бошқа моддаларнинг дегидрогенланишида иштирок этади.
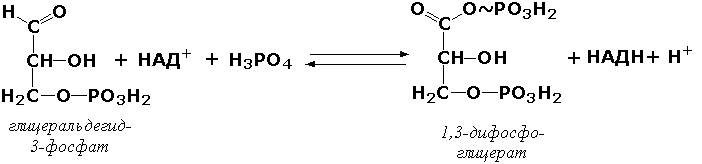
Донорларнинг альдегид ёки кетон группасига таъсир қилувчи оксидоредуктазалар. Ушбу ферментлар карбон кислоталарнинг альдегид ёки кетон группасини оксидлайди. Масалан, глицеральдегид-3-фосфатдегидрогеназа (D-глицеральдегид-3-фосфат: НАД - оксидоредуктаза, фосфорловчи, КФ 1.2.1.12) ферменти глюкоза парчаланишининг оралиқ реакцияларидан бирини катализ қилади:
Донорларнинг СН-СН группасига таъсир қилувчи оксидоредуктазалар. Бу ферментлар катализ қилувчи реакциялар натижасида СН-СН группалари С=С группаларига айланади, яъни, тўйинган моддалардан тўйинмаган моддалар ҳосил бўлади. Масалан, уч карбон кислоталар циклининг ферменти сукцинатдегидрогеназа (сукцинат : акцептор - оксидоредуктаза, КФ 1.3.99.1) қахрабо кислотасининг фумар кислотасигача оксидланишини тезлаштиради:

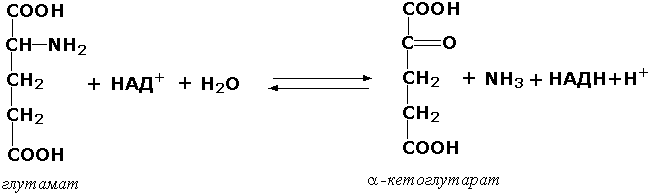
Донорларнинг СН-NH2 группасига таъсир қилувчи оксидоредуктазалар. Бу ферментлар аминокислоталар ва биоген аминларнинг оксидловчи дезаминланишини катализ қилади. Натижада аминлар альдегид ёки кетонларга, аминокислоталар – кетокислоталарга айланади ва аммиак ажралиб чиқади. Масалан, (L-глутамат : НАД(Ф) - оксидоредуктаза дезаминловчи, КФ 1.4.1.3) ферменти глутаматнинг қуйидаги ўзгаришида иштирок этади:
Донорларнинг олтингугурт сақловчи группаларига таъсир қилувчи оксидоредуктазалар тиол (сульфгидрил) группаларнинг дисульфидгача, сульфитларнинг сульфатларгача бўлган оксидланишини катализ қилади. Масалан, дигидролипоилдегидрогеназа (КФ 1.8.1.4) ферменти пируват оксидловчи декарбоксилланишининг оралиқ реакцияларидан бирини қуйидагича катализ қилади:
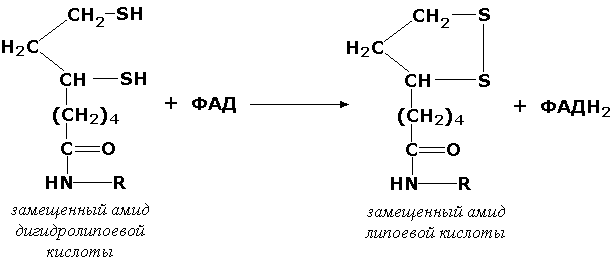
дигидролипой кислотасининг липой кислотасининг
алмашинган амиди алмашинган амиди
Водород пероксидига акцептор сифатида таъсир қилувчи оксидоредуктазалар сон жиҳатдан унча кўп эмас ва алоҳида синф ости группаси – пероксидазалар группасига бирлаштирилган. Масалан, глутатионпероксидаза (глутатион : Н2О2 - оксидоредуктаза. КФ 1.11.1.9) ферменти эритроцитлар, жигар ва бошқа тўқималарда водород пероксидининг инактивациясида иштирок этади:
![]()
қайтарилган глутатион оксидланган глутатион
Донорлар жуфтига молекуляр кислородни қўшиб таъсир қилувчи оксидоредуктазалар, ёки монооксигеназалар – органик моддаларни молекуляр кислород билан оксидлаш реакцияларини катализ қилувчи ферментлар, бунда кислород атомларидан бири шу моддаларнинг молекуласига бирикиб қолади. Иккинчи атом кислород эса сув молекуласи таркибига киради. Масалан, фенилаланин-4-монооксигеназа (КФ 1.14.16.1) ферменти фенилаланинни тирозинга айланиши реакциясини катализ қилади:
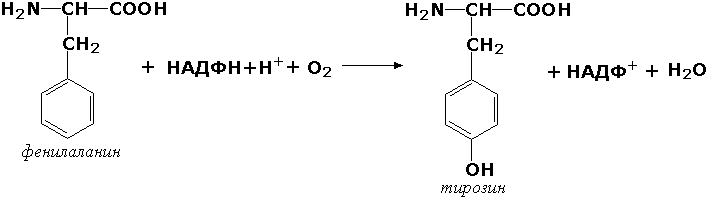
Ушбу фермент тузилишидаги генетик дефект «фенилкетонурия» касаллигини келтириб чиқаради.
Монооксигеназаларга цитохром Р450 (КФ 1.14.14.1) ферменти ҳам киритилган. У жигар ҳужайраларида бўлади ва қўшимча реакциялар натижасида ҳосил бўлган, ёки ташқаридан кириб қолган ва организм учун ёт бўлган липофиль моддаларнинг гидроксилланишини таъминлайди. Масалан, ичаклар микроорганизмларининг фаолияти натижасида триптофандан ҳосил бўладиган индол, жигарда қуйидаги схема бўйича гидроксилланишга учрайди:
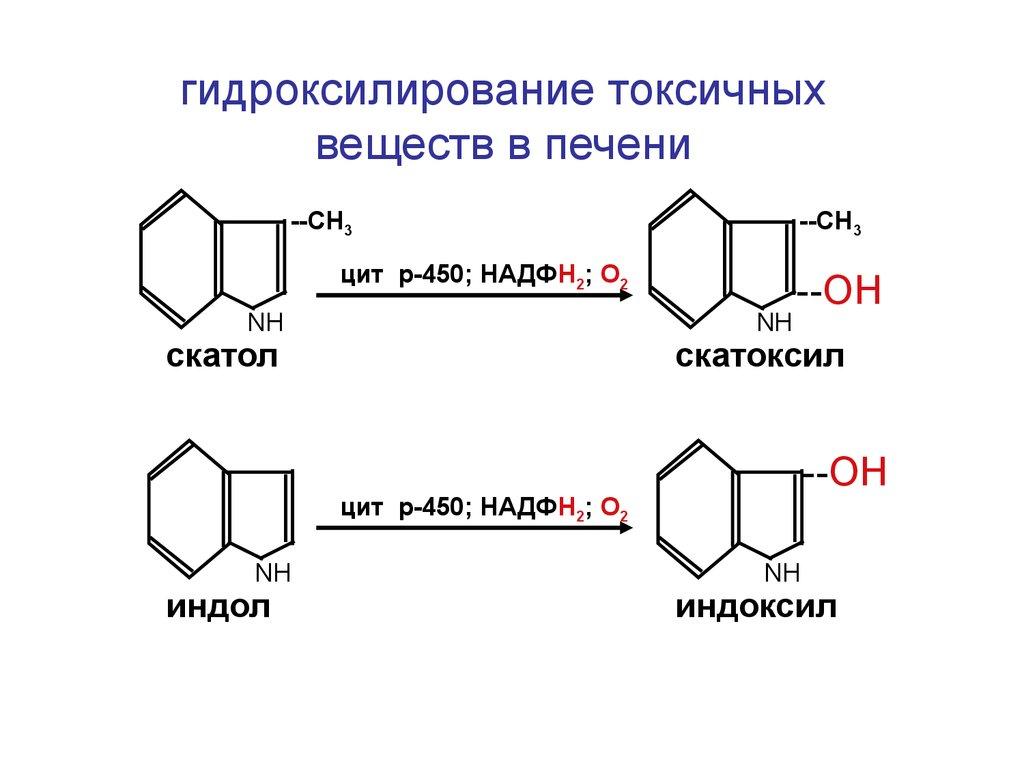
Гидроксил группасининг пайдо бўлиши моддаларнинг гидрофиллигини оширади ва уларнинг кейинги организмдан чиқарилишини осонлаштиради. Бундан ташқари, цитохром Р450 холестерин ва стероид гормонларнинг ўзгариши маълум босқичларида ҳам иштирок этади. Жонли организмларда юқори эффектив цитохром Р450 системасининг мавжудлиги керак бўлмаган амалий оқибатларга олиб келади: одам организмида дори препаратларининг бўлиши вақтини қисқартиради ва демак, дорининг терапевтик эффектини ҳам камайтиради.
Якка донорга молекуляр кислородни қўшиб таъсир қилувчи оксидоредуктазалар ёки диоксигеназалар оксидланаётган субстрат таркибига кислород молекуласининг иккала атоми ҳам бирикиши билан ўтувчи ўзгаришларни катализ қилади. Масалан, фенилаланин ва тирозин катаболизми жараёнида гомогентизин кислотасидан молекуласига иккала атом кислородни бириктириб олган малеилацетоацетат ҳосил бўлиши кузатилади:
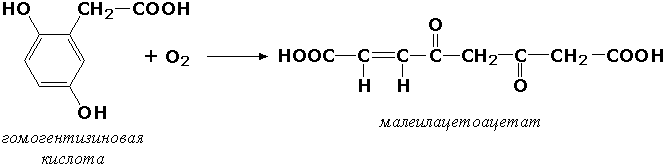
гомогентизин кислотаси
Бу реакцияни гомогентизат-1,2-диоксигеназа (КФ 1.13.11.5) ферменти бошқаради. Ушбу ферментнинг туғма дефицити «алкаптонурия» касаллигининг келиб чиқишига олиб келади.
Трансферазалар. Трансферазалар синфига молекулалараро реакцияларда турли атомлар, атомлар группаси ва радикалларни ўтказишни катализ қилувчи ферментлар киритилган. Уларнинг номланиши «донор: транспорт қилинаётган группа - трансфераза» шаклида тузилади.
Бир углеродли қолдиқларни, ацил, гликозил, альдегид, кетон, нуклеотид қолдиқларини, азотли группаларни, фосфат ва сульфат кислоталарнинг қолдиқларини ўтказишни катализ қилувчи трансферазалар ажратиб кўрсатилади. Масалан, метил- ва формилтрансферазалар, ацетилтрансферазалар, аминотрансферазалар, фосфаттрансферазалар ва ҳ-зо.
Трансферазалар бир бирикманинг функционал группасини иккинчи бирикмага ўтишини катализ қилувчи ферментлардир. Ушбу ўзгаришларнинг умумий схемасини қуйидагича кўрсатиш мумкин:
![]()
бу ерда Х - ўтказилаётган группа, АХ – группа донори, В – акцептор. Ўтказилаётган группалар табиатига кўра трансферазалар синф ости группаларига бўлинади.
Бир углеродли фрагментларни ўтказувчи трансферазалар. Ушбу синф ости группасига метил (—CH3), метилен (—СН2—), метенил (—СН=), формил ва шуларга ўхшаш группаларни ўтказувчи ферментлар киритилган. Масалан, гуанидинацетат-метилтрансфераза (S-аденозилметионингуанидин-ацетат-метилтрансфераза, КФ 2.1.1.2) ферменти иштирокида креатин биологик актив моддасининг синтези амалга ошади:

Карбон кислоталар қолдиқларини кўчириб ўтказувчи трансферазалар (ацилтрансферазалар). Ушбу ферментлар асосан коэнзим А нинг тиоэфирларидан ҳар хил акцепторларга турли кислоталар (сирка кислотаси, пальмитин кислотаси ва бошқ.) қолдиқларини ўтказиш билан боғлиқ кимёвий жараёнларни катализ қилади. Масалан, трансацетиллаш реакциясига мисол тариқасида холин-ацетилтрансфераза (ацетил-КоА : холин-О-ацетилтрансфераза, КФ 2.3.1.6) ферменти иштирокида ацетилхолин медиаторининг ҳосил бўлишини кўрсатиш мумкин:
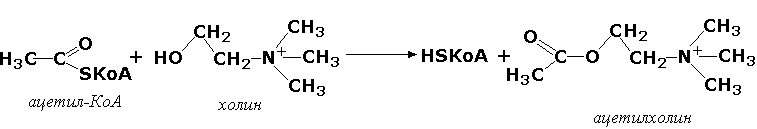
Гликозил қолдиқларини кўчириб ўтказувчи трансферазалар (гликозилтрансферазалар) фосфорэфирлари молекулаларидан гликозил қолдиқларини моносахаридлар, полисахаридлар ва бошқа моддалар молекулаларига ўтказувчи ферментлардир. Ушбу ферментлар, хусусан, гликоген ва крахмал синтезида, ҳамда улар деструкциясининг биринчи фазасида асосий рольни ўйнайди. Бу группанинг яна бир ферменти УДФ-глюкуронилтрансфераза (УДФ-глюкуронат-глюкуронил-трансфераза, КФ 2.4.1.17) – жигар тўқималаридаги эндоген ва ташқаридан кириб қолган ёт токсик моддаларни зарарсизлантириш жараёнларида иштирок этади:
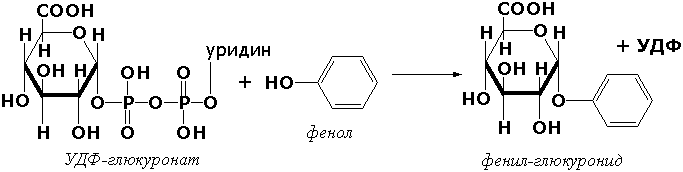
Азотли группаларни ўтказувчи трансферазалар. Ушбу синф ости группасига аминокислоталар α-аминогруппасини кетокислоталарнинг α-углерод атомига ўтказишни тезлаштирувчи ферментлар киради. Уларнинг орасида энг муҳими аланинаминотрансфераза (L-аланин:2-оксоглутарат-аминотрансфераза, КФ 2.6.1.2):
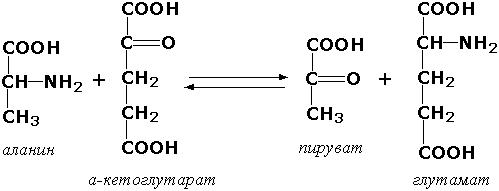
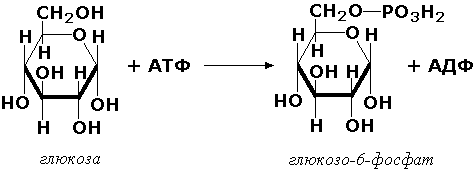
Ушбу ферментлар группаси фосфат кислота қолдиқларини турли субстратларга транспорт қилиш билан ўтадиган биокимёвий жараёнларни катализ қилади. Бу жараёнлар организмнинг ҳаёт фаолияти учун муҳим аҳамиятга эга, чунки юқори кимёвий активликка эга бўлган ва кейинги реакцияларга осон кириша оладиган қатор моддаларни органик фосфоэфирларга айланишини таъминлайди. Фосфатнинг донори сифатида АТФ ни ишлатадиган фосфотрансферазаларга киназалар дейилади. Кенг тарқалган киназалардан гексокиназа (ATФ : D-гексоза-6-фосфотрансфераза, КФ 2.7.1.1.) АТФ молекуласидан фосфат группаларини моносахаридларга ўтказишни тезлаштиради:
Баъзи ҳолларда тескари реакция – фосфат группасини субстратдан АДФ га ўтказиш ва АТФ ҳосил бўлиши ҳам мумкин. Масалан, фосфоглицераткиназа (АТФ:D-3-фосфоглицерат-1-фосфотрансфераза, КФ 2.7.2.3) ферменти 1,3-дифосфоглицератнинг ўзгаришини тезлаштиради:
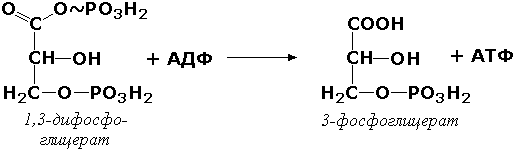
АДФнинг фосфорилланиши натижасида АТФ ҳосил бўлишига ва субстратнинг ўзгаришига ўхшаган (нафас олиш занжирида электронни кўчириб ўтказиш эмас) реакциялар «субстрат фосфориллаш» номини олган. Ушбу реакцияларнинг ҳужайрадаги роли тўқималарда кислород етишмаслигида муҳим бўлиб қолади.
Гидролазалар. Гидролазалар синфига органик моддаларнинг ички молекуляр боғларини сув молекуласи иштирокида парчаловчи ферментларнинг катта группаси киритилган. Уларнинг номланиши «субстрат-гидролаза» шаклида тузилади. Гидролазаларга қуйидаги ферментлар киритилган:
- мураккаб эфирларнинг синтези ва гидролизи реакцияларини катализ қилувчи ферментлар – эстеразалар;
- гликозид боғларининг парчаланишини тезлаштирувчи ферментлар – гликозидазалар;
- фосфоангидрид ва пептид боғларининг гидролизини катализ қилувчи фосфатаза ва пептидгидролазалар;
- пептид боғларидан фарқ қилувчи амид боғларининг узилишини тезлаштирувчи ферментлар – амидазалар.
Ушбу реакциялар қуйидаги умумий схема бўйича кетади:
![]() ,
,
бу ерда А-В мураккаб модда, А-Н ва В-ОН – унинг гидролизланиши маҳсулотлари. Бундай реакциялар организмда актив амалга ошиб туради, улар энергия ажралиши билан ўтади ва қайтмас реакциялар ҳисобланади. Гидролазалар синф ости группалари гидролизланаётган боғ табиатига қараб қуйидаги группаларга бўлинган:
Мураккаб эфирларга таъсир қилувчи гидролазалар (эстеразалар). Бу ферментлар карбон кислоталар, фосфат, сульфат ва бошқа кислоталар мураккаб эфирларини гидролиз қилишда иштирок этади. Масалан, триацилглицероллипаза (глицерол эфирларининг гидролазаси, КФ 3.1.1.3) ферменти ацилглицеролларнинг гидролизини тезлаштиради, ва кенг тарқалган ферментдир:
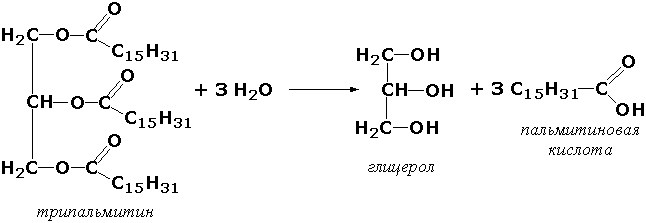
Бошқа тур эстеразалар ацетилхолиндаги (ацетилхолинэстераза), фосфолипидлардаги (фосфолипаза), нуклеин кислоталардаги (нуклеаза), фосфоорганик эфирлардаги (фосфатаза) мураккаб эфир боғларини парчалайди.
Гликозид боғларга таъсир қилувчи гидролазалар (гликозидазалар) олиго- ва полисахаридларнинг, ҳамда моносахарид тутган бошқа моддаларнинг, масалан, нуклеозидларнинг гидролиз реакцияларини тезлаштиради. Масалан ушбу тур ферментларга сахарозани парчаловчи сахараза (β-D-фруктофуранозид-фруктогидролаза, КФ 3.2.1.26) ферменти мисол бўла олади:
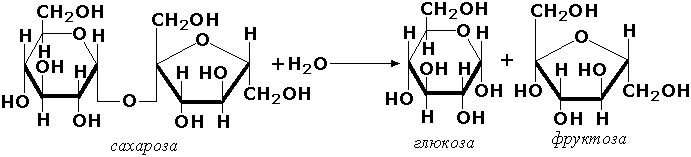
Пептид боғига таъсир этувчи гидролазалар (пептидазалар) – оқсил ва пептидларда пептид боғини гидролизланишини катализ қилади. Бу синфга пепсин, трипсин, химотрипсин, катепсин ва бошқа протеолитик ферментлар киритилган. Пептид боғларининг гидролизи қуйидаги схема бўйича кетади:
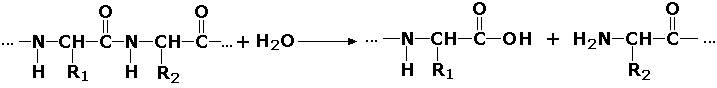
Пептид боғидан фарқ қилувчи C-N боғига таъсир қилувчи ферментлар – органик кислоталар амидларининг гидролизланишини тезлаштиради. Масалан, глутаминаза (L-глутамил-амидогидролаза, КФ 3.5.1.2) буйракларда глутаминнинг гидролизланишини катализ қилиб, организмдаги кислота-асос ҳолатини қўллаб қувватлаб туришда иштирок этади:
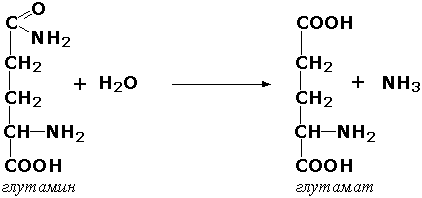
Лиазалар. Лиазалар синфига С—О, С—С, С—N ва бошқа боғларнинг узилишини катализ қилувчи, ҳамда, субстратлардан турли группаларнинг гидролиздан фарқ қилувчи йўллар билан узилишига олиб келувчи қайтар реакцияларни тезлаштирувчи ферментлар киритилган. Бундай реакциялар қўш боғнинг ҳосил бўлиши ёки қўш боғ узилган жойига бошқа группаларнинг боғланиши реакциялари билан ўтади. Бу ферментлар «субстрат-лиазалар» шаклида номланади. Масалан, фумарат-гидратаза (систематик номланиши «L-малат-гидролаза») ферменти олма кислотасидан қайтар реакция ёрдамида сув молекуласининг ажралиб чиқишини ва фумар кислотаси ҳосил бўлишини катализ қилади. Бу синфга декарбоксилазалар (карбоксилиазалар), амидин-лиазалар ва бошқалар киритилган. Бу реакциялар натижасида кўпинча оддий моддалар, масалан, СО2, NH3, H2О ажралиб чиқади.
Углерод-углерод лиазалар – иккита углерод атоми орасидаги боғнинг парчаланишини катализ қилади. Уларнинг орасида декарбоксилазалар, кетокислоталарнинг лиазалари ва альдегидлиазалар (альдолазалар) муҳим аҳамиятга эга, чунки уларнинг таъсири остида α-кето- ва аминокислоталарнинг декарбоксилланиши содир бўлади. Альдозалар синфига кирувчи фруктозодифосфатальдолаза (фруктозо-1,6-дифосфат-D-глицеральдегид-3-фосфат-лиаза, КФ 4.1.2.13) иштирокида қуйидаги реакция катализланади:
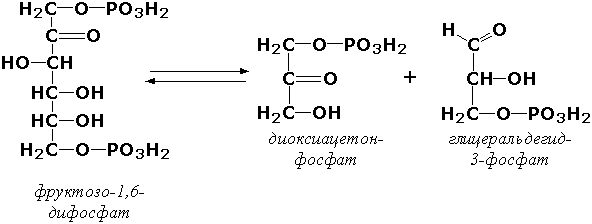
Углерод-кислород лиазалар – углерод ва кислород атомлари орасидаги боғнинг парчаланишини катализ қилади. Бу синф ости группасига биринчи навбатда дегидратация ва гидратация реакцияларида иштирок қилувчи гидролиазалар киритилади. Масалан, сериндегидратаза (L-серин-гидролиаза, дезаминловчи, КФ 4.2.1.3) қуйидаги реакцияни катализ қилади:
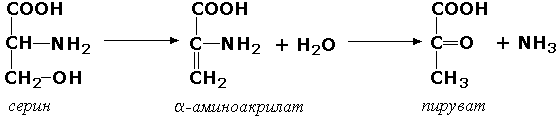
Баъзан ферментнинг ишчи номининг асоси сифатида қайтар реакция олиниши мумкин, бунда «гидратаза» термини ишлатилади. Масалан, уч карбон кислоталар циклининг ферменти L-малат-гидролиаза (КФ 4.2.1.2) учун «фумаратгидратаза» терминини ишлатиш тавсия этилади:
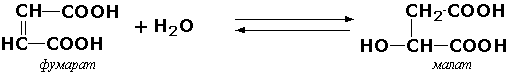
Углерод-азот лиазалар – азот сақловчи группаларнинг узилишида иштирок этадиган ферментлардир. Масалан, гистидин-аммиак-лиаза (L-гистидин-аммиак-лиаза, КФ 4.3.1.3) гистидин аминокислотасининг дезаминланишида иштирок этади:
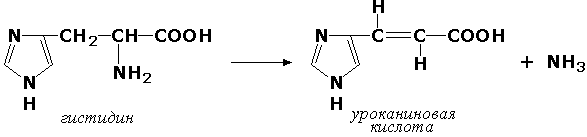
Углерод-олтингугурт лиазалар – сульфгидрил группаларининг узилишини катализ қилади. Бу синфга олтингугурт сақловчи аминокислоталарнинг десульфгидразалари киритилган. Масалан, цистеиндесульфгидраза (L-цистеин-сероводород-лиаза, дезаминловчи, КФ 4.4.1.1).
Изомеразалар. Изомеразалар синфига оптик ва геометрик изомерларнинг ўзаро бир-бирига айланишини катализловчи ферментлар киритилган. Уларнинг систематик номланиши «субстрат – цис-транс-изомераза» шаклида тузилади. Агар изомеризация давомида функционал группанинг ички молекуляр кўчирилиши кузатилса, фермент «мутаза» номини олади. Амино- ва оксикислоталар, углеводлар ҳамда уларнинг ҳосилаларига таъсир қилувчи рацемазалар ва эпимеразалар ҳам, альдоза ва кетозаларнинг ўзаро бир-бирига айланишини катализловчи ички молекуляр оксидоредуктазалар ҳам, ацил-, фосфорил- ва бошқа группаларни кўчириб ўтказувчи ички молекуляр трансферазалар ҳам шу синфга киритилган. Ушбу реакцияларнинг умумий схемаси қуйидагича:
![]() ,
,
бу ерда А ва Á – изомер моддалар.
Изомеразалар сон жиҳатдан кам бўлган ферментлар синфи, бу синф катализ қилинаётган реакция типига қараб қуйидаги синф ости группаларига бўлинади:
Рацемазалар ва эпимеразалар – асимметрик углерод атоми тутган изомерларнинг ўзаро бир-бирига айланишини катализ қилувчи ферментлардир. Рацемазалар битта асимметрик атоми бўлган субстратларга таъсир қилувчи ферментлар. Масалан, L-аминокислоталарни D-аминокислоталарга айлантирувчи ферментлар бор. Улардан бири алaнинрацемаза (аланин-рацемаза, КФ 5.1.1.1) қуйидаги реакцияни катализ қилади:
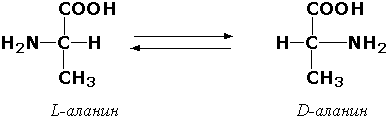
Бир нечта асимметрик углерод атоми бўлган субстратларга таъсир этувчи ферментларга эпимеразалар дейилади. Масалан, УДФ-глюкозо-эпимераза (УДФ-глюкоза-4-эпимераза, КФ 5.1.3.2) ферменти моносахаридларнинг ўзаро бир-бирига айланишида иштирок этади:
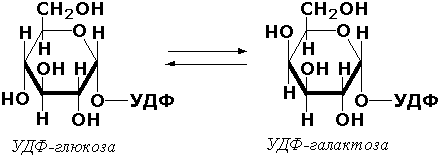
Цис-транс изомеразалар – қўш боғга нисбатан конфигурациянинг ўзгаришини чақирувчи ферментлар. Масалан, малеилацетоацетат-изомераза (малеилацетоацетат-цис-транс-изомераза, КФ 5.2.1.2) ферменти фенилаланин ва тирозиннинг катаболизмида иштирок этиб, малеилацетоацетатни фумарилацетоацетатга айлантиради:
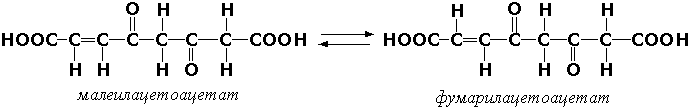
Ички молекуляр оксидоредуктазалар – альдоза ва кетозаларнинг ўзаро бир-бирига айланиши реакцияларини катализ қилувчи ферментлар. Бунда СН-ОН группасининг оксидланиши қўшни С=О группасининг қайтарилиши билан бир вақтда рўй беради. Масалан, триозофосфатизомераза (D-глицеральдегид-3-фосфат-кетол-изомераза, КФ 5.3.1.1) ферменти углевод алмашинувининг реакцияларидан бири бўлган қуйидаги реакцияни катализ қилади:
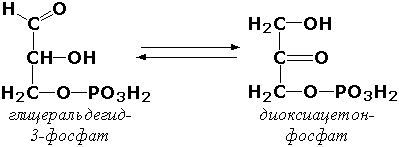
Изомеразаларга бир молекула доирасида битта группани ўша молекуланинг бошқа қисмига ўтказувчи ички молекуляр трансферазалар ҳам, дециклизация, ҳамда бир типдаги ҳалқанинг бошқа типга ўтишини катализ қилувчи ички молекуляр лиазалар ҳам киритилган.
Таъкидлаш лозимки, натижаси изомеризация бўлган биокимёвий жараёнларнинг ҳаммасини ҳам изомеразалар катализ қилавермайди. Масалан, лимон кислотасининг изолимон кислотасига айланиши дегидратация-гидратация реакцияларини катализ қилувчи аконитатгидратаза (цитрат (изоцитрат)-гидролиаза, КФ 4.2.1.3) ферменти бошқаради, бунда оралиқ модда сифатида цис-аконит кислотаси ҳосил бўлади:
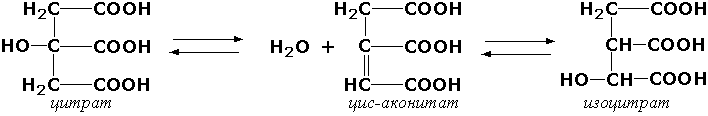
Лигазалар (синтетазалар). Лигазалар синфига АТФ ёки бошқа нуклеозидтрифосфатнинг парчалинишидан ҳосил бўлаётган энергиядан фойдаланиб, иккита дастлабки моддадан органик моддаларнинг синтезини катализловчи ферментлар киритилган. Уларнинг систематик номланиши «X:Y лигаза» шаклида тузилади, бу ерда X ва Y дастлабки моддаларни билдиради. Мисол тариқасида «L-глутамат:аммиак лигаза»ни келтириш мумкин, тавсия этилган қисқартирилган номи «глутаминсинтетаза», бу фермент ёрдамида глутамин кислотаси ва аммиакдан АТФ иштирокида глутамин синтезланади.
КФ.6.4. синф ости ферментлари. Бу ферментлар С-С, С-О, С-N, С-S боғларини ҳосил қилувчи реакцияларда иштирок этади.
С-С боғини ҳосил қилувчи лигазалар. Бу ферментлар углерод скелетига СО2 ни бириктирувчи реакцияларни катализ қилади. Масалан, пируваткарбоксилаза (КФ 6.4.1.1) ферменти иштирокида пируватнинг оксалоацетатга айланиши содир бўлади:
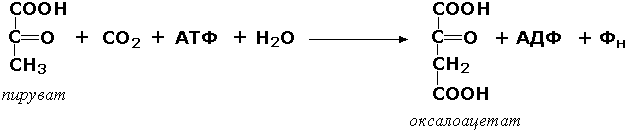
Оксалоацетат уч карбон кислоталар циклининг ва углеводлар биосинтезининг энг муҳим компонентидир.
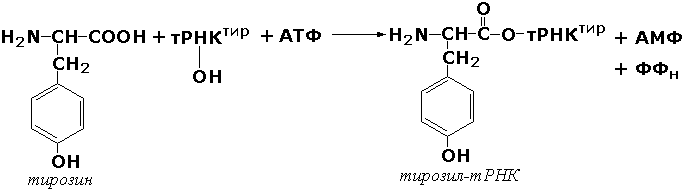
С-О боғини ҳосил қилувчи лигазалар. Бу синф ости группасига аминокислота-тРНК-лигазалар (аминоацил-тРНК-синтетазалар) киритилган, улар аминокислоталарнинг тегишли транспорт РНК лари билан ўзаро таъсирини катализ қилади. Бу реакцияларда рибосомада оқсил синтези жараёнида иштирок эта олувчи аминокислоталарнинг актив шакллари ҳосил бўлади. Мисол тариқасида тирозил-тРНК-синтетаза (L-тирозин:тРНК-лигаза (АМФ-ҳосил қилувчи, КФ 6.1.1.1) ферментини келтириш мумкин:
С-S боғини ҳосил қилувчи лигазалар. Бу синф ости ферментларига ёғ кислоталарининг коэнзим А билан тиоэфирлар ҳосил қилувчи ферментлари киритилган. Бу ферментлар иштирокида ёғ кислоталарининг ацил-КоА – актив шакллари синтез бўлади, улар эса ўз навбатида турли биосинтез реакцияларига киришиш қобилиятига эга бўладилар. Масалан, ацил-КоА-синтетаза (карбон кислотаси : коэнзим А-лигаза (АМФ-ҳосил қилувчи, КФ 6.2.1.2) ферменти иштирокидаги ушбу реакцияни келтириш мумкин:
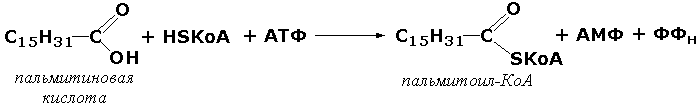
пальмитин кислотаси пальмитоил КоА
С-N боғини ҳосил қилувчи лигазалар. 6.3. Синф ости группасининг ферментлари асосан азот сақловчи группаларни органик моддаларга киритилиши (азотнинг органификацияси) реакцияларини катализ қилади. Бу синф ости группасига қуйидаги 5 та синф ости ости (подподкласс) ферментлари киритилган:
КФ 6.3.1. Амидсинтазалар
КФ 6.3.2. Пептидсинтазалар
КФ 6.3.3. Циклолигазалар
КФ 6.3.4. Бошқа C-N лигазалар
КФ 6.3.5. Глутамин амид группанинг донори сифатида бўлган C-N лигазалар.
6.3.1. Синф ости ости группаси ферментларига - амидсинтазаларга -мисол тариқасида дикарбон аминокислоталарга аммиакнинг боғланиб, амид боғини ҳосил қилувчи реакцияларни катализ қилувчи ферментлар киритилган: – глутамат : аммиак лигаза (глутаминсинтетаза, КФ 6.3.1.2) и аспартат:аммиак лигаза (аспарагинсинтетаза, КФ 6.3.1.1):
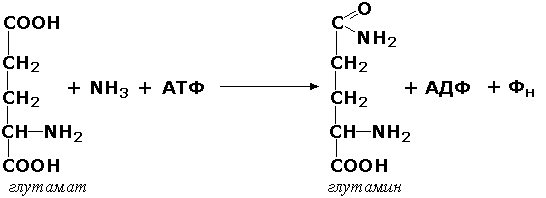
Аспарагиннинг синтези аналогик тарзда ўтади, лекин бу реакция давомида АТФ АМФгача гидролизланади. Глутаминсинтетаза, аспарагинсинтетаза С-N боғини ҳосил қилувчи ферментлар ҳисобланади, бу қаторга яна глутатионсинтаза (КФ 6.3.2.3), убиквитин-протеинлигаза (КФ 6.3.2.19) ферментлари ҳам киритилган.
3. Ферментатив реакциялар кинетикаси. Ферментатив реакциялар кинетикаси – ферментатив реакцияларнинг тезлиги, уларнинг турли факторларга боғлиқлиги ҳақидаги фандир. Ферментатив реакциянинг тезлиги реакцияга киришган субстрат ёки вақт бирлиги давомида ҳажм бирлигида маълум вақт ичида ҳосил бўлган маҳсулот билан белгиланади:
V = Δс/t
бу ерда V – ферментатив реакция тезлиги, Δс - субстрат ёки реакция маҳсулоти концентрациясининг ўзгариши, t – вақт.
Ферментатив реакциянинг тезлиги ферментнинг активлигини белгилаб берувчи табиатига боғлиқ. Ферментнинг активлиги қанча юқори бўлса, реакция тезлиги ҳам шунча юқори бўлади. Ферментнинг активлиги фермент катализ қилаётган реакциянинг тезлиги бўйича аниқланади. Фермент активлигининг ўлчови – фермент активлигининг 1 стандарт бирлиги дейилади. Фермент активлигининг 1 стандарт бирлиги – 1мкмоль субстратни 1 минут давомида катализ қилиш учун кетган фермент миқдоридир.
Ферментатив реакция давомида фермент (Е) субстрат (S) билан таъсирлашади, натижада фермент-субстрат комплекси ҳосил бўлади, кейинчалик бу комплекс ферментни ажратиб чиқариб ва маҳсулотни (Р) ҳосил қилиб парчаланади, 49-расм:
E + S ↔ ES → E + P
фермент актив комплекс фермент
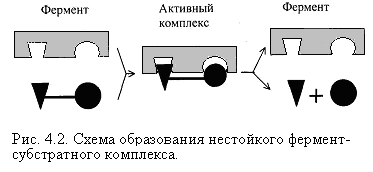
субстрат реакция маҳсулотлари
49-расм. Фермент-субстрат комплексининг ҳосил бўлиши
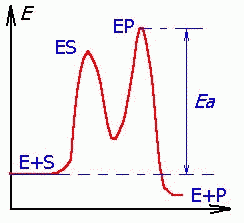
50-расм. Ферментатив катализ мувозанатга эришишни тезлаштиради, кўпинча бу жараён босқичли кетади. Жараённинг уч босқичи: 1) E + S ----- ES (K = k1/k-1) (тез);
2) ES ----- EP (k2) (секин); 3) EP ---- E + P. Мувозанат моментида ES фермент-субстрат комплексининг ҳосил бўлиш ва йуқолиш тезлиги ўзаро тенг:
E + S ---- ES ----- EP --- E + P
Ферментатив реакция тезлиги жуда кўп омилларга боғлиқ: субстратнинг ва ферментнинг концентрацияси, температура, муҳитнинг рН қиймати, ферментнинг активлигини кўтарувчи ёки пасайтирувчи турли регулятор моддаларнинг борлиги.
Ферментлардан медицинада турли касалликларни диагностика қилишда фойдаланилади. Миокард инфаркти касаллигида юрак мушакларининг зарарланиши ва парчаланиши оқибатида қонда аспартаттрансаминаза ва аланинаминотрансфераза ферментларининг миқдори кескин ошиб кетади. Уларнинг активлигини аниқлаш ушбу касалликни аниқлашда (диагноз қўйишда) ёрдам беради.
Субстрат ва фермент концентрациясининг ферментатив реакция тезлигига таъсири. Субстратнинг концентрацияси паст бўлган ҳолларда реакция тезлиги унинг концентрациясига тўғри пропорционал, кейинчалик концентрация ортиши билан реакция тезлиги ҳам секин ошиб боради, субстратнинг концентрацияси жуда юқори бўлганида реакция тезлиги концентрацияга боғлиқ бўлмай қолади ва ўзининг максимал қийматига эга бўлади (Vmax).
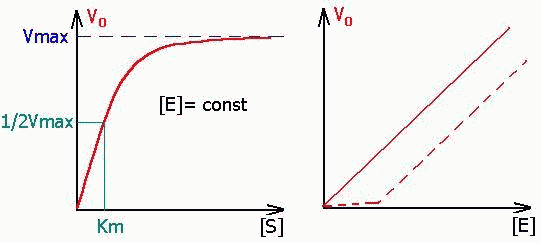
51-расм. Ферментатив реакция тезлигининг субстрат концентрациясига боғлиқлиги:
Е – чизиқли боғлиқлик, S-гиперболик боғлиқлик. Бу деган сўз, S нинг кичик қийматларида реакция биринчи тартибли, кейинчалик у ноль тартибига ўтади. Ферментатив реакция тезлигининг фермент концентрациясига боғлиқлиги графигида пунктир чизиқ билан ингибиторларнинг реакция тезлигига боғлиқлиги кўрсатилган – бунда ингибитор таъсирини ферментнинг ортиб бораётган миқдори енгиб ўтадиган моментгача тезлик секинлик билан ортиб бориши кўрсатилган
Субстратнинг бундай концентрацияларида ферментнинг барча молекулалари фермент-субстрат комплекси таркибида бўлади, фермент актив марказларининг тўлиқ тўйиниши содир бўлади, айнан шунинг учун ҳам реакция тезлиги субстратнинг концентрациясига боғлиқ бўлмай қолади, 51-расм.
Фермент активлигининг субстрат концентрациясига боғлиқлиги графиги Михаэлис-Ментен тенгламаси билан ифодаланади:
V
=
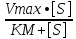
Бу ерда V – ферментатив реакция тезлиги [S] – субстрат концентрацияси, KM –Михаэлис константаси. V = ½ Vmax бўлганида KM = [S] бўлади, демак, Михаэлис константаси реакция тезлиги максимал тезликнинг ярмига тенг бўлган ҳолатдаги субстратнинг концентрациясига тенг, 52-расм:
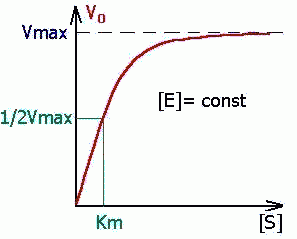
52-расм. Михаэлис константаси моль/л да ўлчанади, Кm қанча кичик бўлса, фермент шунча актив бўлади. V=1/2Vmax да Km = [S]. Лекин Vmaxни асимптота бўйича аниқлаш қийин, шунинг учун Ханс Лайнуивер ва Дин Бэрк тенгламанинг чап ва ўнг тарафларининг тескари боғланишларини тенглаштиришган:
![]()
Лайнуивер-Бэрк координаталарида тезликнинг график ифодаси Х ўқида 1/Km, Y ўқида 1/Vmax қийматларини кесиб ўтувчи тўғри чизиқ кўринишига эга:
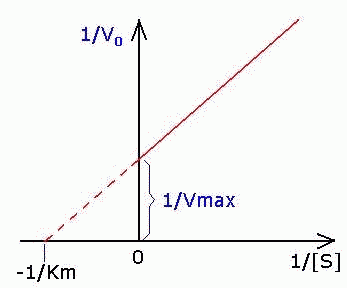
53-расм. Лайнуивер-Бэрк координаталарида ферментатив
реакция тезлигининг график ифодаси
Ферментатив реакция тезлигининг фермент концентрациясига боғлиқлиги. Ферментатив реакция тезлиги ферментнинг концентрациясига ҳам боғлиқ, ва бу боғланиш тўғри чизиқли характердадир, 54-расм:
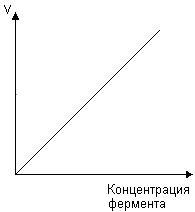
54-расм. Ферментатив реакция тезлигининг фермент концентрациясига боғлиқлиги
Ферментатив реакция тезлигига температуранинг таъсири. Паст температураларда (~40-50°С) температуранинг ҳар 10°С га ортиши, Вант-Гофф қоидасига кўра, кимёвий реакция тезлигининг 2-4 марта ортишига олиб келади. 55-60°С ва ундан юқори температураларда ферментнинг активлиги унинг денатурацияси туфайли кескин пасаяди, ва шунинг оқибатида ферментатив реакциянинг тезлиги ҳам кескин пасаяди. Ферментларнинг максимал активлиги одатда 40-60°С оралиғига тўғри келади. Ферментнинг активлиги максимал бўлган температура «температура оптимуми» дейилади.
Ферментлар
учун тезлик константаси ва температура
ўртасидаги боғланиш 2,3lgK
= B - Ea/RT
билан ифодаланади, бу ерда Еа
- активация энергияси, В – тўқнашишлар
сони. Бу кўрсатилган чизиқли боғланиш
фақат чекланган бўлакдагина тўғридир,
чунки температура қиймати ортиши билан
ферментнинг денатурацияси кузатилади,
55-расм.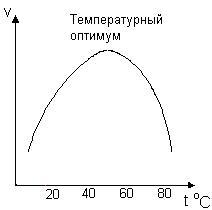
55-расм. Ферментатив реакция тезлигининг температурага боғлиқлиги
Ферментатив реакция тезлигига рН қийматининг таъсири. Ферментнинг активлиги максимал бўлгандаги муҳитнинг рН қиймати «ферментнинг рН оптимуми» деб аталади (4-жадвал). рН оптимумнинг қийматлари турли ферментлар учун кенг интервалда бўлиши мумкин, 56-расм.
.56-расм.
Ферментатив реакция тезлигига рН
қийматининг таъсири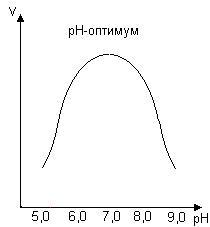
4-жадвал. Баъзи ферментларнинг рН оптимуми қийматлари
|
Фермент |
рН-оптимум |
|
Пепсин |
1,5 |
|
Фосфатаза |
5,8 |
|
Уреаза |
6,7 |
|
Трипсин |
7,7 |
|
Каталаза |
7,6 |
|
Аргиназа |
9,7 |
Ферментатив реакциянинг рН қийматига боғлиқлиги характери шу билан белгиланадики, бу кўрсаткич қуйидаги ҳолатларга таъсир ўтказади:
- катализда иштирок қилаётган аминокислоталарнинг ионизацияси
- субстратнинг ионизацияси
- ферментнинг ва унинг актив марказининг конформацияси.
Фермент активлигининг рН қийматига боғлиқлиги ҳам максимум орқали ўтади. Муҳитнинг кислоталилиги фермент молекуласининг зарядларига таъсир қилади, ва шу орқали унинг субстратни бириктириб олиш қобилиятига ҳам таъсир ўтказади.
Фермент активлигининг бирликлари:
Е (стандарт бирлик) – 1 мкмоль субстратни 1 минут давомида ўзгартирган фермент миқдори
КАТАЛ. – субстратни 1моль/сек тезликда ўзгартирган фермент миқдори
1 КАТАЛ = 60 000 000 Е.
4. Ферментларнинг актив марказлари, уларни активлаштирувчилари ва ингибиторлари. Фермент таъсир этаётганида дастлабки ҳодиса унинг лиганд – субстрат билан специфик боғланишининг содир бўлишидир. Бу ҳодиса унинг бир нечта специфик группалари – фазода ўзига хос ориентацияланган аминокислоталаридан иборат бўлган актив маркази соҳасида рўй беради. Ферментатив реакцияларда иштирок этувчи субстратларнинг молекулалари кўпинча ферментларнинг молекулаларига нисбатан анча кичик бўлгани учун фермент-субстрат комплекслари ҳосил бўлишида, субстратнинг молекуласи билан пептид занжирининг чекланган сондаги аминокислоталари реакцияга киришади, деган тахмин билдирилган. Бу тахмин асосида ферментниг актив маркази ҳақидаги тасаввур ҳосил бўлган. Ферментнинг актив маркази деганда фермент молекуласининг субстрат молекуласи билан бевосита боғлана оладиган ва катализ актида иштирок этадиган аминокислота қолдиқларининг уникал комбинациясини тушуниш керак (57-расм). Мураккаб ферментлар актив марказига простетик группалар ҳам кириши мумкинлиги аниқланган.
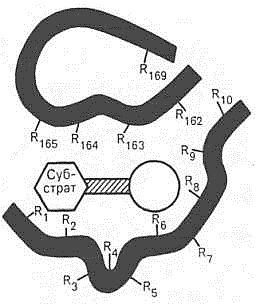
57-расм. Ферментнинг актив маркази схемаси: қора рангда – ферментнинг пептид занжири бўлаклари, R – аминокислота қолдиқлари ва уларнинг тартиб номерлари
(N-охиридан бошлаб)
Масалан, химотрипсин ферментининг актив марказида гистидиннинг 2 та қолдиғи ва сериннинг 1 та қолдиғи борлиги экспериментал аниқланган (58-расм):

58-расм. Химотрипсин молекуласининг гипотетик учламчи структураси. Пушти ранг билан серин ва гистидин қолдиқлари кўрсатилган. Стрелка билан полипептид занжирининг N-охирги участкасидаги узилиш жойи кўрсатилган
Ферментнинг актив марказида шартли равишда субстрат билан бевосита ўзаро таъсирга киришувчи каталитик бўлимни ва субстратга мойилликни таъминловчи ҳамда унинг фермент билан комплексини шакллантирувчи боғлаш бўлимини ажрата олиш керак. Ферментлар структурасида, уларнинг ўзига хослиги ва таъсир механизмининг хилма-хил бўлишига қарамасдан, актив марказлар ҳосил бўлишида қатор умумий қонуниятлар кўзга ташланади:
-
Актив марказ ферментнинг нисбатан кичик қисмини эгаллайди (5-10 та аминокислота қолдиқлари). Қолган аминокислоталар фермент полипептид занжирининг тўғри конформацияни эгаллашини ва кимёвий реакция оптимал ўтишини таъминлаш учун хизмат қилади.
-
Ферментнинг актив маркази – аминокислоталар кетма-кетлигининг турли қисмларига тааллуқли бўлган группалар иштирок этган мураккаб уч ўлчамли структурадир. Актив марказни ҳосил қилган аминокислоталар радикаллари оқсилнинг учламчи структураси шаклланиши натижасида бир-бирига яқин жойлашиб қолади. Денатурацияга олиб келувчи физик ва кимёвий факторлар таъсирида актив марказ конформациясини йўқотади ва фермент ҳам ўз активлигини йўқотади.
-
Актив марказ – сув реакцияга киришувчи реагент бўлган ҳолатлардан мустасно ҳолда, ичига сув кириши чекланган ингичка чуқурланиш ёки тешик шаклига эга бўлади. Мана шу чуқурланишда субстратни бириктириб олиш ва катализ учун зарур бўлган бир нечта қутбли аминокислоталарнинг қолдиқлари жойлашган бўлади.
-
Актив марказ таркибида шартли равишда икки қисмни ажратиб кўрсатиш мумкин: а) субстратни керакли ориентацияда бириктириб олувчи контакт ёки «якорь» қисми ва б) реакция ўтишини таъминловчи каталитик қисм. Каталитик ва контакт қисмлари ўртасида аниқ чегарани кўрсатиш ҳар доим ҳам мумкин эмас – баъзи ферментларда улар бир-бирига қўшилган бўлади ёки бири иккинчисини ёпиб туради, 59-расм:
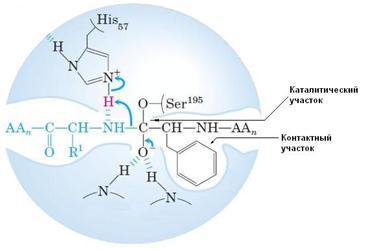
59-расм. Химотрипсин ферментининг актив маркази. Катализ учун принципиал муҳим бўлган Ser195 и His57 қолдиқлари кўрсатилган
-
Ферментларнинг ўлчами субстратларнинг ўлчамидан анча катта бўлади.
-
Субстратлар ферментлар билан нисбатан кучсиз боғланади. Субстратларни бириктириб олиш ва ўзгартиришда аминокислота радикалларининг қуйидаги группировкалари иштирок этади:
- қутбли зарядланган: глутамат ва аспартатнинг СООН группалари, лизиннинг аминогруппаси, аргининнинг гуанидин группаси, гистидиннинг имидазол группаси.
- қутбли зарядланмаган: серин ва треониннинг ОН группалари, цистеиннинг сульфгидрил группалари, тирозиннинг фенол группалари.
- қутбсиз группалар: алифатик аминокислоталарнинг углеводород занжирлари, фенилаланин ва триптофаннинг ароматик ҳалқаси.
Мураккаб ферментларда актив марказнинг шаклланишида коферментларнинг функционал группалари ҳам иштирок этади. Фермент-субстрат комплексларининг ҳосил бўлишида ҳам макромолекулаларнинг фазовий структурасининг шаклланишини таъминлаб беришда иштирок этган, ҳужайралараро контактларни ва биологик системалардаги бошқа жараёнларда қатнашган ўзаро таъсирлар иштирок этади:
- субстрат ва ферментнинг қутбли зарядланмаган группировкалари ўртасидаги водород боғлар
- субстрат ва ферментнинг қарама-қарши зарядланган группировкалари ўртасидаги ионли боғлар
- субстрат ва ферментнинг қутбсиз группировкалари ўртасидаги гидрофоб ўзаро таъсирлар.
Ковалент бўлмаган мана шу уч асосий ўзаро таъсир ўзининг геометрияси, энергияси ва спецификлиги билан фарқланади.
Ферментларнинг активаторлари. Ферментлар активлигини бошқариш уларнинг турли биологик компонентлар ёки бегона бирикмалар билан ўзаро таъсири натижасида амалга ошади, бундай моддаларга регуляторлар дейилади. Ферментларнинг каталитик активлигини оширувчи моддаларга активаторлар дейилади. Уларнинг қуйидаги турлари ажратиб кўрсатилади:
-
Актив марказ соҳасига таъсир қилувчи моддалар. Одатда ферментларнинг активаторлари турли металларнинг ионларидир: Na+, K+, Fe2+, Co2+, Cu2+, Ca2+, Zn2+, Mg2+, Mn2+ ва ҳ-золар. Қатор ҳолатларда металл ионлари ферментнинг кофактори функциясини бажаради. Бошқа ҳолларда эса улар субстратнинг актив марказга бирикишига ёрдам беради. Металл ионлари организмда дефицит ҳолида бўлгандагина активатор бўла олади.
-
Аллостерик эффекторлар – апоферментнинг (ферментнинг оқсил қисмининг) аллостерик (регулятор) қисми билан боғланадилар. Бу боғланиш оқсил молекуласида актив марказнинг структурасини ўзгартирувчи конформацион ўзгаришларни келтириб чиқаради, бу эса ўз навбатида субстратнинг актив марказ билан боғланишига ва унинг актив марказда ўзгаришига таъсир қилади. Бунда ферментнинг активлиги ортиши ҳам мумкин (аллостерик активаторлар), камайиши ҳам мумкин (аллостерик ингибиторлар). Ферментларнинг аллостерик эффекторлари сифатида кўпинча турли метаболитлар, гормонлар, металл ионлари, нуклеозидлар - АТФ, АДФ, АМФ хизмат қилади.
Каталитик функцияни амалга оширишдан ташқари каталитик активликни орттирувчи ёки пасайтира олувчи ферментларга аллостерик ферментлар дейилади. Бундай ферментларнинг таъсири туфайли метаболик реакциялар ҳар бир кетма-кетлигининг тезлиги бир зумда ҳужайранинг талабларига ва шароитига мослашиб, ўзгариши мумкин, 60-расм.
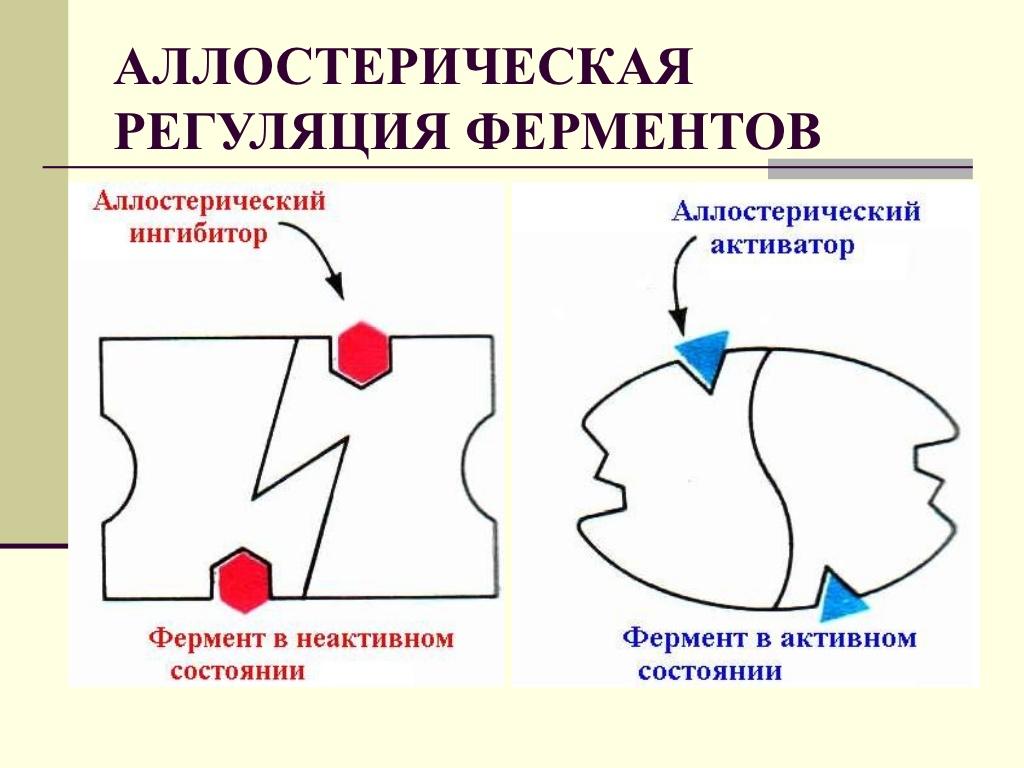
а б
60-расм. Аллостерик ингибирланиш (а), аллостерик активация (б)
-
Ферментнинг актив марказига тегмасдан модификацияларни келтириб чиқарувчи моддалар. Бундай модификацияларнинг бир нечта варианти мавжуд.
Ферментларнинг ингибиторлари. Ингибирлашнинг иккита асосий йўналишини ажратиб кўрсатиш мумкин:
-
Ферментнинг ингибитор билан боғланиш мустаҳкамлигига қараб ингибирлаш қайтар ва қайтмас бўлади
-
Ингибиторнинг фермент актив марказига муносабатига қараб конкурент ва ноконкурент ингибирланиш бўлади.
Ⱪайтмас ингибирланишда фермент активлигини намоён қилиши учун зарур бўлган функционал группаларининг боғланиши ёки парчаланиши содир бўлади. Масалан, диизопропилфторфосфат моддаси асаб синапсларидаги ацетилхолинни гидролизловчи ацетилхолинэстераза ферментининг актив марказидаги серин аминокислотасининг ОН группаси билан қайтмас боғлана олади. Бу ферментнинг қайтмас ингибирланиши ацетилхолиннинг синаптик тешикда парчаланишининг олдини олади, натижада медиатор ўзининг рецепторларига таъсир этишни давом эттиради, бу эса холинэргик регуляцияни назоратсиз кучайишига олиб келади.
Диизопропилфторфосфат, шунга ўхшаш тарзда, актив марказида серин тутган химотрипсин ва бошқа протеазаларни (серинли протеазаларни) ингибирлайди.
Диизопропилфторфосфат – асаб-паралитик заҳарли моддалар сирасига киради, унга ўхшаган фосфорорганик моддалар аналогик тарзда таъсир қилади (зарин, зоман). Карбофос, дихлофос инсектицидлари таркибига кирган «малатион» моддаси ҳам шу қатордан ўрин олган, ва ҳашаротларнинг организмида ацетилхолинэстеразанинг ингибиторига айланади, одам ва ҳайвонлар организмида эса зарарсиз моддаларгача парчаланади.
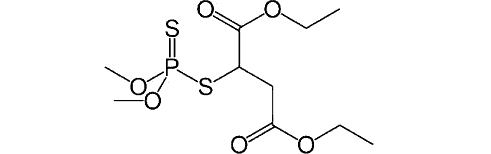
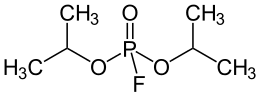
Малатион Диизопропилфторфосфат
Яна бир мисол - простагландинлар синтезидаги асосий фермент – циклооксигеназанинг ацетилсалицил кислотаси билан ингибирланишидир. Бу кислота яллиғланишга қарши воситалар таркибига киради. Ацетил группа ферментнинг актив марказидаги сериннинг ОН группасига бирикиши унинг инактивациясига ва простагландинлар синтезининг тўхташига олиб келади, 61-расм:
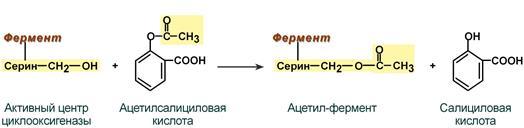
циклооксигеназанинг ацетилсалицил ацетил-фермент салицил кислотаси
актив маркази кислотаси
61-расм. Циклооксигеназанинг қайтмас ингибирланиши механизми
Ⱪайтар ингибирланишда ингибитор ферментнинг актив марказидаги функционал группалар билан кучсиз боғланади, натижада ферментнинг активлиги секин-аста тикланади. Масалан, қайтар ингибирланишга мисол тариқасида ацетилхолинэстеразанинг актив маркази билан боғлана олувчи прозеринни келтириш мумкин. Холинэстераза ингибиторлари группасига кирувчи прозерин, дистигмин, галантамин моддалари миастения, энцефалит, менингит, марказий асаб системасининг травмаларини даволашда ишлатилади.
Конкурент ингибирлаш. Бунда ингибитор ўз структураси бўйича ферментнинг субстратига ўхшаш бўлади. Шунинг учун у субстрат билан ферментнинг актив маркази билан контакт қилиш учун рақобатлашади. Бу эса ўз навбатида субстратнинг фермент билан боғланиш даражасини пасайтиради ва катализ жараёнини бузади. Конкурент ингибирлашнинг моҳияти ҳам шунда – субстрат концентрациясини ўзгартириш орқали ингибирланишни кучайтириш ёки пасайтириш мумкин, масалан:
-
Этанол ва метанолнинг алкогольдегидрогеназанинг актив маркази учун конкурент ўзаро таъсири.
-
Уч карбон кислоталар циклининг ферменти – сукцинатдегидрогеназанинг, бу ферментнинг субстрати - қаҳрабо кислотасининг структурасига ўхшаш бўлган, малон кислотаси билан ингибирланиши, 62-расм:
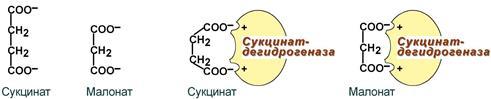
62-расм. Сукцинатдегидрогеназанинг конкурент ингибирланиши
Ноконкурент ингибирлаш. Ингибирлашнинг бу тури ингибиторнинг актив марказга эмас, балки молекуланинг бошқа жойи билан бирикиб қолиши билан боғлиқ. Аммо, бунда актив марказ структураси ўзгаради ва субстрат билан боғланиш мумкин бўлмай қолади. Бу ферментнинг активлиги табиий модуляторлар билан пасайтирилгандаги аллостерик ингибирланиш бўлиши мумкин, ёки ферментнинг актив ва аллостерик марказдан ташқари бирор модда билан боғланиши натижасида содир бўлиши мумкин.
Масалан:
- синиль кислотаси (цианидлар) нафас олиш занжири ферментлари (цитохромоксидаза) геми таркибидаги темир билан бирикиб ҳужайра нафас олишини блоклайди.
- оқсилларнинг SH-группалари томонидан оғир металлар ионларининг (Cu2+, Hg2+, Ag+) бириктирилиши.
Ноконкурент ингибирланишнинг ўзига хослиги шундаки, ингибитор модда фермент билан, субстратдан мустақил равишда, боғлана олади, яъни субстрат концентрациясини ўзгартириш «фермент-ингибитор» комплексининг ҳосил бўлишига таъсир қила олмайди.
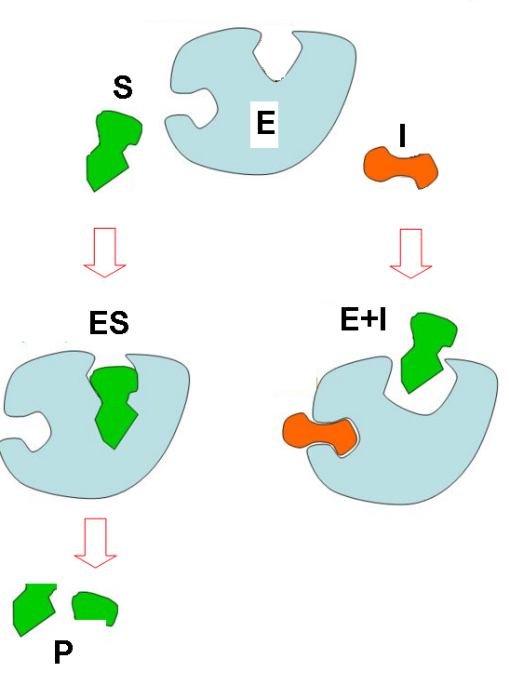
63-расм. Ноконкурент ингибирланиш
Конкурентсиз
ингибирлаш.
Бу ҳолда ингибитор фермент-субстрат
комплекси билан унинг актив марказида
бирикади. Субстрат концентрациясини
ошириш, фермент-субстрат комплекси
миқдорининг ортишига олиб келади, ва
ингибиторнинг боғланишини ҳам орттиради.
Шунинг учун ҳам конкурентсиз ингибирлаш
бошқа тур ингибирлашлардан фарқли
равишда мураккаброқдир.
Мисол тариқасида
бактериялар ҳужайра деворининг синтезида
пептидогликан занжирларининг уланишини
таъминлаб берувчи транспептидаза
ферментининг пенициллин билан боғланишини
келтириш мумкин. Пенициллин ферментнинг
актив марказига бирикиб олади, унинг
лактам ҳалқаси ферментнинг оралиқ
ҳолатига - фермент-субстрат комплексига
- ўхшашликни мимикриялагандек бўлади.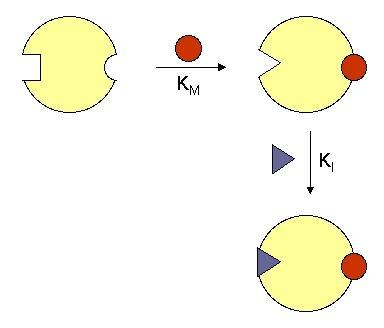
64-расм. Конкурентсиз ингибирлаш
Аралаш ингибирлаш. Бунда ингибитор фақат актив марказга эмас, балки молекуланинг бошқа қисмларига ҳам бирика олади. Фақат бу ҳолатда фермент қисман бўлса ҳам активлигини сақлаб қолган бўлади. Масалан, симоборганик бирикма бўлган мертиолатнинг микромицет замбуруғлар ривожланишини пасайтириш мақсадида уларнинг ферменти бўлган сахаразага таъсирини келтириш мумкин.
Ингибирланиш типини аниқлаш:
-
Конкурент ингибитор Кm ни оширади ва Vmax ни ўзгартирмайди.
-
Ноконкурент ингибитор Кm ни ўзгартирмайди ва Vmax ни пасайтиради.
-
Конкурентсиз ингибирлаш Кm ва Vmax ни бир хил даражада пасайтиради.
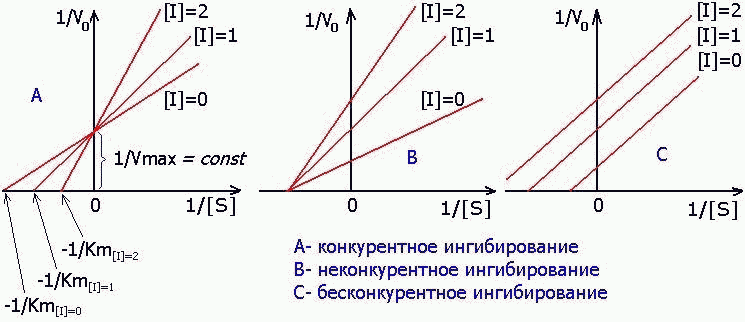
65-расм. Ингибирланиш типини аниқлаш
5. Кооператив таъсирлар. Аллостерик ферментлар. Кооперативлик тушунчаси шуни билдирадики, бир лиганднинг оқсилга (ферментга) бирикиши ўша оқсилнинг иккинчи молекула лигандни бириктириб олиш хусусиятини ёки оширади, ёки камайтиради. Агар модификация бириктириб олиш хусусиятини орттирса – ижобий кооперативлик, камайтирса – салбий кооперативлик дейилади.
Бири иккинчисининг бирикишига таъсир кўрсатаётган иккита лиганд кимёвий жиҳатдан бир хил бўлиши мумкин, масалан субстратнинг бир молекуласи иккинчи молекуланинг бирикишини ўзгартиради. Бундай таъсирга гомотроп эффект дейилади. Агар улар кимёвий жиҳатдан фарқ қилсалар, масалан, ингибиторнинг субстрат бирикишига таъсири - гетеротроп эффект дейилади.
Боғланиш сайтлари кўп бўлган ферментлар учун кооператив таъсир этиш характерлидир. Фазавий ўзгаришлар даврида – суюқланиш, ечилиш - кооператив таъсир бир хил суббирликларга эга бўлган катта молекулалар учун ҳам хос, масалан ДНК, оқсиллар, фосфолипидлар.
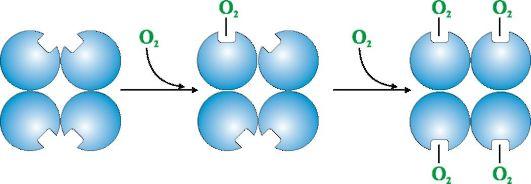
Ижобий кооператив таъсирга гемоглобин макромолекуласи тарафидан кислородни бириктириб олиш мисол бўла олади (66- ва 67-расм). Гемоглобиннинг кооператив таъсири уни эффектив кислород ташувчисига айлантиради. Олигомер оқсиллар протомерларининг ўзаро бир-бирига таъсири кооператив таъсир деб аталади. Ўпкада суббирликларнинг мана шундай ўзаро таъсири гемоглобиннинг кислородга бўлган мойиллигини оширади ва кислороднинг гемоглобинга бирикишини ~300 марта ошириб юборади. Тўқималарда қайтар жараён амалга ошади, яъни, кислородга мойиллик пасаяди, кислородни бериш тезлиги ҳам ~300 мартагача камаяди.
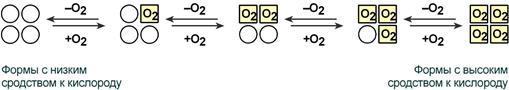
кислородга мойиллиги кислородга мойиллиги
паст бўлган шакллар юқори бўлган шакллар
66-расм. Гемоглобин суббирликларининг кооператив таъсири
67-расм. Гемоглобин протомерлари конформациясининг кислород
бирикишида кооператив ўзгариши
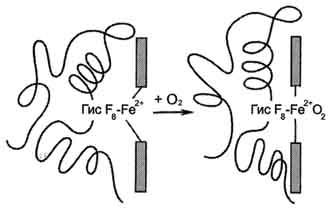
68- расм. Гемоглобинга кислород бирикишида Fe2+ ва оқсил қисми
жойлашишининг ўзгариши
Ушбу феномен шу билан тушунтириладики, ўпкада темирга биринчи молекула кислороднинг боғланишида темир атоми гемнинг текислигига тортилади, кислород текисликдан ташқарида бўлади (68-расм). Бу оқсил занжирининг бир қисмининг силжишига ва биринчи протомер конформациясининг ўзгаришига олиб келади. Мана шундай ўзгарган протомер бошқа қолган суббирликларга таъсир этади ва кислороднинг иккинчи суббирлик билан бирикишини осонлаштиради. Бу эса ўз навбатида қолган протомерларнинг конформациясининг ўзгаришига олиб келади ва ҳоказо.
Аллостерик ферментлар. Ҳужайранинг нормал ҳаёт фаолиятини таъминлаш учун кўпчилик метаболитлар концентрациясини жуда нозик бошқариш талаб этилади. Реакция тезликларининг кенг диапазонда ўзгаришига тезда жавоб реакция қилиш талаб этилганда ва ҳужайранинг узлуксиз ўзгариб турувчи функционал ҳолатига жавоб тариқасида ҳужайрада субстратларнинг етарли концентрацияларининг тор диапазони бор. Аввал ўтказилган ҳисоблашлар шуни кўрсатадики, ферментатив реакцияларнинг тезлиги субстрат концентрациясининг ўзгаришларига у қадар сезгир эмас. Масалан, Vmax тезликни 0,1 дан 0,9 гача ортиши субстрат концентрациясини 81 марта ортишини тақозо этади. Шунга ўхшаш рақамлар ингибиторлар таъсирини ҳам характерлайди. Метаболитларнинг ўзгаришларини бошқарувчи ферментлар субстратларнинг ҳам, ингибиторларнинг ҳам концентрацияларининг ўзгаришига сезгирроқ бўлиши керак. Шунинг учун табиатнинг ўзи бир параметрдаги кичик ўзгариш тезликнинг катта ўзгаришига олиб келувчи «кооператив системалар»га мурожаат қилган. Бундай ишнинг график натижаси – реакция тезлигининг субстрат концентрациясига боғлиқлиги – гипербола билан эмас, S-симон сигмоид эгри чизиқ билан ифодаланишида ўз аксини топган. Бундай кооператив системалардан иборат ферментларнинг кўп оилалари мавжуд, улар аллостерик ферментлардир.
Аллостерик ферментлар деб активлиги уларнинг субстратлари билан эмас, балки ферментларнинг актив марказидан узоқда жойлашган ўзига хос қисмларида бирика оладиган бошқа моддалар билан бошқариладиган ферментларга айтилади. Бундай моддалар ферментнинг активлигига таъсир кўрсатиб, унинг актив марказида қайтар ўзгаришларни келтириб чиқара олади. Бундай моддаларга аллостерик эффекторлар дейилади. Уларнинг ферментнинг субстратга мойиллигини кучайтириши ёки пасайтириши таъсири характерига қараб эффекторлар аллостерик активаторлар (реакцияни тезлаштирувчи) ва аллостерик ингибиторларга (реакцияни тормозловчи) бўлинади. Аллостерик ферментларга мисол тариқасида фосфофруктокиназани келтириш мумкин. Бу фермент фруктозо-6-фосфатдан фруктозо-1,6-бисфосфат ҳосил бўлиши реакциясини катализ қилади. Бу реакция нафас олиш жараёнлари босқичларидан бири бўлган гликолиз давомида содир бўлади. АТФ, агар унинг концентрацияси юқори бўлса, фосфофруктокиназани аллостерик ингибирлайди. Ҳужайра метаболизми кучайиб, АТФ нинг сарф бўлиши ошса, ва демак унинг концентрацияси пасайса, бу метаболик йўл яна ҳаракатга - амал қилишга тушади (69-расм).
Аллостерик оқсиллар лигандларни бириктириб олувчи ва бир-бири билан функционал ўзаро таъсирлаша олувчи икки ва ундан кўп топологик ҳар хил марказларга эга бўлган оқсиллардир. Лиганднинг бир марказ билан боғланиши иккинчи (ва бошқа марказларни ҳам), марказнинг хоссаларини ҳам ўзгартиради. Аллостерик оқсилларнинг катта қисми аллостерик ферментлардир. Барча аллостерик ферментлар ва оқсиллар полимер ёки тўртламчи структурага эга. Ҳақиқий аллостерик оқсил қатор оқсил занжирларидан ёки суббирликлардан тузилган бўлади. Аллостерик оқсил функцияларини амалга ошириши учун полимер структурага эга бўлиши унинг ҳал қилувчи функциясидир.
69-расм.
АТФнинг фосфофруктокиназага аллостерик
таъсир этиши механизми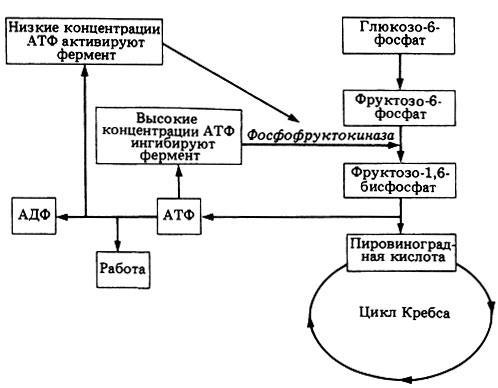
Мавзуни қайтариш учун саволлар:
-
Ферментлар деб қандай моддаларга айтилади?
-
Ферментларнинг замонавий классификацияси ва номенклатураси ҳақида маълумот беринг.
-
Оксидоредуктазаларнинг функциялари нимадан иборат? Уларнинг қандай турлари бор?
-
Трансферазаларнинг функциялари нимадан иборат? Уларнинг қандай турлари бор?
-
Гидролазаларнинг функциялари нимадан иборат? Уларнинг қандай турлари бор?
-
Лиазаларнинг функциялари нимадан иборат? Уларнинг қандай турлари бор?
-
Изомеразаларнинг функциялари нимадан иборат? Уларнинг қандай турлари бор?
-
Лигазаларнинг функциялари нимадан иборат? Уларнинг қандай турлари бор?
-
Ферментатив реакциянинг тезлиги қайси омилларга боғлиқ?
-
Субстрат ва фермент концентрациясининг ферментатив реакция тезлигига қай тарзда таъсир этади?
-
Фермент активлигининг субстрат концентрациясига боғлиқлигини ифодаловчи Михаэлис-Ментен тенгламасини ёзинг ва унинг физик маъносини тушунтириб беринг.
-
Ферментнинг лиганд – субстрат билан специфик боғланиши қандай амалга ошади?
-
Ферментнинг актив маркази деганда нимани тушуниш керак?
-
Ферментлар структурасининг ўзига хослиги ва таъсир механизмининг хилма-хил бўлишига қарамасдан актив марказлар ҳосил бўлишида мавжуд бўлган умумий қонуниятларни санаб ўтинг
-
Ферментларнинг активаторлари ҳақида маълумот беринг
-
Ферментларнинг ингибиторлари ҳақида маълумот беринг
-
Ингибирланишнинг қандай турлари мавжуд?
-
Конкурент ингибирланиш ва ноконкурент ингибирланиш орасидаги фарқ нимадан иборат?
-
Аллостерик ферментларга таъриф беринг
-
Аллостерик оқсиллар қандай бирикмалар?
