
- •Аминокислоталар, пептидлар, оқсиллар
- •Оқсилларнинг аминокислота таркибини аниқлаш
- •Оқсилларнинг тузилиши
- •Оқсил ва пептидларнинг кимёвий синтези
- •Оқсиллар ва пептидларнинг кимёвий модификацияси
- •40000 Марта катталаштирилган
- •Ферментлар
- •Ферментларнинг каталитик фаоллиги сабаблари
- •Ҳимоя оқсиллари
- •2. Антитаналарнинг изотиплари. Улар константа қисмининг типи орқали аниқланади. Баъзи изотиплар бириктирувчи занжир ёрдамида димерларни (IgA), ёки пентамерларни (IgM) ҳосил қилади.
- •Иммун жавоб медиаторлари - цитокинлар
- •Яллиғланиш медиаторларининг классификацияси
- •Тўқима лизокиназалари, стрептокиназа
- •Плазминоген (фибринолизиноген, профибринолизин)
- •Оқсил ва пептид гормонлар
- •Оқсил ва пептид гормонлар биосинтези
- •Нейропептидлар
- •Қилувчи гипоталамус гормонлари
- •Гастроинтестинал пептид-гормонлар ва уларнинг биологик функциялари
- •Пептид токсинлар
- •Предмет кўрсаткичи
- •Номлар кўрсаткичи
- •Фойдаланилган адабиётлар
- •Интернет ресурслари
- •Мундарижа
Оқсиллар ва пептидларнинг кимёвий модификацияси
Оқсил ва пептидларнинг биоспецифик (йўналтирилган) модификацияси, оқсил ва пептидларнинг биоспецифик модификациясига тегишли реакциялар.
-
Оқсил ва пептидларнинг биоспецифик модификацияси. Жуда кўп оқсил ва пептидлар котрансляцион ва посттрансляцион ўзгаришлар натижасида турли структуравий ўзгаришларга – модификацияларга учрайди, яъни рибосомалар ёрдамида уларнинг синтези давомида (котрансляцион) ва синтез тугаллангандан сўнг (посттрансляцион) турли модификацияларга учрайди. Пептид ёки оқсил занжири рибосомадан ажралгандан сўнг ўзининг биологик актив шаклига кириши керак, яъни маълум йўл билан керакли конформацияга эга бўлиши, у ёки бу функционал группаларни, молекула қолдиқларини бириктириб олиши керак бўлади ва ҳ-зо. Полипептид занжирининг актив оқсилга айланишига «процессинг» ёки «оқсилларнинг посттрансляцион модификацияси дейилади».
Адабиётларда 100 дан ортиқ посттрансляцион модификациялар ҳақида маълумот келтирилган. Уларнинг кўпчилигининг роли аниқланмаган, баъзилари тасодифий модификациялар, ва шунинг учун ҳужайранинг фаолиятида функционал аҳамиятга эга эмас. Лекин, баъзи модификациялар ҳужайра фаолияти учун муҳим аҳамият касб этади, чунки улар специфик ферментлар тарафидан назорат қилинади.
Модификациялар эндоплазматик ретикулум (ЭР) ва Гольджи аппаратида содир бўлади. Бу органеллаларда, масалан, гликозиллаш ферментлари оқсилларга мураккаб углеводларнинг қолдиқларини қўшади ва гликопротеинларни ҳосил қилади.
Сут
эмизувчилар ҳужайра цитозолида (цитозоль
– цитоплазманинг бир қисми, мембрана
органеллалари орасидаги бўшлиқни
эгаллаган бўлади) гликозиллаш ўрганилган
– бу оқсилга N-ацетилглюкозамин
молекуласининг боғланишидир: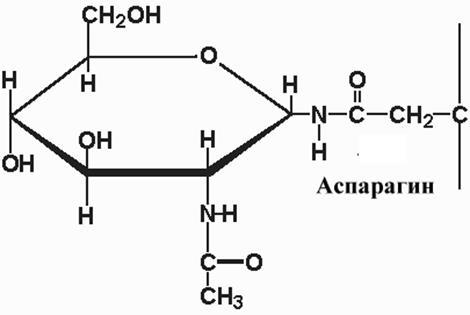
Бошқа жуда кўп ковалент модификациялар биринчи навбатда цитозольда содир бўлади. Уларнинг баъзилари барқарор ва оқсилнинг активлиги учун зарур, масалан, коферментларнинг ковалент боғланиши (биотин, липой кислотаси, пиридоксальфосфат).
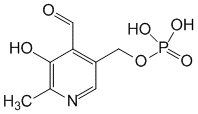
пиридоксальфосфат
Биоспецифик
модификациялардан бири оқсилларни
тегишли жойга етказиб беришда жуда
муҳим бўлиб, оқсил молекуласига ёғ
кислотасининг бирикиши уни цитозольга
қарашли маълум мембраналарга йўналтиради.
Бундай оқсилларга липидлар билан
якорьланган (белгиланган) оқсиллар,
ёки ҳужайра мембранасининг липидлари
билан ковалент боғланган ҳужайра
мембранасининг оқсиллари дейилади.
Ушбу липидлар мембранада ёғ кислотасининг
учлари билан ёнма-ён жойлашган бўлади.
Липидлар билан якорьланган (белгиланган)
оқсиллар ҳужайра мембранасининг ҳар
қайси тарафида туриши мумкин. Шунинг
учун липид оқсилни ҳужайра мембранасида
белгилаб турувчи ўзига хос якорь (белги)
вазифасини бажаради, 24-расм.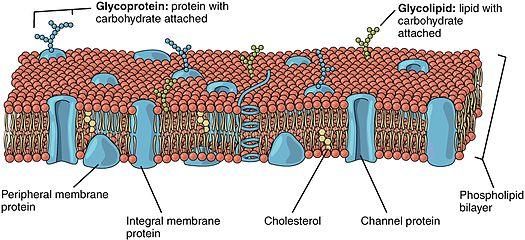
24-расм. Турли оқсиллар жойлашган липидли мембрана
Оқсиллар билан боғланган липидлар оқсил-оқсил ўзаро таъсирларида иштирок этади, улар билан боғланган оқсилларнинг функциясига таъсир эта олади. Масалан, липид группалари молекуланинг гидрофоблиги ортишида роль ўйнайди. Бу эса липидлар орқали белгиланган оқсилларнинг ҳужайра мембранаси билан ва оқсилларнинг доменлари билан таъсирлашувини таъминлаб беради.
Липидлар билан белгиланган оқсилларнинг 3 типи ажратиб кўрсатилади:
-
Пренилланган оқсиллар
-
Ёғ кислоталари билан ацилланган оқсиллар
-
Гликозилфосфатидилинозитол (GPI) билан боғланган оқсиллар
Пренилланган оқсиллар изопреннинг гидрофоб полимерлари билан ковалент боғланган бўлади:
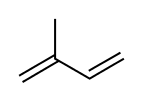
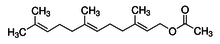
Изопрен бирлиги Фарнезил
Ёғ кислоталари билан ациллланган оқсиллар – посттрансляцион модификацияга учраган оқсиллардир. Натижада улар ёғ кислоталари билан аминокислота қолдиқлари орқали ковалент боғланиб қолади. Оқсиллар билан боғланиб қоладиган ёғ кислоталари – тўйинган кислоталардан миристин кислотаси (С14), пальмитин кислотасидир (С16). Оқсиллар битта ёки иккита ёғ кислотаси билан боғланиб қолади.
N-миристоилланиш (миристин кислотасининг оқсилга боғланиши) – одатда қайтмас реакция бўлиб, оқсил синтези давомида рўй беради ва миристин кислотасининг охирги кислотаси бўлган глициннинг α-аминогруппасига пептид боғи орқали боғланиш натижасидир, 25-расм:
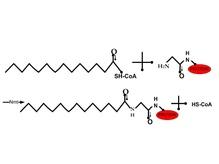
25-расм. Миристин кислотасининг оқсилга боғланиши

26-расм. G-актин оқсили 27-расм. G-актин (актиннинг
(актиннинг мономер полимер шакли), шакли),
376 та аминокислота 13 та суббирликдан тузилган
қолдиғидан тузилган оқсил
Бу реакцияни N-миристоилтрансфераза ферменти катализ қилади. Миристоилланган оқсиллар апоптозда иштирок этади. Уларга мисол тариқасида апоптозда иштирок этувчи актин (26-ва 27-расм) ва гельзолин оқсилларини келтириш мумкин.
S-пальмитоиллаш
(пальмитин кислотасининг оқсилларга
бирикиши) – қайтар реакция, бунда
пальмитин кислотаси цистеиннинг
қолдиғига тиоэфир боғи орқали бирикиб
қолади (28-расм). Пальмитоилланган
оқсилларга ўртача
ва катта узунликдаги ёғ кислоталари
бирикканда S-ациллаш
термини ишлатилади. Пальмитоил группаси
пальмитоилэстераза ферменти ёрдамида
узилади. Қайтар пальмитоиллаш оқсилларнинг
ҳужайра мембранаси билан ўзаро таъсирини
бошқариб туради ва шу тариқа
сигнал беришда иштирок этади.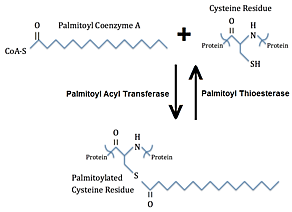
28-расм. S-пальмитоиллаш (пальмитин кислотасининг оқсилларга бирикиши)
GPI-оқсиллар (гликозилфосфатидилинозитид оқсиллар) – GPI комплексига С-охирги аминокислотанинг карбоксил группаси орқали бирикади. GPI-оқсил бир нечта боғланган компонентлардан иборат бўлади: фосфоэтаноламин, чизиқли тетрасахарид (маннозанинг 3 та қолдиғи ва глюкозаминил), фосфатидилинозитол.
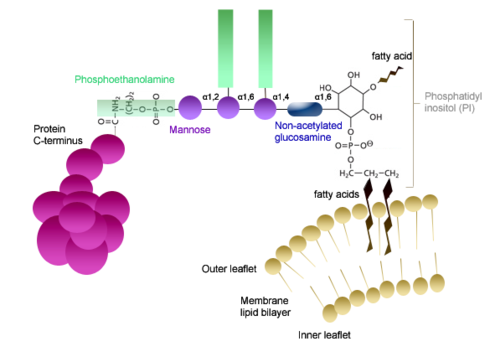
29-расм. GPI-оқсиллар (гликозилфосфатидилинозитид оқсиллар)
Фосфатидилинозитол тетрасахариднинг N-ацетилланмаган глюкозамини билан гликозид боғ орқали боғланган. Тетрасахариднинг қайтарувчи бўлмаган учи ва фосфоэтаноламин ўртасида фосфодиэфир боғи ҳосил бўлади, 29-расм.
Фосфоинозитидларнинг муҳим функцияси – «якорь, белги» функциясидир – уларга ҳужайра устки юзасининг жуда кўп оқсиллари бирикиб қолади. Мембрана оқсилларининг якори бўлиб хизмат қиладиган фосфоинозитидлар учун миристин кислотасининг миқдори катта бўлиши характерлидир. Фосфоинозитидларда липиднинг инозитол қисми гликозилланган булади, 30-расм.
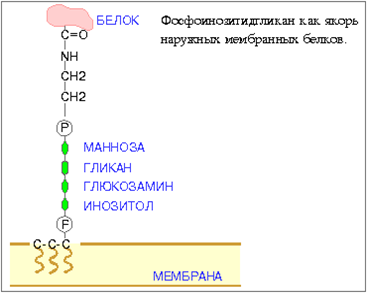
30-расм. Фосфоинозитидгликан – ташқи мембрана оқсилларининг «якори»
-
Оқсил ва пептидларнинг биоспецифик модификациясига тегишли реакциялар. Посттрансляцион модификация реакцияларига (процессинг реакцияларига) қуйидаги реакциялар киритилган:
-
Аминопептидазалар ёрдамида полипептид занжирининг N-охиридан аминокислоталарни узиб ташлаш:
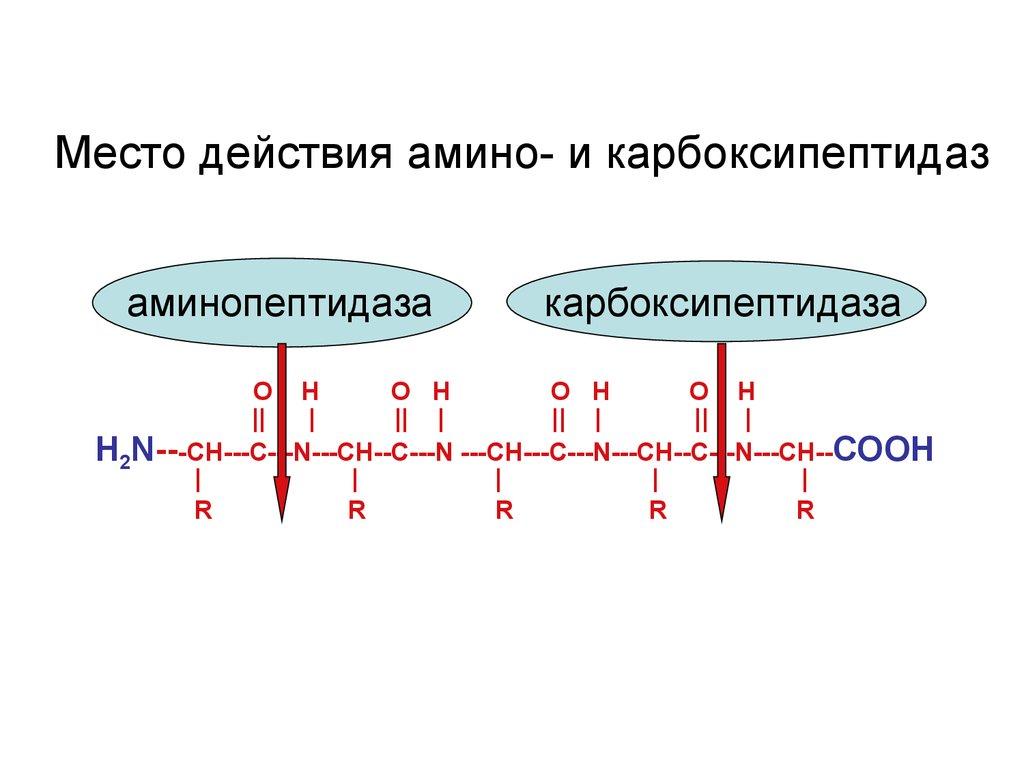
31-расм. Аминопептидазанинг таъсири
-
Цистеин қолдиқлари орасида дисульфид кўприкларини ҳосил қилиш:

32-расм. Дисульфид боғларининг ҳосил бўлиши
-
Чекланган протеолиз – полипептид занжирининг бир қисмини ўзиш (инсулин синтезида кузатилади):

актив бўлмаган пепсиноген, пептид актив пепсин,
М.М. 42000 М.М. 35000
33-расм. Пепсиногеннинг активацияси (механизм – чекланган протеолиз)
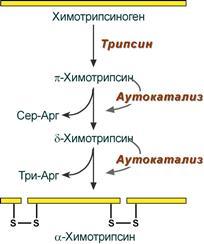
34-расм. Протеолитик ферментлар активацияси (механизм – чекланган протеолиз)
-
Ён занжир аминокислота қолдиқларига кимёвий группаларни бириктириш:
- фосфат кислотани – масалан, ферментлар активлигини бошқариш ёки кальций ионларини боғлаш учун серин, треонин, тирозин аминокислоталари бўйича фосфориллашда фойдаланилади:
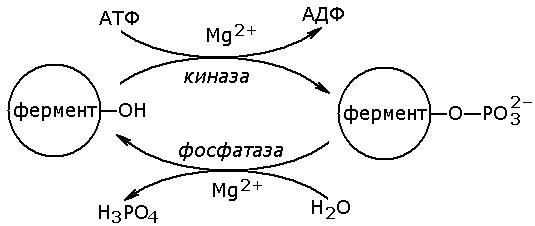
35-расм. Ферментларни фосфориллаш схемаси
- карбоксил кислотани – масалан, витамин К иштирокида протромбин, проконвертин, Стьюарт фактори, Кристмас фактори оқсилларида глутаматнинг γ-карбоксилланиши рўй беради, бу эса қон ивиши кузатилганда кальций ионларини боғлаш имконини беради:
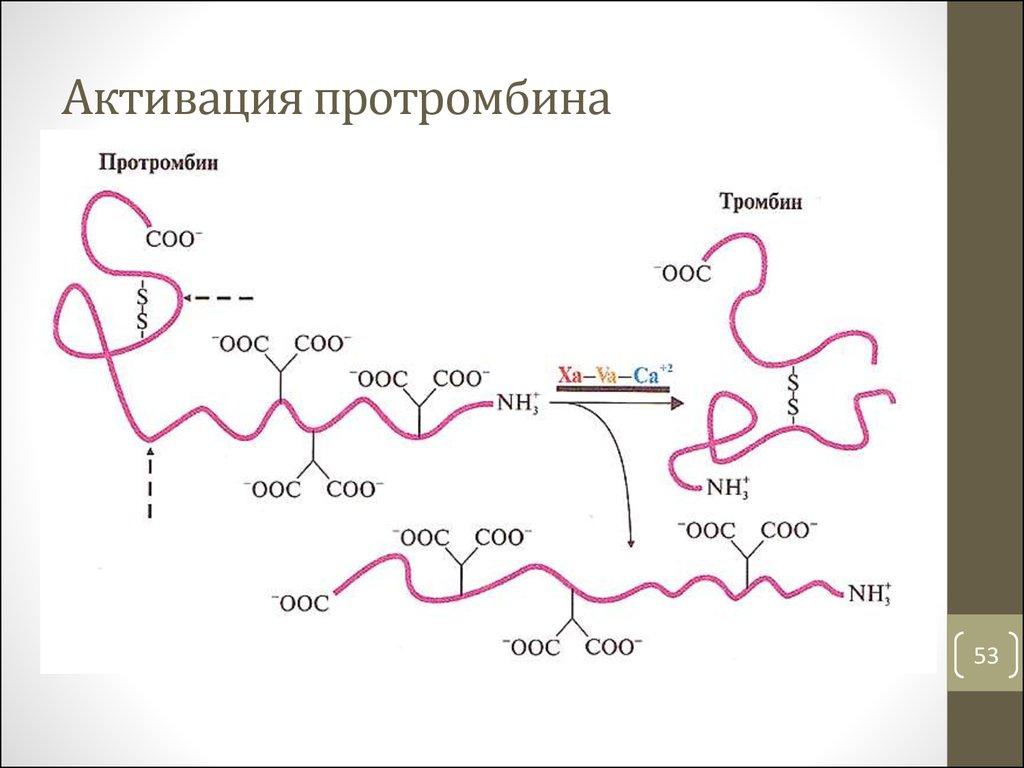
36-расм. Протромбиннинг активацияси
Организмда витамин К қон ивиши жарёнида, қоннинг ивиш системаси компонентларининг ҳосил бўлишида қатнашиб, иштирок этади. Бу компонентларга фактор (II) – протромбин, фактор (VII) – проконвертин, фактор (IX) – Кристмас фактори ва фактор (X) – Стьюарт фактори дейилади.
Микросомал карбоксилазанинг кофактори таркибида витамин К протромбиннинг пептид занжирларидаги глутамин кислотасининг қолдиклари ва қон ивиши ситемасининг бошқа факторлари γ-карбоксиллашда қатнашади.
- метил группасини киритиш – масалан, гистонлар таркибидаги аргинин ва лизинни метиллаш орқали геном активлигини бошқаришда фойдаланилади:
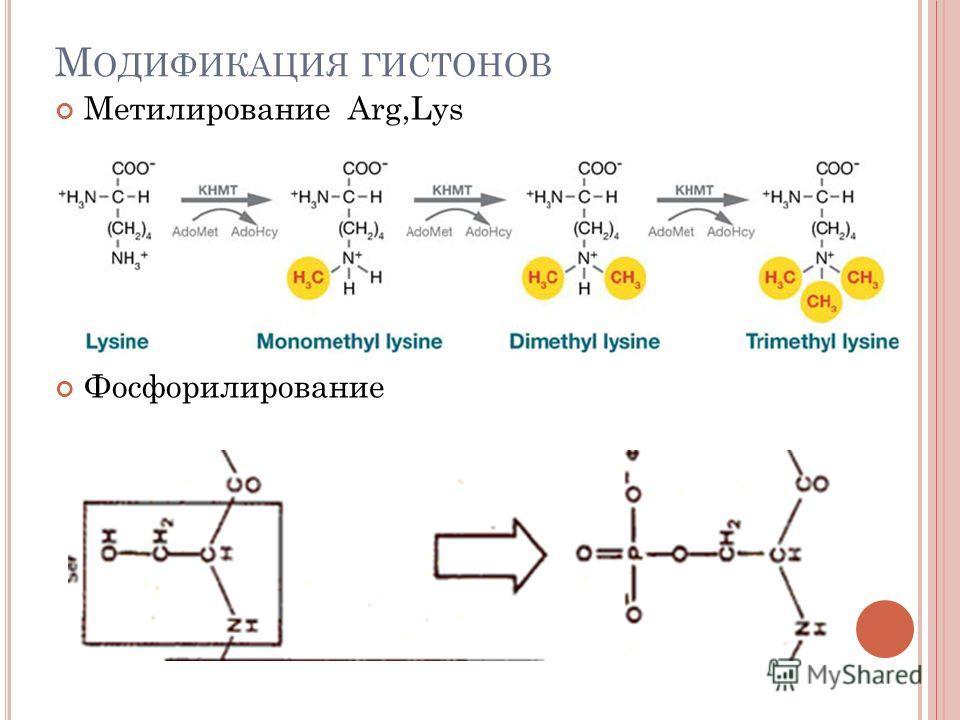
37-расм. Гистонларнинг модификацияси. Аргинин ва лизиннинг метилланиши
Метил группасини оқсилга киритиш – метиллаш – полипептиднинг аминокислоталарига метил группасини ферментлар иштирокида киритиш посттрансляцион модификация реакцияларидан биридир. Оқсилни метиллаш асосан лизин, аргинин ва гистидин аминокислоталарининг қолдиқлари бўйича (N-метиллаш), ҳамда глутамин ва аспарагин кислотасининг қолдиқлари бўйича (О-метиллаш) амалга ошади. Оқсилларни метиллашда метилаза, метилтрансфераза ферментлари иштирок этади.
Гистонлар – ядро оқсилларининг жуда катта синфи, улар 2 та функцияни бажаради: ядрода ДНК толаларининг упаковкасида иштирок этади ва транскрипция, репликация ва репарация каби ядро жараёнларининг эпигенетик бошқарувида иштирок этади. Гистонларнинг 5 та ҳар хил типлари мавжуд: H1/Н5, H2A, H2B, H3, H4. H2A, H2B, H3, H4 гистонлар (кóровые гистоны, core – ядро) оқсил глобуласи бўлган нуклеосомани шакллантирадилар, бу глобула атрофида ДНК толаси ўралиб боради. Линкер гистон деб аталувчи Н1/Н5 гистон нуклеосоманинг ташқи тарафи билан боғланади ва унда ДНК толасини маҳкамлайди.
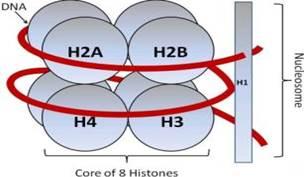
38-расм.
Нуклеосома структурасининг схематик
тасвири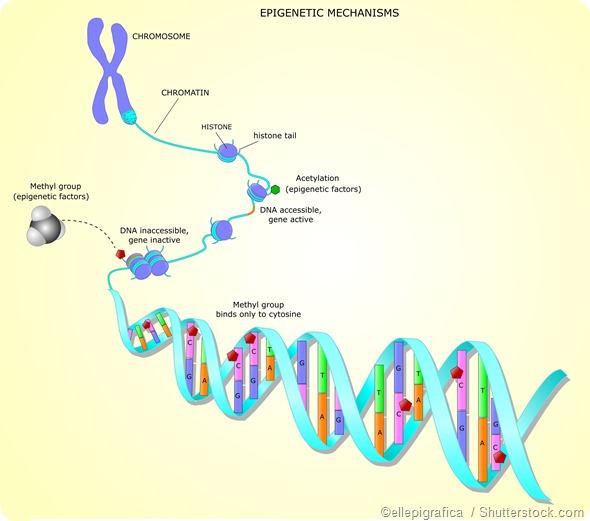
39-расм. ДНК ҳосил бўлишининг эпигенетик механизми
- гидроксил группани киритиш – масалан, витамин С иштирокида лизин ва пролинга ОН группаси бирикиб, гидроксипролин ва гидроксилизин ҳосил бўлиши коллаген молекуласининг етилиши учун зарур:
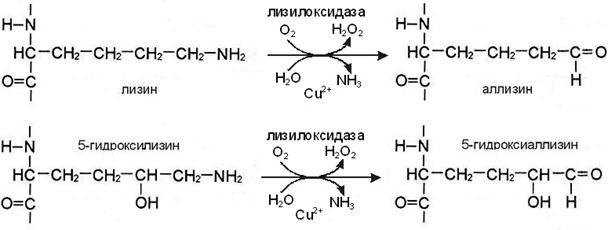
Лизин ва гидроксилизин аминокислоталари қолдиғини гидроксиллаш
Гидроксипролиннинг ОН группалари водород боғ ҳосил қилишда иштирок этади ва шу билан коллагеннинг учламчи структурасини барқарорлайди. Гидроксилизин ҳосил бўлиши коллаген фибриллалари орасида ковалент боғларнинг вужудга келишига олиб келади ва шу билан коллаген фибриллаларининг бирикишига эришилади.
- йоднинг бирикиши – масалан, тиреоглобулинга йоднинг бирикиши тиреоид гормонларнинг ўтмишдоши бўлган моддалар – йодтиронинларнинг ҳосил бўлиши учун керак:

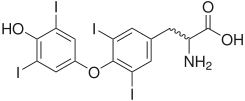
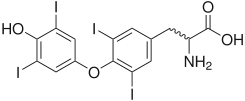
А Б
Қалқонсимон без гормонлари – А –трийодтиронин (Т3),
Б - тетрайодтиронин, тироксин (Т4)
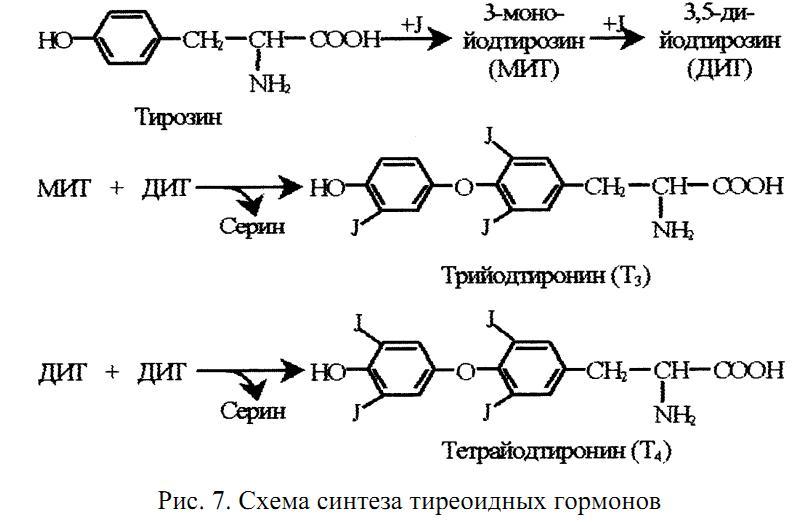
Йодтиронинлар синтезининг схемаси
5) Простетик группанинг киритилиши:
- углевод қолдиқларини киритиш – масалан, гликопротеин синтезида гликирлаш талаб этилади:
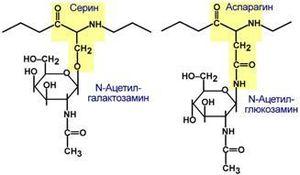
40-расм. Гликопротеинларнинг ҳосил бўлиш схемаси
Гликопротеинлар – простетик группа сифатида аминокислоталар радикалларига ковалент боғ орқали боғланган 15% гача углевод қолдиқларини сақлаган оқсиллардир. Бу оқсилларнинг углевод қисмида гексозалар (галактоза, манноза, гохида глюкоза), пентозалар (ксилоза, арабиноза), аминоуглеводлар (ацетилгалактозамин, ацетилглюкозамин), нейрамин кислотаси ва унинг сирка эфирлари (сиал кислоталари) киради. Улар кўпинча аспарагиннинг амид группасидаги азотга N-гликозид боғ билан, серин, треонин, гидроксилизинларнинг ОН группасига О-гликозид боғ билан боғланган бўлади. Гликопротеинларга иммуноглобулинлар, вируслар, қон группасини белгиловчи моддалар - антигенлар ва бошқалар киради.
- гемни киритиш – масалан, гемоглобин, миоглобин, цитохромлар, каталаза синтезида кузатилади:

41-расм. Гемнинг оқсилга бирикиши
-
витамин коферментларини киритиш –
биотин, ФАД, пиридоксальфосфат ва
ҳ-золар синтезида кузатилади: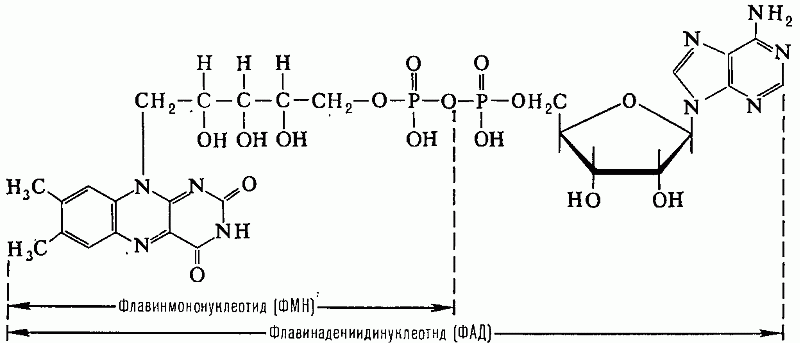
Флавинадениндинуклеотид, кофермент ФАД
6)
Протомерларнинг ягона олигомер блокка
бирлашиши, масалан, гемоглобин, коллаген,
лактатдегидрогеназа, креатинкиназа
синтезида кузатилади. Масалан,
лактадегидрогеназа 4 та суббирликдан
иборат тетрамер оқсил. 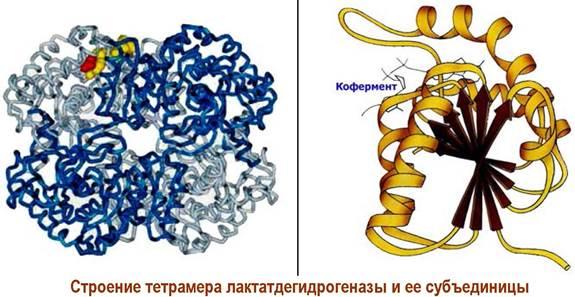
42-расм. Лактатдегидрогеназа тетрамери ва субстратининг тузилиши
-
Оқсилларнинг фолдинги. Фолдинг – узун (чузилган) полипептид занжирининг тўғри уч ўлчамли фазовий структурани эгаллашидир (укладка). Фолдингни таъминлаш учун шаперонлар (chaperon, франц. – йўлдош, энага) деб аталадиган ёрдамчи оқсиллардан фойдаланилади. Улар янги синтезланган оқсилларнинг бир-бири билан ўзаро таъсирининг олдини олади, оқсилларнинг гидрофоб қисмларини цитоплазмадан изоляциялайди, ва уларни молекула ичида «ушлаб туради», оқсил доменларини тўғри жойлаштира олади.
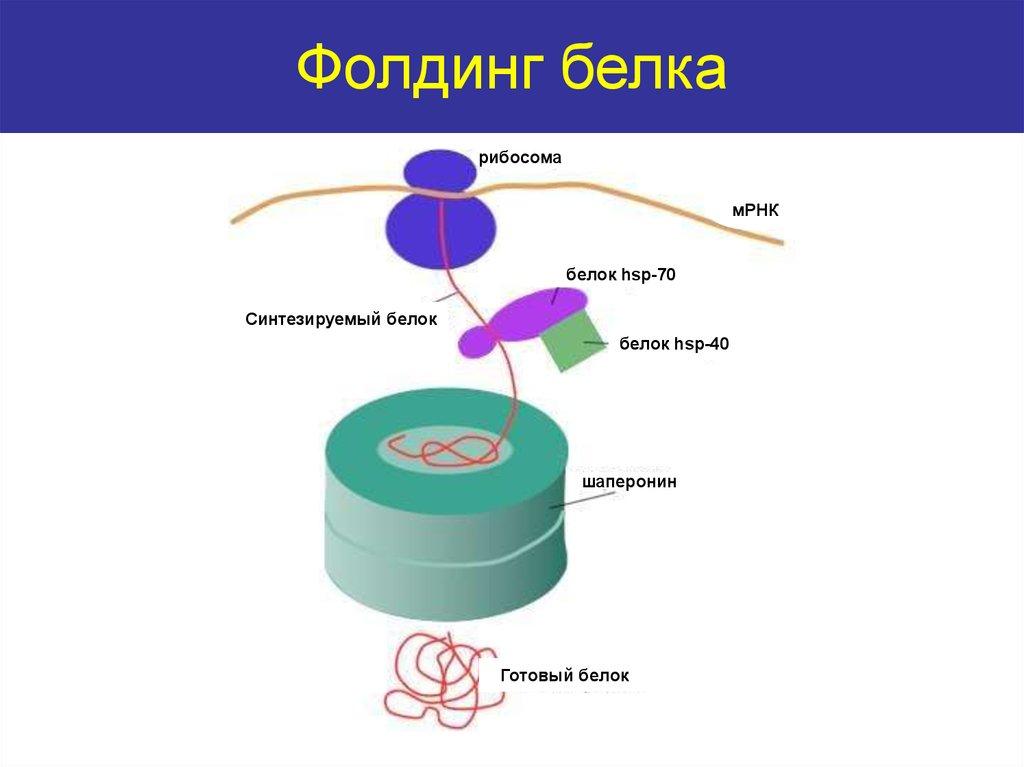
44-расм. Оқсиллар фолдингининг схемаси
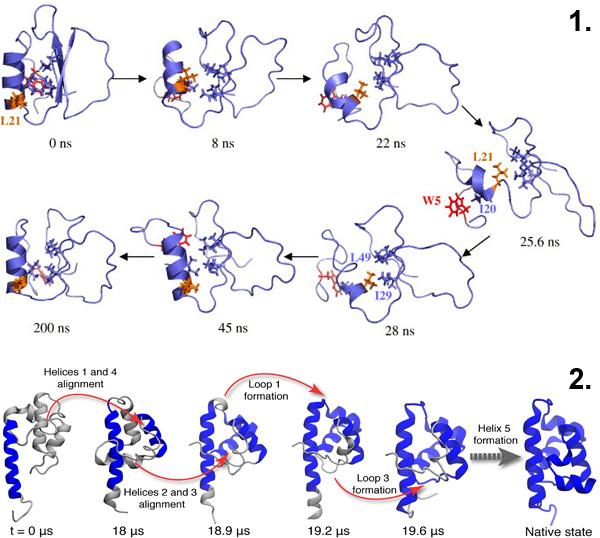
45-расм. Оқсил фолдингида ўтувчи ҳодисалар: наносекундлар давомида (юқори қатор) ва микросекундлар қаторида (пастки қатор). Расмлар R. Day, V. Daggett, 2007. Direct Observation of Microscopic Reversibility in Single-molecule Protein Folding мақоласидан ва ks.uiuc.edu сайтидан олинди
Шаперонлар
оқсиллар
структурасининг
бирламчи
даражасидан
учламчи
ва
тўртламчи
даражасигача
ўтишини
таъминлаб
беради.
Шаперонлар
функциясининг
бузилиши
ва
фолдингнинг
бўлмаслиги
натижасида
ҳужайрада
оқсилларнинг
йиғилиб
қолиши
кузатилади
– амилоидоз
касаллиги
вужудга
келади.
Амилоидознинг
тахминан 15 хил варианти бор.
46-расм. Шаперон HsP 70 оқсилининг электронографияси,
