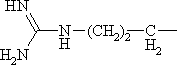- •Аминокислоталар, пептидлар, оқсиллар
- •Оқсилларнинг аминокислота таркибини аниқлаш
- •Оқсилларнинг тузилиши
- •Оқсил ва пептидларнинг кимёвий синтези
- •Оқсиллар ва пептидларнинг кимёвий модификацияси
- •40000 Марта катталаштирилган
- •Ферментлар
- •Ферментларнинг каталитик фаоллиги сабаблари
- •Ҳимоя оқсиллари
- •2. Антитаналарнинг изотиплари. Улар константа қисмининг типи орқали аниқланади. Баъзи изотиплар бириктирувчи занжир ёрдамида димерларни (IgA), ёки пентамерларни (IgM) ҳосил қилади.
- •Иммун жавоб медиаторлари - цитокинлар
- •Яллиғланиш медиаторларининг классификацияси
- •Тўқима лизокиназалари, стрептокиназа
- •Плазминоген (фибринолизиноген, профибринолизин)
- •Оқсил ва пептид гормонлар
- •Оқсил ва пептид гормонлар биосинтези
- •Нейропептидлар
- •Қилувчи гипоталамус гормонлари
- •Гастроинтестинал пептид-гормонлар ва уларнинг биологик функциялари
- •Пептид токсинлар
- •Предмет кўрсаткичи
- •Номлар кўрсаткичи
- •Фойдаланилган адабиётлар
- •Интернет ресурслари
- •Мундарижа
ЎЗБЕКИСТОН РЕСПУБЛИКАСИ
ОЛИЙ ВА ЎРТА МАХСУС ТАЪЛИМ ВАЗИРЛИГИ
МИРЗО УЛУҒБЕК НОМИДАГИ
ЎЗБЕКИСТОН МИЛЛИЙ УНИВЕРСИТЕТИ
КИМЁ ФАКУЛЬТЕТИ
ТАБИИЙ БИРИКМАЛАР КИМЁСИ КАФЕДРАСИ
Г.Н.Далимова, С.А.Маулянов
ОҚСИЛЛАРНИНГ ТУЗИЛИШИ ВА БИОЛОГИК ФУНКЦИЯЛАРИ
Тошкент - 2019
Г.Н.Долимова, С.А.Маулянов. Оқсилларнинг тузилиши ва биологик функциялари. Ўқув қўлланмаси – Тошкент. – 2019. – 222 бет.
«Оқсилларнинг тузилиши ва биологик функциялари» курси таълим дастурининг 5А140501 – Кимё (Биоорганик кимё) таълим йўналиши бўйича танлов фанлари қаторига киради. Ушбу курс бўлажак тадқиқотчи ва ўқитувчиларнинг илмий дунёқарашининг ва замонавий биологик-кимёвий фикрлашининг шаклланишида муҳим ўринга эга. «Оқсилларнинг тузилиши ва биологик функциялари» курсини ўқитиш давомида талабалар ҳозирги замон илмий адабиётларида акс эттирилган оқсиллар ва уларнинг тузилишига, биологик функцияларига тегишли муфассал маълумотлар билан танишадилар.
Тақризчилар:
Б.Н.Бабаев - ЎзМУ Табиий бирикмалар кимёси кафедрасининг мудири, кимё фанлари доктори, профессор
М.Б.Гафуров – ЎзР ФА академик О.С.Содиков номидаги Биоорганик кимё институти катта илмий ходими, кимё фанлари доктори
«Оқсилларнинг тузилиши ва биологик функциялари (ўқув қўлланмаси) Мирзо Улуғбек номидаги Ўзбекистон Миллий Университети Услубий кенгаши йиғилишида кўриб чиқилган ва нашр этиш учун тавсия этилган. _______________2019-йил № «____» мажлис баёни.
-
Аминокислоталар, пептидлар, оқсиллар
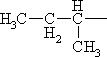
α-Аминокислоталар. Уларнинг туркумлари. Аминокислоталарнинг физик-кимёвий хоссалари. L- ва D-аминокислоталар, уларнинг фарқи. α-Аминокислоталар ва уларнинг классификацияси. α-Аминокислоталарнинг физик-кимёвий хусусиятлари. Аминокислоталарнинг кислота-асос хоссалари. Карбоксил группа бўйича реакциялари (туз хосил қилиш, этерификация, декарбоксилланиш), аминогруппа бўйича реакциялар (дезаминланиш, ацилланиш), ди- ва полипептидларнинг хосил бўлиш реакциялари, радикал бўйича реакциялар – бензол халқасини тутган аминокислоталарнинг реакциялари (бензол халқаси бўйича алмашиниш реакциялари).
-
Оқсилларнинг тузилиши ва биологик функцияларини ўрганишнинг аҳамияти. Оқсиллар ёки протеинлар барча тирик организмлар ҳужайраларининг асосий қисмини ташкил этувчи, уларнинг ҳаёт фаолиятини таъминлаб берувчи табиий бирикмалардир. Протеин атамаси юнонча proteios - биринчи сўзидан олинган. Оқсиллар тери, мушаклар, пайлар, асаб толалари, қон, ферментлар, антитаналар ва гормонларнинг асосий таркибий қисмидир.
Кимёвий нуқтаи назардан оқсиллар юқори молекуляр массали полимер моддалар ҳисобланади. Улар полиамидлар бўлиб, уларнинг синтезида дастлабки моддалар α-аминокислоталардир. Оқсил молекуласи таркибига бир неча юз ёки минг α-аминокислоталарнинг қолдиқлари кириши мумкин. Оқсилларнинг структурасини 20 та стандарт α-аминокислоталарнинг қолдиқлари ташкил этиши фанда аллақачон аниқланган. Бунда аминокислоталарнинг бирлашиб ҳосил қилиши мумкин бўлган комбинациялари сони, ва демак, оқсиллар сони деярли чексиз бўлиб қолади.
Жонли организмларнинг ривожланиши ва ҳаёт фаолиятини амалга ошириши учун минглаб турли оқсиллар мавжуд бўлиши зарур, ва ҳар бир организм учун мана шу оқсиллар жамланмаси ўта специфик, яъни ўзига хосдир. Шунинг учун ҳам оқсилларнинг тузилишини ва уларнинг биологик функцияларини ўрганиш жуда муҳим, ва ҳар доим ҳам долзарб масала бўлиб келган.
Шундай қилиб, оқсиллар (протеинлар, полипептидлар) - пептид боғлари орқали боғланган α-аминокислоталарнинг занжиридан иборат юқори молекуляр органик бирикмалардир.
Жонли организмда оқсилларнинг аминокислота таркиби генетик код билан белгиланади. Аксарият ҳолатларда оқсил синтези учун организмда 20 та стандарт аминокислоталар иштирок этади. Юқорида келтирилгандек, аминокислоталарнинг турли комбинациялари хилма-хил хоссаларга эга бўлган оқсилларнинг яратилишига олиб келади. Кўпинча жонли организмларда турли оқсилларнинг бир нечта молекулалари мураккаб комплексларни ҳосил қилади. Масалан, бактериородопсинлар ва родопсинлар (1-расм). Бактериородопсинлар – бир ҳужайрали организмларнинг нурга сезгир, мембрана оқсилларидир. Улар тузилиши бўйича сут эмизувчилар синфига кирувчи организмларга хос бўлган родопсинларга ўхшаш. Родопсинлар эса мураккаб тузилишдаги хромопротеинларга киради.
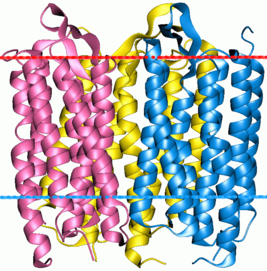
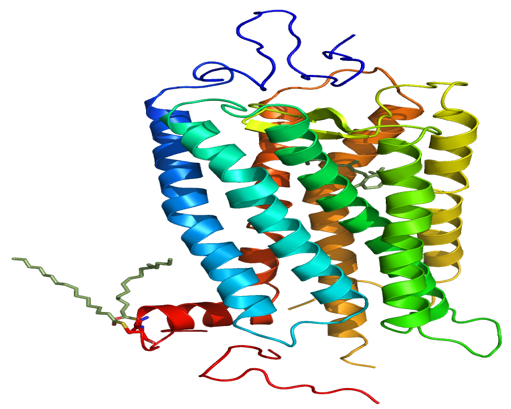
1-расм. Бактериородопсин тримери ва родопсин
Оқсилларнинг денатурацияси ва ренатурацияси. Ташқи факторлар (темрературанинг, муҳитнинг туз таркибининг, рН қийматининг ўзгариши, радиация) таъсири оқсил молекуласининг структуравий ташкил этилганлигининг бузилишига олиб келади (2-расм).
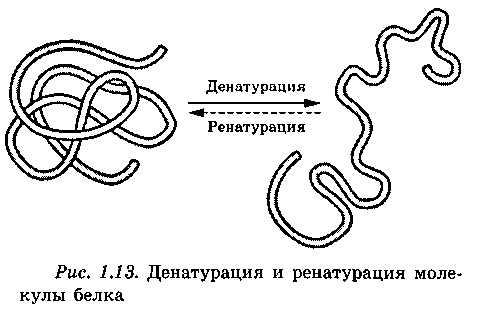
2-расм. Оқсилнинг денатурацияси ва ренатурацияси
Берилган оқсил молекуласининг учламчи конформациясининг йўқотилиши жараёнига денатурация дейилади. Оқсил молекуласи структурасини барқарорлаштириб турувчи боғларнинг узилиши денатруациянинг сабабидир. Бунда дастлаб кучсиз боғланишлар узилади, шароит қийинлашган сари кучли боғлар ҳам узилади. Шунинг учун аввал тўртламчи, сўнгра учламчи ва иккиламчи структуралар йўқотилади. Шу билан бирга денатурация натижасида полипептид занжирининг парчаланиши кузатилмайди. Фазовий конфигурациянинг ўзгариши оқсил хоссаларининг ўзгаришига олиб келади, ва оқибатда оқсил биологик функцияларини бажариши мумкин бўлмай қолади.
Денатурация қайтар бўлиши мумкин: агар оқсилга хос структурани тиклаш имконияти бўлса. Бундай денатурацияга ҳужайра мембраналарининг рецептор оқсиллари учрайди. Агар оқсил қайтар денатурацияга учраса ва муҳитнинг нормал шароитларида ўзининг структурасини, ва мос равишда хоссаларини ҳам тўлиқ тиклай олса, бу жараёнга ренатурация дейилади.
-
Оқсилларнинг функциялари. Жонли организмда оқсиллар аҳамияти жуда юқори бўлган қатор функцияларни амалга оширишда иштирок этади. Булар: каталитик, қурувчи, ҳимоя, регулятор, сигнал, транспорт, заҳира, рецептор, мотор (ҳаракат) ва бошқа функциялардир.
Оқсилларнинг каталитик функцияси – турли кимёвий жараёнларни катализ қилиш, оқсил табиатига эга бўлган моддалар – ферментлар иштирокида ўтади. Ҳар бир фермент бир ёки бир нечта ўхшаш жараёнларнинг катализида иштирок қилади.
Оқсиллар жонли организмнинг қурувчи материалидир. Цитоскелет (ҳужайра скелети) оқсиллари, мисол учун, ҳужайра ва бошқа органеллаларга шакл бериб туради. Уларга коллаген, кератин, фиброин каби оқсиллар мисол бўла олади.
Оқсилларнинг ҳимоя функцияси бир неча хил бўлиши мумкин: физик, кимёвий ва иммун ҳимоя. Коллаген, кератин, фибриноген ва тромбинлар физик ҳимояни таъминловчи оқсиллардир. Оқсиллар баъзи токсин моддаларни боғлаш хусусиятига эга, бу билан улар кимёвий ҳимояни амалга оширадилар. Ⱪон ва бошқа биологик суюқликлар таркибига кирувчи оқсиллар организм зарарланганда ёки патогенларнинг ҳужумига жавоб берувчи оқсиллар иммун ҳимояни бажарадилар. Буларга иммуноглобулинлар (антитаналар) - қонда ҳар доим мавжуд бўлган протеолитик оқсиллар системаси киради.
Оқсилларнинг регулятор функциясини ҳужайрада махсус оқсиллар амалга оширади. Улар ҳужайра циклини, транскрипцияни, трансляцияни, сплайсингни, бошқа оқсилларнинг фаоллигини ва қатор жараёнларни бошқариб турадиган оқсиллардир. Бундай бошқарув оқсилларнинг ферментатив активлиги асосида (протеинкиназалар) уларнинг бошқа молекулалар билан ўзига хос боғлана олиш хусусиятида ўз аксини топган.
Оқсилларнинг сигнал функцияси – оқсилларнинг сигнал, яъни «хабар» бера олувчи моддалар сифатида хизмат қила олиш хусусиятидир. Масалан, сигнал функцияси амалга оширилаётганда оқсиллар ҳужайралараро, тўқималар ўртасида, органлар ўртасида ва организмлар ўртасида «сигнал моддалар» билан алмашинадилар. Оқсилларнинг сигнал функциясини кўпинча гормонлар, цитокинлар, ўсиш факторлари амалга оширади. Масалан, инсулин оқсили қонда глюкоза концентрациясини бошқариб турадиган гормон-оқсилдир.
Оқсилларнинг транспорт функцияси - кўпчилик эрувчан оқсилларнинг кичик молекулаларни боғлай олиш ва керакли жойга етказиб берилгандан сўнг ажрата олиш хусусияти билан боғлиқ. Транспорт оқсиллари нафас олиш ва фотосинтезда электронлар ташувчиси вазифасини бажаради, қон таркибидаги кислород гемоглобин ёрдамида, темир – трансферрин ёрдамида, мис – церулоплазмин ёрдамида, ёғ кислоталари эса плазманинг альбуминлари ёрдамида етказиб берилади.
Оқсилларнинг заҳира функцияси уларнинг ўсимликлар уруғларида энергия манбаъи сифатида сақланиши ва зарур бўлганда аминокислоталар манбаъи бўлиб хизмат қила олиши билан белгиланади. Масалан, пахта чигитининг 7S ва 11S глобулинлари ўз вақтида (1970 -1980 йилларда) ЎзР ФА Ўсимлик моддалари кимёси институти ходимлари тарафидан ўрганилган. Заҳира оқсилларига мисол тариқасида тухум оқсилидан олинган альбумин, сутдан олинган казеин, қора талоқда тўпланадиган темир сақловчи оқсил ферритин, буғдойдан олинган глиадин, маккажўхори донидан олинган цеин, картошкадан олинган туберинларни келтириш мумкин.
Оқсилларнинг рецептор функцияси – оқсил рецепторлари цитоплазмада ҳам бўлиши мумкин, шу билан бирга ҳужайра мембранасига ҳам тизилиб олиши мумкин. Бунда молекуланинг бир қисми аксарият кимёвий моддалар бўлган сигнал вазифасини бажарувчиларни қабул қилиб олади, баъзи ҳолларда эса сигнал вазифасини ёруғлик, механик таъсир ва бошқа стимуллар бажаради, уларга ҳам рецепторлар жавоб қайтаради, масалан конформациясининг ўзгариши билан.
Оқсилларнинг мотор (ҳаракат) функцияси. Жуда кўп ҳаракат оқсиллари организмнинг ҳаракатланишини таъминлаб беради. Бундай оқсиллар «молекуляр моторлар» деб ҳам аталади. Масалан, мушакларнинг қисқариши (миозин), организм ичида ҳужайраларнинг силжиши, киприкчалар ва толачаларнинг ҳаракатланиши, ҳамда ҳужайра ичидаги актив ва йўналтирилган транспорт (кинезин, динеин). Миозин мушакларнинг қисқарувчи толаларининг – микрофибриллаларнинг асосий қисмини ташкил этади. Миозин мушак оқсиллари умумий миқдорининг 40-60% ни ташкил этадиган фибрилляр оқсил (3-расм):
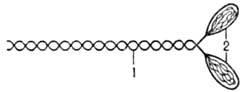
3-расм. Миозин оқсилининг тузилиши: 1 – фибрилляр стержень, 2 – икки дона «бош»
Шундай қилиб, оқсилларнинг юқорида келтирилган асосий функциялари қаторидан (бу қаторни узоқ давом эттириш мумкин) кўриниб турибдики, ушбу биополимер моддалар жонли организмларда алоҳида ва турли туман ролларни ўйнайди. Оқсилларнинг биологик функцияларининг турли-туманлигини таъминлаб берувчи асосий ва ҳал қилувчи хоссани ажратиб кўрсатмоқчи бўлсак, уларнинг кенг қамровдаги ҳар хил моддалар билан танлаб, ўзига хос боғлана олиш қобилиятини кўрсатишимиз керак бўлади. Хусусан, бундай юқори танловчанлик ёки мойиллик (сродство) ферментларнинг субстратлар билан, антитаналарнинг антигенлар билан, қон таркибидаги транспорт оқсилларининг кўчириб олиб борилаётган моддаларнинг молекулалари билан ўзаро таъсирлашувини таъминлаб беради. Бу ўзаро таъсир ферментнинг тегишли субстратга боғланиши билан тугайдиган биоспецифик «таниб олиш» принципига асосланган бўлиб, ўз навбатида, тегишли кимёвий реакциянинг ўтишига ёрдам беради.
-
α-Аминокислоталар, уларнинг туркумлари, физик ва кимёвий хоссалари. Аминокислоталар, таркибида бир вақтнинг ўзида аминогруппа ва карбоксил группа тутган гетерофункционал бирикмалардир. Углеводород радикалининг типига асосланиб аминокислоталар ароматик ва алифатик аминокислоталарга классификацияланади. Алифатик аминокислоталарнинг ўзи эса α, β, γ, δ ва ω-аминокислоталарга ажратилади, уларнинг кимёвий хоссалари турличадир, Оқсиллар кимёси курсида биз фақат α-аминокислоталар устида тўхталиб ўтамиз.
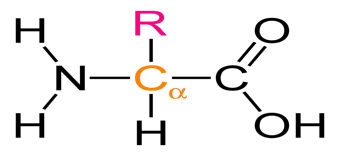
Кимёда α-аминокислоталарнинг аҳамияти жуда катта, чунки улар оқсилларни ташкил этувчи мономерлардир. Энг муҳим α-аминокислоталар таркибига алифатик, ароматик ва гетероароматик радикаллар киради.
α-Аминокислоталарнинг
IUPAC
бўйича номенклатурасида тегишли карбон
кислотасининг номи асос сифатида
олинади, карбонил группасининг углерод
атомидан бошлаб қолган углерод атомлари
номерланади. Рационал номенклатурага
кўра кўшни углерод атомидан бошлаб
юнон алфавити ҳарфлари билан белгиланади: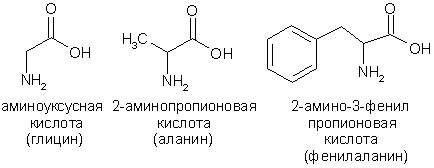
аминосирка 2-аминопропион 2-амино-3-фенилпропион
кислотаси кислотаси кислотаси
(глицин) (аланин) (фенилаланин)
Бундан ташқари, тривиал номлар ҳам кенг кўлланилади. Улар аминокислоталар ажратиб олинган манбаъларнинг номи билан боғлиқ, масалан, серин аминокислотаси ипакдан ажратиб олинган (лотинча serieus – ипакдек), тирозин эса пишлоқдан ажратиб олинган (юнонча tyros – пишлоқ).
1-жадвал. Протеиноген α-аминокислоталар
|
№ |
Радикал |
Тривиал номи |
Аминокислота қолдиғининг қисқартирилган белгиланиши |
|
Алифатик α-аминокислоталар |
|||
|
1 |
Н- |
Глицин |
Gly |
|
2 |
СН3- |
Аланин |
Ala |
|
3 |
(СН3)2СН- |
Валин* |
Val |
|
4 |
(СН3)2СНСН2- |
Лейцин* |
Leu |
|
5 |
|
Изолейцин* |
Ile |
|
Гидроксил тутган α-аминокислоталар |
|||
|
6 |
НОСН2- |
Серин |
Ser |
|
7 |
|
Треонин* |
Thr |
|
Карбоксил группа тутган α-аминокислоталар |
|||
|
8 |
НООССН2- |
Аспарагин кислотаси |
Asp |
|
9 |
НООССН2СН2- |
Глутамин кислотаси |
Glu |
|
СОNH2 группа тутган α-аминокислоталар |
|||
|
10 |
|
Аспарагин |
Asn |
|
11 |
|
Глутамин |
Gln |
|
NH2 группа тутган α-аминокислоталар |
|||
|
12 |
H2N(CH2)3CH2- |
Лизин* |
Lys |
|
13 |
|
Аргинин |
Arg |
|
S тутган α-аминокислоталар |
|||
|
14 |
HSCH2- |
Цистеин |
Cys |
|
15 |
СH3SСН2CH2- |
Метионин* |
Met |
|
Арил тутган α-аминокислоталар |
|||
|
16 |
С6Н5СН2- |
Фенилаланин* |
Phe |
|
17 |
|
Тирозин |
Tyr |
|
Гетарил тутган α-аминокислоталар |
|||
|
18 |
|
Триптофан* |
Trp |
|
19 |
|
Гистидин |
His |
|
20 |
|
Пролин |
Pro |
Табиатда учрайдиган α-аминокислоталарнинг умумий сони 180 га етади, шулардан 20 таси оқсил молекулалари таркибига киради (1-жадвал).
Ўсимликлар ва баъзи микроорганизмлар ўзлари учун зарур бўлган аминокислоталарни синтез қила оладилар. Ҳайвонлар ва одам организмида эса баъзи аминокислоталар синтез қилинмайди, ва шу сабабдан ташқаридан олиниши керак. Бундай аминокислоталарга алмаштириб бўлмайдиган аминокислоталар дейилади, Булар - валин, лизин, фенилаланин, лейцин, треонин, триптофан, изолейцин ва метионин аминокислоталаридир.
α-Аминокислоталар қолдиқларини номлашда уларнинг номидаги асосий илдизга –ил қўшимчаси қўшилади, масалан: H2N-CH2-CO- глицил; H2N-CH(С6Н5)-CO- фенилаланил; H2N-CH(ОН)-CO- серил ва ҳоказо.
α-Аминокислоталарнинг
олиниши
учун бир нечта асосий ёндошишлардан
фойдаланилади. Масалан, карбон кислотанинг
α-ҳолатидаги водород галоген ҳосила
олиш орқали аминогруппага алмаштирилади.
Галогенкарбон кислота Гель-Фольгард-Зелинский
усули бўйича олинади, сўнгра аммиак
таъсирида Габриэль реакцияси бўйича
ёки N-алкилфталимид орқали аминланади: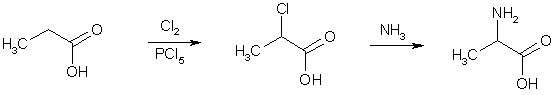
α-Аминокислоталарни
олишнинг яна бир кенг тарқалган усули
цианаминлар нитрил группасининг
гидролизига асосланган. Ўз навбатида
улар карбонил бирикмаларга калий
цианиди ва аммиак таъсир эттириб олинади
(Штреккер усули). Бу синтез усули умумий
аҳамиятга эга, чунки цианаминларни
деярли барча альдегид ва кетонлар
асосида олиш мумкин, демак, ушбу усул
ёрдамида турли ўриндошларга эга бўлган
аминокислоталарни синтез қилиш мумкин: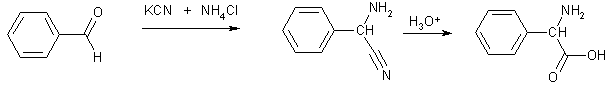
α-Аминокислоталарни олишнинг учинчи усули - α-оксокислоталарни қайтарувчи аминлашдир. α-Оксокислоталарга аммиак ёки гидроксиламин таъсир эттириб, тегишли иминлар ёки оксимлар олинади, уларни палладий катализатори иштирокида водород билан қайтариб α-аминокислоталар олинади:
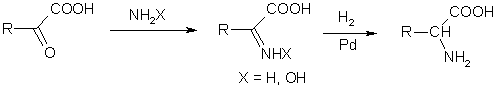
α-Аминокислоталарнинг физик-кимёвий хоссалари. Физик хоссалари бўйича аминокислоталар тегишли карбон кислоталар ва асослардан кескин фарқ қилади. Уларнинг барчаси кристалл моддалар бўлиб, органик эритмалардан кўра сувда яхши эрийди, ва етарли даражада юқори суюқланиш температурасини намоён қилади, уларнинг кўпчилиги ширин мазага эга. Бу хоссалар уларнинг туз характерини кўрсатишини билдиради. Аминокислоталарнинг физик ва кимёвий хусусиятлари уларнинг тузилиши билан белгиланади, яъни уларнинг таркибидаги хоссалар бўйича карама-қарши бўлган группалар – кислота ва асос группаларнинг мавжудлиги билан белгиланади.
α-Аминокислоталарнинг кимёвий хоссалари:
Кислота-асос
хоссалари α-аминокислоталарнинг
ва оқсилларнинг ҳам аксарият физик ва
кимёвий хоссаларини белгилаб беради.
Бундан ташқари, аминокислоталарни
ажратиб олиш ва идентификация қилишда
ишлатиладиган деярли барча усуллар
уларнинг мана шу кислота-асос хоссаларига
асослангандир.
Аминокислоталар
амфотер моддалар бўлиб, катионлар ёки
анионлар ҳолида мавжуд бўлиши мумкин.
Аминокислоталар нейтрал сувли
эритмалардан диссоциацияланмаган
молекулалар ҳолида эмас, балки биполяр
амфотер ионлар - цвиттерионлар
ҳолида кристалланади. Сувли эритмаларда
аминокислоталар биполяр ионининг
катион ва анион шакллари орасидаги
мувозанатли аралашмадан иборат бўлади: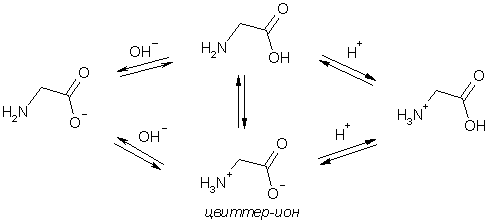
Эритмаларда биполяр ионнинг концентрацияси максимал, катион ва анион шаклларнинг концентрацияси минимал бўлгандаги рН қиймати аминокислотанинг изоэлектрик нуқтаси (pI) деб аталади. Ҳар бир аминокислотанинг ўз pI қиймати бор (2-жадвал). Бу нуқтада аминокислотанинг суммар заряди нольга тенг, биполяр ионлар электр майдонида силжимайди. рН қиймати pI қийматидан паст бўлганида аминокислота катиони (аммонийли форма) катодга қараб силжийди, рН қиймати pI қийматидан баланд бўлганида эса карбоксилат анион анодга қараб силжийди. Аминокислоталарни электрофорез усули ёрдамида ажратиш мана шунга асосланган. Ароматик аминокислоталар цвиттер-ионларни ҳосил қила олмайди, чунки уларнинг молекуласидаги амин группасининг бензол ҳалқасига яқинлиги молекуланинг асослилигини пасайтиради.
2-жадвал. Баъзи аминокислоталарнинг pI қийматлари
|
Кислота |
pI |
Кислота |
pI |
|
Глицин |
6.0 |
Цистеин |
5.0 |
|
Аланин |
6.0 |
Лизин |
9.8 |
|
Валин |
6.0 |
Аргинин |
10.8 |
|
Фенилаланин |
5.5 |
Аспарагин кислотаси |
3.0 |
|
Серин |
5.7 |
Глутамин кислотаси |
3.2 |
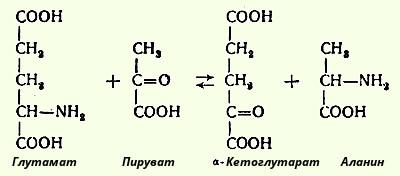
α-Аминокислоталарнинг биологик жиҳатдан муҳим реакцияларига трансаминлаш, декарбоксиллаш, дезаминлаш, пептид боғларини ҳосил қилиш кабилар киради.
Трансаминлаш реакциясида аминогруппа аминокислотадан α-кетокислотага ўтказилади, бунда оралиқ модда сифатида аммиак ҳосил бўлмайди (1937 йилда кимёгарлар А.Е. Браунштейн ва М.Г. Крицман тарафидан очилган).
Аминокислоталарнинг декарбоксилланиши карбоксил группасига электроноакцептор аммоний группаси NH3+ яқин тургани учун осон ўтади. Cu(II) тузлари иштирокида ва СО2 ни ютиб олувчи Ba(OH)2 билан таъминланган ҳолда α-аминокислоталар қиздирилганда улар декарбоксилланади:
Организм тўқималари шароитида декарбоксилланиш декарбоксилаза ва пиридоксальфосфат ферментлари иштирокида амалга ошади, натижада ҳосил бўладиган биоген аминлар (мурда доғлари) организмнинг кўпчилик функцияларига кучли фармакологик таъсир ўтказади.
Аминокислоталарнинг дезаминланиши – аминогруппанинг ажралиши - 4 хил дезаминлаш (қайтарувчи, гидролитик, ички молекуляр ва оксидловчи) мавжудлиги исботланган. Уларни тегишли ферментлар системалари катализ қилади, барча ҳолатларда NH2-группа аммиак ҳолида ажралиб чиқади:
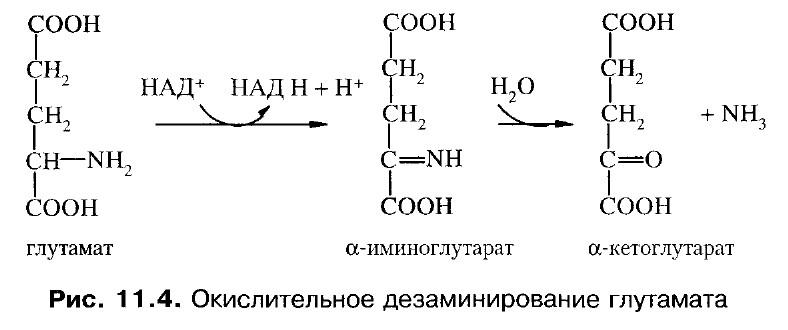
Глутаматнинг оксидловчи дезаминланиши
Пептид боғларини ҳосил қилиши. Аминокислоталар ўзаро пептид боғлар орқали боғланиб полимер молекуласини ҳосил қилади. Бунда аминокислота қолдиқлари 10 тадан ошмаса ҳосил бўлган модда пептид дейилади, 10 – 40 атрофида бўлса полипептид, 40 дан ошса оқсил дейилади. Формал равишда пептид боғларининг ҳосил бўлишини қуйидагича тасаввур қилиш мумкин:
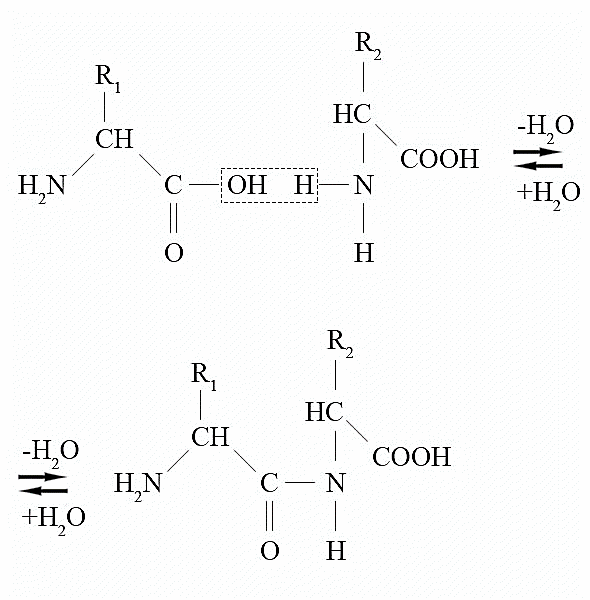
Аминокислоталарнинг сифат реакциялари:
-
Нингидрин реакцияси (Руэманн реакцияси). α-Аминокислоталар нингидрин билан реакцияга киришиб, кўк-бинафша рангли комплексни (Руэманн пурпури) ҳосил қилади. Ҳосил бўлаётган комплекс рангининг интенсивлиги аминокислота миқдорига пропорционал. Нингидрин билан реакция α-аминокислоталарни визуал хроматограммаларда (қоғоз, юпқа қатламдаги хроматограмма) аниқлаш учун, ҳамда реакция маҳсулоти рангининг интенсивлиги бўйича аминокислоталар концентрациясини колориметрик аниқлаш учун ишлатилади.
Реакциянинг
моҳияти шундан иборатки, α-аминокислоталар
нингидрин билан реакцияга киришиб бир
вақтнинг ўзида ҳам оксидловчи
дезаминланиш, ҳам декарбоксилланишга
учрайди. Реакция маҳсулотларидан бири
– гидриндантин аммиак ва нингидрин
билан реакцияга киришиб, рангли маҳсулот
дикетогидриндилиден-дикетогидриндамин
(ДИДА), ёки Руэманн пурпурини ҳосил
қилади
нингидрин Руэманн пурпури
Нингидрин фақат α-аминокислоталар билан эмас, балки бошқа аминлар билан ҳам реакцияга киришади – бунда ҳам кўк-бинафша ранг ҳосил бўлади, аммо СО2 ажралиб чикмайди. Демак, СО2 нинг ажралиши нингидрин реакциясида айнан α-аминокислоталарнинг иштирок этишини кўрсата олади.
-
Комплекслар ҳосил қилиш. α-Аминокислоталар металл катионлари билан ички комплекс тузлар ҳосил қила олади. Масалан, глицин янги чўктирилган мис гидроксиди билан кўк рангли мис глицинатини ҳосил қилади:
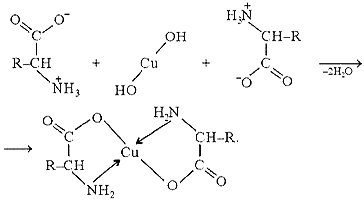
4. L- ва D-аминокислоталар, уларни ажратиб олиш усуллари. Аминокислоталар асимметрик углерод атомига эга, α-аминокислоталарда бу α углерод атомидир, шу сабабдан улар оптик изомерлар ҳолида мавжуд бўла оладилар:
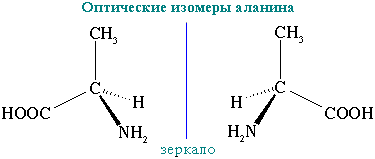
D-аминокислота L-аминокислота
Абсолют конфигурацияси аниқланган биринчи аминокислота L-серин эди:

L-серин серин D-серин
Аминокислоталарнинг
конфигурациясини аниқлашда уларни L-
ва D-сут кислоталарининг молекуласи
билан солиштириш қабул қилинган, сут
кислотасининг конфигурацияси эса L- ва
D-глицерин альдегиди асосида белгиланган.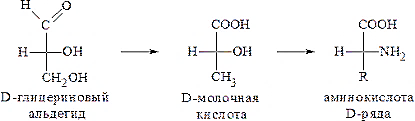
D-глицерин альдегиди D-сут кислотаси D-қатор аминокислотаси
Табиатда аксарият оптик актив аминокислоталар учрайди, ва уларнинг кўпчилиги L-қаторга мансуб. Аминокислоталарнинг D-шакллари жуда кам учрайди, ва улар баъзи антибиотиклар (грамицидин ва полимиксин) таркибига кириши аниқланган. Бундан ташқари, Dα-аминокислоталарнинг қолдиқлари бактериялар ҳужайра девори биополимерлари таркибида ҳам учраши аниқланган. Масалан, D-глутамин кислотаси сибирь яраси (сибирская язва) бактерияларининг қобиғида топилган, шунинг учун одам ва ҳайвон организмидаги парчалаш ферментлари бу бактериялар олдида кучсиздир.
Баъзи α-аминокислоталар 2 та хирал марказга эга ва 4 та стереоизомерлар ҳолида мавжуд бўлиши мумкин, лекин оқсил молекуласида уларнинг фақат биттаси учрайди, масалан изолейцин ва треонин аминокислоталари:
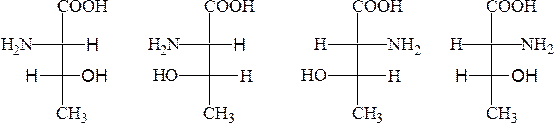
L-треонин L-алло-треонин D-треонин D-алло-треонин
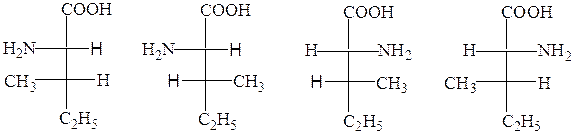
L-изолейцин L-алло-изолейцин D-изолейцин D-алло-изолейцин
Рацемизацияни истисно қилувчи шароитларда табиий оқсилларнинг гидролизи натижасида ҳосил бўладиган аминокислоталарнинг барчаси L-қаторга мансуб бўлади. Шундай қилиб, табиий аминокислоталар L-глицерин альдегидининг конфигурациясига ўхшаш фазовий тузилишни намоён қилади. Таъкидлаш лозимки, аминокислоталарга берилган L ва D символлари уларнинг стереокимёвий конфигурацияси бўйича L- ёки D-қаторга мансублигини билдиради холос, бир вақтнинг ўзида «+» ёки «-» белгилари ёруғлик нурининг қутбланиш текислиги йўналишининг ўзгаришини кўрсатади.
5. Оқсилларни ўрганиш соҳасида Ўзбекистон кимёгарларининг олиб бораётган изланишлари. Ўзбекистон Республикаси Фанлар академияси таркибига кирувчи Биоорганик кимё институтида «Оқсиллар ва пептидлар кимёси» лабораторияси бор. Уни академик, к.ф.д., профессор Салихов Шавкат Исмаилович бошқаради. Бу лабораторияда ўсимлик ва ҳайвон организми оқсиллари ва пептидлари ўрганилади. Лабораторияда бўғиноёқлилар заҳаридан ажратиб олинган янги юқори специфик токсинларнинг структураси, таъсир механизми ва уларни нейрофизиологик тадқиқотлар учун «инструмент» сифатида ўрганиш мақсадида чуқур фундаментал тадқиқотлар олиб борилган. Токсик таъсирга эга бўлган 50 дан ортиқ оқсил ва пептидлар ажратиб олинган. Уларнинг 15 тасининг кимёвий структураси аниқланган. Бўғиноёқлилар заҳаридан ажратиб олинган юқори специфик токсинларни тадқиқ этиш ҳужайрада содир бўладиган ва биологик мембраналарнинг структуравий ва молекуляр ташкил этилганлиги билан боғлиқ бўлган ҳаётий муҳим жараёнлар механизмини тушуниш имконини берди. Ушбу тадқиқотларнинг тугалланиши натижасида кобра, чаён, қорақурт заҳарларига қарши, таркибида ажратиб олинган нейротоксинлар антитана вазифасини бажарган, антизардоблар ишлаб чиқарилди.
Ўсимликларнинг антимикроб ва антибактериал активлиги молекуляр механизмларини аниқлаш мақсадида, Институтда биринчи бор Марказий Осиё учун эндемик бўлган ўсимликларнинг уруғи ва нишонаси таркибидаги катионли пептидларни систематик тадқиқ этиш ишлари олиб борилган. Натижада Марказий Осиё учун эндемик бўлган ўсимликлардан қишлоқ хўжалик экинларининг ген инженерияси учун перспектив бўлган пептидлар ажратиб олинган. Хусусан, фунгицид активликка эга ва мембраналарнинг, хитиннинг биогенезида иштирок қилувчи, ҳамда ўсимликларнинг патоген организмлар ҳужумига қарши ҳимоя реакцияларида иштирок этувчи липид-ташувчи пептидлар ажратиб олинган. Биринчи бор институтда Malvaceae турига мансуб ўсимликлар уруғидан биоцид пептидларнинг физик-кимёвий характеристикалари, антимикроб ва инсектицид активликлари аниқланиб ўрганилган.
Ўсимлик хом ашёсидан фитопатоген активликка эга бўлган 20 дан ортиқ гомоген пептидлар ажратиб олинган. Уларнинг молекуляр параметрлари, аминокислота кетма-кетликлари ва фитопатоген активлиги аниқланган. Ажратиб олинган пептидлар пахта ўсимлигининг трансген навларини яратишда маркер сифатида қўлланилиши имконияти борлиги жиҳатидан қизиқиш уйғотади.
Седана уруғидан ажратиб олинган пептидларнинг структураси ва функциялари ўрганилган, улар асосида ишлаб чиқилган композициянинг куйишга қарши ва ярани битказувчи активликлари ўрганилган. Таркибида седана уруғидан ажратиб олинган полипептидларни сақлаган фармацевтик композиция ўзининг тўқималарни регенерация қилувчи ва яраларни битказувчи активлиги бўйича мавжуд чет эл аналогларидан актив эканлиги ҳам кўрсатилган.
ЎзР ФА Ўсимлик моддалари кимёси институтида ҳам кўп йиллар давомида «Оқсиллар кимёси» лабораторияси ўсимлик оқсиллари бўйича изланишлар олиб борган. Ушбу изланишлар асосан техник ўсимликлар уруғи таркибидаги оқсилларни, ферментларни ўрганишга багишланган. Асосий техник экин бўлган пахтанинг бир қанча навларининг заҳира оқсиллари, ферментлари шу лаборатория ходимлари тарафидан ўрганилган. Бу лабораторияни узоқ вақт к.ф.д., профессор Йўлдошев Паттоҳ Ходжаевич бошқарган. Ҳозир бу лаборатория «Юқори молекуляр табиий бирикмалар кимёси» лабораторияси таркибига киритилган.
Мавзуни қайтариш учун саволлар
-
Оқсилларнинг денатурацияси ва ренатурацияси нимани билдиради?
-
Оқсилларнинг биологик функцияларини санаб ўтинг.
-
Протеиноген аминокислоталарга қайси аминокислоталар киритилган?
-
Аминокислоталарнинг IUPAC бўйича номланиши ва тривиал номлари ҳақида маълумот беринг.
-
Аминокислоталарнинг энг муҳим реакцияларини санаб ўтинг.
-
α-Аминокислоталарнинг кимёвий хоссалари нимага асосланган?
-
Оқсилларнинг биологик функцияларининг турли-туманлигини таъминлаб берувчи асосий ва ҳал қилувчи хоссани таърифланг.
-
α-Аминокислоталарнинг IUPAC бўйича номенклатурасида
-
α-Аминокислоталарнинг физик хоссаларини санаб ўтинг.
-
α-Аминокислоталарнинг кимёвий хоссалари ҳақида маълумот беринг.
-
Цвиттерионлар ҳақида тушунча беринг.
-
Аминокислотанинг изоэлектрик нуқтаси (pI) нимани билдиради?
-
α-Аминокислоталарнинг биологик жиҳатдан муҳим реакцияларига қайси реакциялар киритилган?
-
Аминокислоталарнинг пептидларни ҳосил қилиши реакциясининг аҳамияти нимадан иборат?
-
Аминокислоталарнинг конфигурациясини аниқлашда уларни қайси L- ва D-кислоталарининг молекуласи билан солиштириш қабул қилинган?
-
Табиий аминокислоталар қандай фазовий тузилишни намоён қиладилар?
-
α-Аминокислоталар металл катионлари билан қандай моддаларни ҳосил қила олади?
-
Аминокислоталарнинг дезаминланиши натижасида аминогруппа қандай қуйи молекуляр модда сифатида ажралади?