
- •Часть вторая Циклические соединения
- •Глава 10
- •Алициклические соединения
- •10.1. Способы получения
- •10.2. Химические свойства
- •10.3. Кислородсодержащие производные
- •10.4. Пяти- и шестичленные циклы
- •10.4.1. Способы получения
- •10.5. Циклопентан и его производные
- •10.5. Циклогексан и его производные
- •10.3. Взаимопревращения циклов
- •10.2.4. Полициклические алифатические соединения
- •Способы получения
- •10.2.6. Средние циклы и макроциклы
- •10.2.6.1. Производные циклогептана
- •10.2.6.2. Производное циклооктана
- •10.2.6.3. Макроциклы
- •10.2.6.4. Каркасные алициклы
- •10.2.6.5. Терпеноиды
- •Ароматический ряд
- •Глава 11 Арены
- •11.1. Строение бензола
- •11.2. Ароматичность
- •11.3. Изомерия и номенклатура
- •11.4. Способы получения
- •11.5. Химические свойства
- •Реакции замещения
- •Реакции присоединения
- •Реакции боковой цепи
- •11.5.10. Закономерности реакций электрофильного замещения
- •-Nh2, -nhr, -nr2, -oh, -nhcor, -or, -c6h5, , алкилы, галогены
- •11.5.10.1. Теория резонанса
- •11.5.10.2. Механизм электрофильного замещения в ароматическом ряду
- •11.5.10.2.1. Генерирование электрофильных частиц
- •11.5.10.2.2. Общий механизм электрофильного замещения
- •11.5.10.2.3. Влияние заместителей на скорость замещения
- •11.5.10.2.4. Влияние заместителей на ориентацию
- •11.5.10.2.5. Передача электронных эффектов при замещении
- •Глава 12 арилгалогениды
- •12.1. Методы получения
- •12.2. Химические свойства
- •12.3. Механизмы замещения ароматически связанного галогена
- •Глава 13 Сульфокислоты
- •13.1. Методы получения
- •13.2. Химические свойства
- •13.2.1. Реакции бензольного кольца
- •13.2.2. Реакции сульфогруппы
- •13.2.3. Замещение сульфогруппы
- •Ароматические соединения кислорода
- •Глава 14 Фенолы
- •14.1. Одноатомные фенолы
- •14.1.1. Методы получения
- •14.1.2. Химические свойства
- •Реакции с участием гидроксильной группы
- •Реакции с участием бензольного кольца
- •14.2. Многоатомные фенолы
- •14.2.2. Химические свойства
- •14.3. Хиноны
- •14.4. Ароматические спирты
- •Глава 15 Ароматические альдегиды и кетоны
- •15.1. Альдегиды
- •15.1.1. Методы получения
- •15.1.2. Химические свойства
- •15.2. Кетоны
- •15.2.1. Способы получения
- •15.2.2. Химические свойства
- •15.3.4. Карбоновые кислоты
- •15.3.1. Методы получения
- •15.3.2. Химические свойства
- •Ароматические азотсодержащие соединения
- •Глава 16 Нитросоединения
- •16.1. Получение нитросоединений нитрованием
- •16.2. Химические свойства
- •Глава 17 Амины
- •17.1. Методы получения
- •17.2. Химические свойства
- •Реакции по аминогруппе
- •17.2.1. Основность
- •Реакции с участием бензольного кольца
- •17.3. Соли диазония
- •17.3.1. Методы получения
- •17.3.2. Химические свойства
- •Реакции с выделением азота
- •Глава 18 Полициклические ароматические соединения
- •18.1. Ароматические соединения с изолированными бензольными кольцами
- •18.1.1. Группа дифенила
- •18.1.2. Полифенилалканы
- •18.2. Ароматические соединения с конденсированными бензольными ядрами
- •18.2.1. Нафталин
- •18.2.2. Антрацен и фенантрен
- •Глава 11 Гетероциклические соединения
- •11.2. Гетероциклические ароматические соединения
- •11.2.1. Фуран
- •Реакции электрофильного замещения
- •Реакции присоединения
- •Обмен гетероатома
- •Раскрытие кольца
- •Превращения функциональных производных
- •11.2.2. Пиррол
- •Реакции замещения
- •Реакции присоединения
- •Кислотно-основные свойства
- •Реакции окисления и восстановления
- •Биологически активные соединения на основе пиррола
- •11.2.3. Индол
- •11.4. Тиофен
- •Реакции присоединения
- •11.5. Пиридин
- •Реакции электрофильного замещения
- •Реакции нуклеофильного замещения
- •Пиридин как основание
- •Окисление, восстановление и раскрытие кольца пиридина
- •Оглавление
- •Глава 1. Общие положения органической химии………..
- •Глава 2. Углеводороды
- •Глава 3. Галогенпроизводные углеводородов………………..
- •Глава 4. Спирты и простые эфиры……………………………………
- •Глава 5. Альдегиды и кетоны………….
- •Глава 6. Карбоновые кислоты….
- •Глава 7. Азотсодержащие органические соединения
- •Глава 8. Углеводы….
- •Глава 9. Аминокислоты и белки…
- •Глава 10…
- •Глава 11..
- •Глава 12
- •Глава 13
- •Глава 14
- •Глава 15
- •Глава 16
- •Глава 17
- •Глава 18
- •Глава 19
10.2.6.3. Макроциклы
К ним относятся алициклические соединения, состоящие из 12 углеродных атомов.
Многие природные макроциклические соединения являются биологически активными веществами, поэтому представляют большой практический интерес. Все высшие кетоны обладают характерным запахом. Кетоны с 10, 11 и 12 атомами в цикле пахнут камфорой, с 14-18 атомами – мускусом. За способность удерживать молекулы душистого вещества экзальтон, мускон, цибетон и другие высшие кетоны используются в парфюмерии в качестве стабилизаторов запахов

10.2.6.4. Каркасные алициклы
Помимо мостиковых циклических соединений известны объемные циклические системы, в которых каждый из циклов сконденсирован с тремя или четырьмя соседними, например

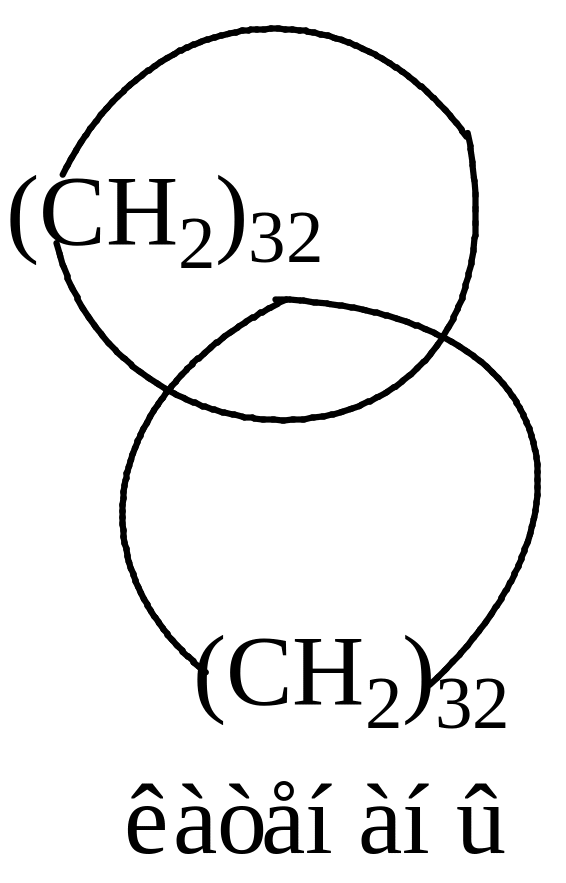
Фуллерены – соединения, состоящие исключительно из атомов углерода, соединенных в конденсированную поликарбоциклическую систему каркасного типа, состоящую из 12 пятизвенных циклов и нескольких шестизвенных.
Интересный ряд бициклических систем представляют собой катенаны. Катенаны отличаются от других бициклических алканов тем, что кольца в них связаны не валентными связями, а свободно ассоциированы, как звенья в цепи.
Разумеется, для подобных циклических соединений нет общих методов получения и в каждом случае они разрабатываются целенаправленно для конкретного объекта. Например, адамантан может быть получен изомеризацией полностью гидрированного димера циклопентадиена под действием AlCl3

10.2.6.5. Терпеноиды
Большую группу природных производных алициклических соединений представляют терпеноиды. Эти соединения выполняют важные биологические функции в живых организмах и растениях. Много лет назад было обнаружено, что активное начало запаха можно выделить из растений путем осторожного нагревания и конденсации пара на холодной поверхности. Выделяемые масла стали называть эфирными, из которых в последующем были выделены первые терпены (от немецкого terpentine). Терпены широко распространены в природе, они обнаружены не только в растениях, животных, но и в морских продуктах.
Структурное сходство многих монотерпеноидов и образование изопрена при их термическом разложении позволило предположить, что пятиуглеродный фрагмент является общей структурной единицей всех монотерпеноидов. Это структурное единство позволило Ружичке сформулировать в 1921 году известное «изопреновое правило», согласно которому углеродный скелет терпеноидов состоит из изопреновых фрагментов, связанных в определенном порядке. По мере накопления сведений о терпеноидах стали известны и примеры отступления от «изопренового» правила. Действительно, в результате метаболизма вполне допустимы перегруппировки, которые и могут приводить к отступлению от этого правила. Поэтому считается, что терпеноидами являются соединения, изначально образованные комбинацией изопреновых фрагментов, в результате которой возникают ациклические предшественники: гераниол, фарнезол,геранилгераниол, сквален и другие соединения. Таким образом, терпеноиды делятся на монотерпеноиды, в основе которых лежит С-10 углеродный скелет, сесквитерпеноиды (С-15), дитерпеноиды (С-20) и тритерпеноиды (С-30).
Все монотерпеновые соединения можно разделить на 3 основные группы: ациклические, моно-, би-, трициклические. Из ациклических моно- и сесквитерпеноидов в природе чаще всего встречаются соединения с 2,6-диметилоктановым скелетом

Гераниол и фарнезол широко распространены в природе и обнаружены в цитронелловом, розовом, апельсиновом и многих других эфирных маслах.
Наиболее интересны циклические терпеноиды. К моноциклическим терпеноидам относятся α,β-фелландрен и лимонен

Из бициклических монотерпеноидов наиболее распространены в природе α,β-пинены, ∆3-карен:
Аналогичным образом сесквитерпеноиды могут быть моно-, би- и трициклическими. Моноциклические сесквитерпеноиды α- и γ-гумулены содержат 11-членный цикл

В живицах хвойных деревьев найдены соединения группы гермакрана, содержащие 10-членный цикл

Бициклические сесквитерпеноиды широко представлены группой кадинана и другими группами, представляющими структуры, эпимерные кадинанам

Среди бициклических терпеноидов известны представители, содержащие аннелированные циклопентановые и циклогексановые, циклодекановые и циклобутановые фрагменты.
Группа лонгифолана представляет трициклические терпеноиды. Тетрациклические сесквитерпеноиды содержатся в смолах различных видов хвойных растений.
Большой класс биологически активных дитерпеноидов, обнаруженных на земле, а также выделенных из морских источников представляют многочисленные производные цембрана

По сравнению с цембраноидами бициклические дитерпеноиды лабданового ряда представлены значительно большим числом соединений

Один из производных лабдана, обладающий понижающим кровяное давление (гипертензивным) действием и эффективным современным препаратом для лечения глаукомы, является форсколин, впервые выделенный из растения, произрастающего в Индии.
К дитерпеноидам относятся новые уникальные по своим биологическим свойствам цитотоксические агенты таксол, элеутеробин, эпотилоны. На их основе созданы или находятся на стадии разработки эффективные противораковые лекарственные препараты

Таксол представляет собой тетрациклический дитерпеноид, обнаруженный в 1962 году в коре тиса Texus brevifolia.
Форсколин является примером того, что бициклические дитерпеноиды в ходе ферментативных трансформаций в биологических объектах, называемых метаболизмом, могут превращаться в трициклические. Аналогичным образом эти превращения могут происходить и между низшими и высшими терпеноидами.
Таким образом, биогенетическую связь между различными классами терпеноидов отражает схема, основанная на последовательной олигомеризации изопентенилпирофосфата

