
- •Часть вторая Циклические соединения
- •Глава 10
- •Алициклические соединения
- •10.1. Способы получения
- •10.2. Химические свойства
- •10.3. Кислородсодержащие производные
- •10.4. Пяти- и шестичленные циклы
- •10.4.1. Способы получения
- •10.5. Циклопентан и его производные
- •10.5. Циклогексан и его производные
- •10.3. Взаимопревращения циклов
- •10.2.4. Полициклические алифатические соединения
- •Способы получения
- •10.2.6. Средние циклы и макроциклы
- •10.2.6.1. Производные циклогептана
- •10.2.6.2. Производное циклооктана
- •10.2.6.3. Макроциклы
- •10.2.6.4. Каркасные алициклы
- •10.2.6.5. Терпеноиды
- •Ароматический ряд
- •Глава 11 Арены
- •11.1. Строение бензола
- •11.2. Ароматичность
- •11.3. Изомерия и номенклатура
- •11.4. Способы получения
- •11.5. Химические свойства
- •Реакции замещения
- •Реакции присоединения
- •Реакции боковой цепи
- •11.5.10. Закономерности реакций электрофильного замещения
- •-Nh2, -nhr, -nr2, -oh, -nhcor, -or, -c6h5, , алкилы, галогены
- •11.5.10.1. Теория резонанса
- •11.5.10.2. Механизм электрофильного замещения в ароматическом ряду
- •11.5.10.2.1. Генерирование электрофильных частиц
- •11.5.10.2.2. Общий механизм электрофильного замещения
- •11.5.10.2.3. Влияние заместителей на скорость замещения
- •11.5.10.2.4. Влияние заместителей на ориентацию
- •11.5.10.2.5. Передача электронных эффектов при замещении
- •Глава 12 арилгалогениды
- •12.1. Методы получения
- •12.2. Химические свойства
- •12.3. Механизмы замещения ароматически связанного галогена
- •Глава 13 Сульфокислоты
- •13.1. Методы получения
- •13.2. Химические свойства
- •13.2.1. Реакции бензольного кольца
- •13.2.2. Реакции сульфогруппы
- •13.2.3. Замещение сульфогруппы
- •Ароматические соединения кислорода
- •Глава 14 Фенолы
- •14.1. Одноатомные фенолы
- •14.1.1. Методы получения
- •14.1.2. Химические свойства
- •Реакции с участием гидроксильной группы
- •Реакции с участием бензольного кольца
- •14.2. Многоатомные фенолы
- •14.2.2. Химические свойства
- •14.3. Хиноны
- •14.4. Ароматические спирты
- •Глава 15 Ароматические альдегиды и кетоны
- •15.1. Альдегиды
- •15.1.1. Методы получения
- •15.1.2. Химические свойства
- •15.2. Кетоны
- •15.2.1. Способы получения
- •15.2.2. Химические свойства
- •15.3.4. Карбоновые кислоты
- •15.3.1. Методы получения
- •15.3.2. Химические свойства
- •Ароматические азотсодержащие соединения
- •Глава 16 Нитросоединения
- •16.1. Получение нитросоединений нитрованием
- •16.2. Химические свойства
- •Глава 17 Амины
- •17.1. Методы получения
- •17.2. Химические свойства
- •Реакции по аминогруппе
- •17.2.1. Основность
- •Реакции с участием бензольного кольца
- •17.3. Соли диазония
- •17.3.1. Методы получения
- •17.3.2. Химические свойства
- •Реакции с выделением азота
- •Глава 18 Полициклические ароматические соединения
- •18.1. Ароматические соединения с изолированными бензольными кольцами
- •18.1.1. Группа дифенила
- •18.1.2. Полифенилалканы
- •18.2. Ароматические соединения с конденсированными бензольными ядрами
- •18.2.1. Нафталин
- •18.2.2. Антрацен и фенантрен
- •Глава 11 Гетероциклические соединения
- •11.2. Гетероциклические ароматические соединения
- •11.2.1. Фуран
- •Реакции электрофильного замещения
- •Реакции присоединения
- •Обмен гетероатома
- •Раскрытие кольца
- •Превращения функциональных производных
- •11.2.2. Пиррол
- •Реакции замещения
- •Реакции присоединения
- •Кислотно-основные свойства
- •Реакции окисления и восстановления
- •Биологически активные соединения на основе пиррола
- •11.2.3. Индол
- •11.4. Тиофен
- •Реакции присоединения
- •11.5. Пиридин
- •Реакции электрофильного замещения
- •Реакции нуклеофильного замещения
- •Пиридин как основание
- •Окисление, восстановление и раскрытие кольца пиридина
- •Оглавление
- •Глава 1. Общие положения органической химии………..
- •Глава 2. Углеводороды
- •Глава 3. Галогенпроизводные углеводородов………………..
- •Глава 4. Спирты и простые эфиры……………………………………
- •Глава 5. Альдегиды и кетоны………….
- •Глава 6. Карбоновые кислоты….
- •Глава 7. Азотсодержащие органические соединения
- •Глава 8. Углеводы….
- •Глава 9. Аминокислоты и белки…
- •Глава 10…
- •Глава 11..
- •Глава 12
- •Глава 13
- •Глава 14
- •Глава 15
- •Глава 16
- •Глава 17
- •Глава 18
- •Глава 19
10.3. Кислородсодержащие производные
Циклопропанон существует в неустойчивой гидратированной форме, легко изомеризующейся в пропионовую кислоту. Он получен взаимодействием кетена, диазометана и воды
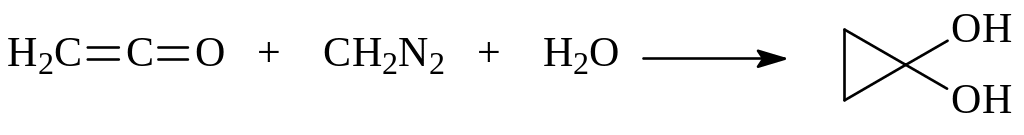
В отсутствии воды эта реакция приводит через стадию взаимодействия промежуточного циклопропанона со второй молекулой диазометана к циклобутанону


Циклобутандион-1,3 получен взаимодействием этинилэтилового эфира с кетеном

Циклобутандион-1,3 представляет собой бесцветные пластинки с температурой плавления 119-120ºС. Как и все 1,3-дикетоны он заметно енолизирован.
Карбоновые кислоты циклопропанового и циклобутанового ряда являются более стабильными соединениями. Синтез эфира циклобутан-1,1-дикарбоновой кислоты по Перкину приведен выше. Димеризацией α,β-непредельных кислот получаются циклобутан-1,3-дикарбоновые кислоты

Для получения циклопропанкарбоновых кислот широко используется реакция непредельных кислот с диазосоединениями

Циклопропанкарбоновая кислота может быть получена из нитрила γ-броммасляной кислоты

Из карбоновых кислот могут быть получены другие функциональные производные циклоалканов.
Среди природных соединений, содержащих фрагмент циклопропанкарбоновой кислоты можно отметить транс-хризантемовую кислоту, эфиры которой образуют класс пиретроидов-инсектицидов малоопасных для теплокровных.
10.4. Пяти- и шестичленные циклы
10.4.1. Способы получения
Аналогично получению низших циклов циклопентан и циклогексан могут быть синтезированы из 1,5-дибромпроизводных действием амальгамы лития

Алициклические кетоны с размерами циклов от 5 до 7 с удовлетворительными выходами можно получать из солей дикарбоновых кислот (Пириа), а также сложноэфирной конденсацией их диэфиров (Дикман) или динитрилов (Торы). По реакции Дикмана образуется α-алкоксикарбонилциклические кетоны

По Тору соответствующие нитрилы, а по Пириа – пиролиз солей сопровождается одновременным декарбоксилированием с образованием циклического кетона.
При проведении смешанной сложноэфирной конденсации с использованием диэфиров различных дикислот возможно получение сложноэфирных циклических ди- и трикетонов.
Циклогексан и его простые производные можно получить каталитическим гидрированием под давлением ароматических аналогов

Важным способом синтеза производных циклогексена является диеновый синтез Дильса-Альдера

Представленная реакция имеет теоретическое значение. На практике для эффективного протекания реакции используют диен, имеющий электронодонорный заместитель и диенофил – электроноакцепторный

10.5. Циклопентан и его производные
Из природных источников циклопентана можно отметить нефть, в которой содержатся углеводороды состава CnH2n называемые нафтенами.
Циклопентановое ядро входит в состав многих биологически активных соединений, выделяемых из животных и растительных объектов.
В состав эфирных масел некоторых тропических растений входят жирные кислоты, содержащие циклопентеновое ядро. Циклопентеновое кольцо содержат также ауксины – природные стимуляторы роста растений.
Наиболее известные из циклопентенов душистые вещества жасмоны и соединения более сложной структуры простагландины, являющиеся биорегуляторами.
Производные циклопентана проще всего получать по рассмотренной выше реакции из эфиров адипиновой кислоты конденсацией Дикмана. Уже исходя из циклопентанона, используя реакции, известные для кетонов алифатического ряда, возможно получение широкого круга непредельных или функциональных производных циклопентана. Это оказывается возможным вследствие высокой стабильности цикла – циклопентановое кольцо размыкается в очень жестких условиях при 250-300ºС над платиновым катализатором.
Важным промышленным продуктом, получаемым из газов коксования, головного погона сырого бензола, продуктов пиролиза керосина или бензина, является циклопентадиен. Одной из причин необычных химических свойств циклопентадиена является настолько высокая подвижность водородных атомов метиленовой группы, что один из водородов может быть замещен на натрий. В полученном циклопентадиениле натрия все атомы углерода уже равноценны, а сам анион приобретает все признаки ароматической системы.

Обработкой циклопентадиенила натрия галоидалкилами могут быть получены гомологи циклопентадиена

Взаимодействием с хлоридами металлов могут быть получены металлоорганические соединения сэндвичевой структуры - металлоцены. Например, при взаимодействии с хлоридом железа (II) образуется ферроцен
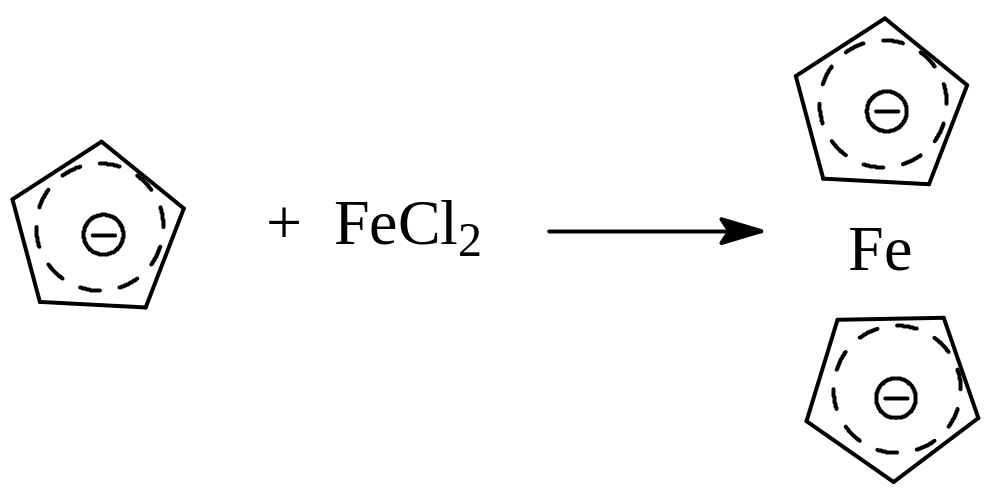
Замещением этильной группы в этилмагнийбромиде возможно получение реактива Гриньяра на основе циклопентадиена

В качестве лиганда циклопентадиенил анион входит в состав металлокомплексных соединений, являющихся катализаторами важных процессов.
Вследствие высокой подвижности атомов водорода в ЦПД достаточно легко идет образование фульвенов в реакции конденсации с альдегидами и кетонами

Циклопентадиен является весьма активным диеном и одновременно диенофилом быстро димеризуясь при хранении

При нагревании он мономеризуется по ретро-реакции Дильса-Альдера. Достаточно легко он вступает в диеновый синтез с активными диенофилами

