
- •Часть вторая Циклические соединения
- •Глава 10
- •Алициклические соединения
- •10.1. Способы получения
- •10.2. Химические свойства
- •10.3. Кислородсодержащие производные
- •10.4. Пяти- и шестичленные циклы
- •10.4.1. Способы получения
- •10.5. Циклопентан и его производные
- •10.5. Циклогексан и его производные
- •10.3. Взаимопревращения циклов
- •10.2.4. Полициклические алифатические соединения
- •Способы получения
- •10.2.6. Средние циклы и макроциклы
- •10.2.6.1. Производные циклогептана
- •10.2.6.2. Производное циклооктана
- •10.2.6.3. Макроциклы
- •10.2.6.4. Каркасные алициклы
- •10.2.6.5. Терпеноиды
- •Ароматический ряд
- •Глава 11 Арены
- •11.1. Строение бензола
- •11.2. Ароматичность
- •11.3. Изомерия и номенклатура
- •11.4. Способы получения
- •11.5. Химические свойства
- •Реакции замещения
- •Реакции присоединения
- •Реакции боковой цепи
- •11.5.10. Закономерности реакций электрофильного замещения
- •-Nh2, -nhr, -nr2, -oh, -nhcor, -or, -c6h5, , алкилы, галогены
- •11.5.10.1. Теория резонанса
- •11.5.10.2. Механизм электрофильного замещения в ароматическом ряду
- •11.5.10.2.1. Генерирование электрофильных частиц
- •11.5.10.2.2. Общий механизм электрофильного замещения
- •11.5.10.2.3. Влияние заместителей на скорость замещения
- •11.5.10.2.4. Влияние заместителей на ориентацию
- •11.5.10.2.5. Передача электронных эффектов при замещении
- •Глава 12 арилгалогениды
- •12.1. Методы получения
- •12.2. Химические свойства
- •12.3. Механизмы замещения ароматически связанного галогена
- •Глава 13 Сульфокислоты
- •13.1. Методы получения
- •13.2. Химические свойства
- •13.2.1. Реакции бензольного кольца
- •13.2.2. Реакции сульфогруппы
- •13.2.3. Замещение сульфогруппы
- •Ароматические соединения кислорода
- •Глава 14 Фенолы
- •14.1. Одноатомные фенолы
- •14.1.1. Методы получения
- •14.1.2. Химические свойства
- •Реакции с участием гидроксильной группы
- •Реакции с участием бензольного кольца
- •14.2. Многоатомные фенолы
- •14.2.2. Химические свойства
- •14.3. Хиноны
- •14.4. Ароматические спирты
- •Глава 15 Ароматические альдегиды и кетоны
- •15.1. Альдегиды
- •15.1.1. Методы получения
- •15.1.2. Химические свойства
- •15.2. Кетоны
- •15.2.1. Способы получения
- •15.2.2. Химические свойства
- •15.3.4. Карбоновые кислоты
- •15.3.1. Методы получения
- •15.3.2. Химические свойства
- •Ароматические азотсодержащие соединения
- •Глава 16 Нитросоединения
- •16.1. Получение нитросоединений нитрованием
- •16.2. Химические свойства
- •Глава 17 Амины
- •17.1. Методы получения
- •17.2. Химические свойства
- •Реакции по аминогруппе
- •17.2.1. Основность
- •Реакции с участием бензольного кольца
- •17.3. Соли диазония
- •17.3.1. Методы получения
- •17.3.2. Химические свойства
- •Реакции с выделением азота
- •Глава 18 Полициклические ароматические соединения
- •18.1. Ароматические соединения с изолированными бензольными кольцами
- •18.1.1. Группа дифенила
- •18.1.2. Полифенилалканы
- •18.2. Ароматические соединения с конденсированными бензольными ядрами
- •18.2.1. Нафталин
- •18.2.2. Антрацен и фенантрен
- •Глава 11 Гетероциклические соединения
- •11.2. Гетероциклические ароматические соединения
- •11.2.1. Фуран
- •Реакции электрофильного замещения
- •Реакции присоединения
- •Обмен гетероатома
- •Раскрытие кольца
- •Превращения функциональных производных
- •11.2.2. Пиррол
- •Реакции замещения
- •Реакции присоединения
- •Кислотно-основные свойства
- •Реакции окисления и восстановления
- •Биологически активные соединения на основе пиррола
- •11.2.3. Индол
- •11.4. Тиофен
- •Реакции присоединения
- •11.5. Пиридин
- •Реакции электрофильного замещения
- •Реакции нуклеофильного замещения
- •Пиридин как основание
- •Окисление, восстановление и раскрытие кольца пиридина
- •Оглавление
- •Глава 1. Общие положения органической химии………..
- •Глава 2. Углеводороды
- •Глава 3. Галогенпроизводные углеводородов………………..
- •Глава 4. Спирты и простые эфиры……………………………………
- •Глава 5. Альдегиды и кетоны………….
- •Глава 6. Карбоновые кислоты….
- •Глава 7. Азотсодержащие органические соединения
- •Глава 8. Углеводы….
- •Глава 9. Аминокислоты и белки…
- •Глава 10…
- •Глава 11..
- •Глава 12
- •Глава 13
- •Глава 14
- •Глава 15
- •Глава 16
- •Глава 17
- •Глава 18
- •Глава 19
Глава 12 арилгалогениды
В соединениях, содержащих бензольное кольцо, атомы галогена могут находиться в кольце или же в боковой цепи. Обычно к арилгалогенидам относят только соединения первого типа. Это, вполне оправдано, поскольку соединения с галогеном в боковой цепи, как по способам получения, так и химическим свойствам, напоминают уже рассмотренные галогеналканы.
Среди арилгалогенидов, а они могут содержать в кольце и другие функциональные группы, наиболее часто встречаются следующие
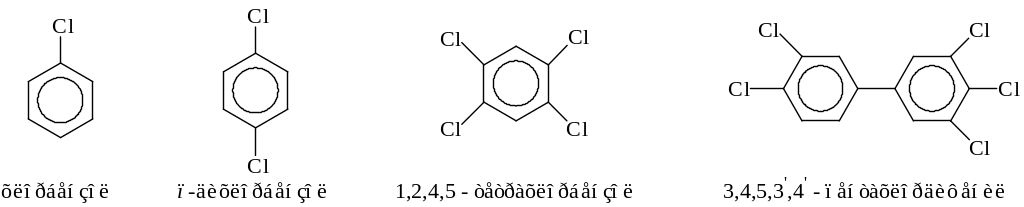

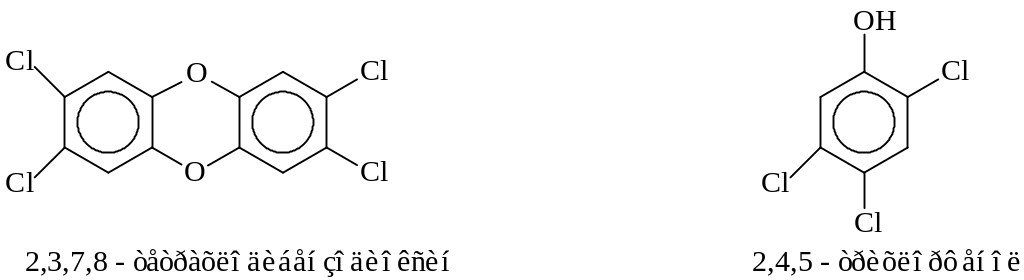
Из приведенных названий можно видеть, что названия соединений составляются с использованием обычных правил тривиальной, рациональной или же систематической номенклатур.
12.1. Методы получения
Прямое введение галогена в ароматическое кольцо. Для получения простейших арилгалогенидов, прямое введение галогена в реакциях хлорирования и бромирования аренов является, по-видимому, наиболее подходящим методом. Галогенирование аренов происходит в присутствии катализаторов, чаще всего – кислот Льюиса: FeCl3, AlCl3 и др. При хлорировании избытком хлора реакция идет вплоть до гексахлорбензола
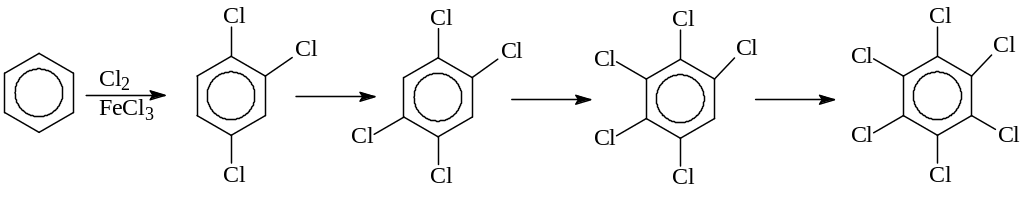
Подбором условий проведения реакции можно получить любой из хлорбензолов, представленных в схеме.
Аналогично протекает бромирование бензола и других аренов.
Иодирование ароматических соединений может происходить и без использования обычных в таких случаях катализаторов, однако оно идет лишь при участии в реакции активных исходных продуктов, таких как фенолы и амины. Сам бензол и алкилбензолы иодом непосредственно не иодируются. Реакцию удается осуществить лишь при её проведении в условиях, когда иодистоводородная кислота, выделяющаяся при иодировании, сразу же окисляется и разрушается. Для этого реакцию проводят в присутствии иодноватой кислоты или нитрующей смеси.
Фторпроизводные бензола также не удается получить прямым фторированием. Из-за чрезмерной активности фтора реакция идет до четырехфтористого углерода и фтористого водорода.
Получение арилгалогенидов через соли диазония. Этот метод характеризуется универсальностью. Через соли диазония (этот класс соединений будет рассмотрен дальше) могут быть получены все возможные арилгалогениды. Сами соли диазония синтезируются из первичных аминов реакцией с азотистой кислотой (соляная кислота и нитрит натрия). Соли диазония в условиях реакции Зандмейера диазогруппу замещают на хлор или бром

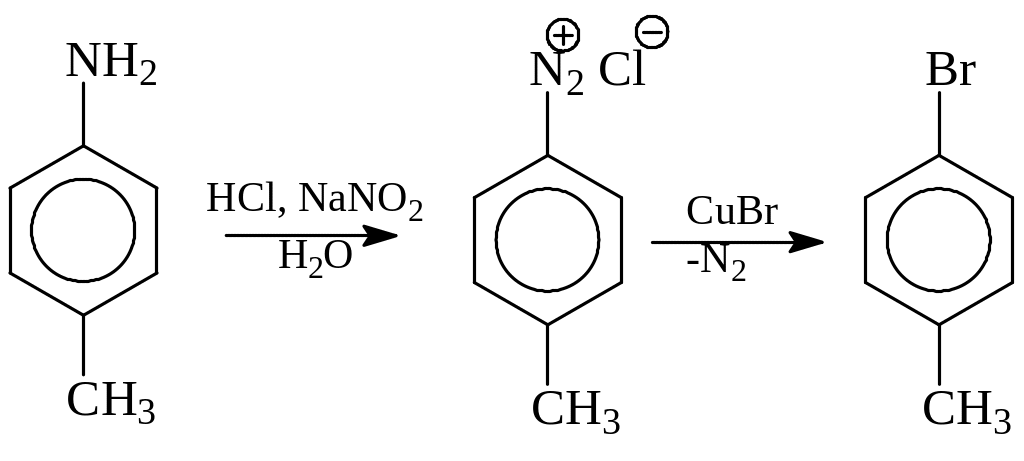
Особенно ценно то, что через соли диазония с хорошими выходами можно получить йод- или фторбензолы

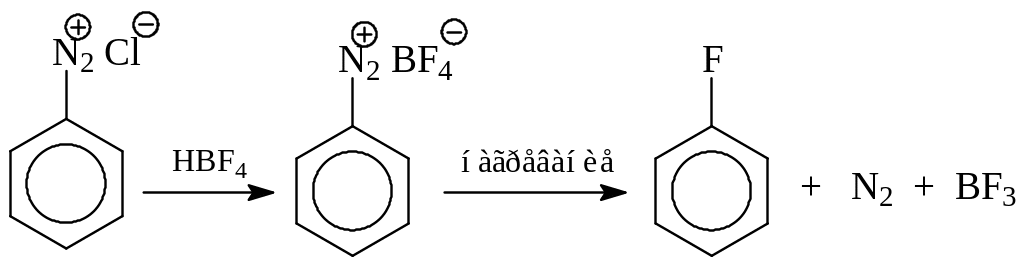
Как видно из приведенной схемы, при синтезе фторпроизводных вначале получают борфторид диазония, который затем при нагревании дает арилфторид, азот и трехфтористый бор (реакция Шимана).
Использование различных реакций. Очень часто важнейшие с точки зрения практического использования галогенпроизводные аренов получают дальнейшими трансформациями более простых арилгалогенидов. Рассмотрим несколько примеров.
Первым из органических соединений, положившим начало химической войне с вредными насекомыми, был ДДТ. Инсектицидные свойства ДДТ были установлены еще в 1937 г (Мюллер), а промышленное применение начато в 1942 г. (Швейцария). ДДТ получается конденсацией хлорбензола с трихлоруксусным альдегидом в присутствии H2SO4 (Цейдлер, 1874 г.)
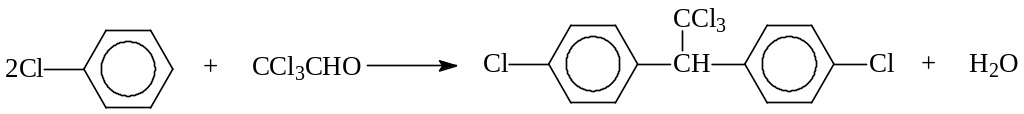
В настоящее время ДДТ как инсектицид не применяется.
Широко используемое средство борьбы с сорной растительностью (гербицид) – 2,4-дихлорфеноксиуксусная кислота получается реакцией Вильямсона из 2,4-дихлорфенолята натрия и монохлоруксусной кислоты

Аналогично из 2,4,5-трихлорфенола и монохлоруксусной кислоты получается еще один представитель гербицидов – 2,4,5-Т

Следует отметить, что смесь бутиловых эфиров 2,4-Д и 2,4,5-Т, под названием «оранжевый препарат», использовался армией США в войне против Вьетнама (1962-71 г.) для уничтожения растительности, лесов и посевов риса.
Производные 2,4,5-трихлорфенола используются для обработки семян хлопчатника, для защиты лесов от вредителей, как исходный продукт при получении 2,4,5-Т. Сам упомянутый трихлорфенол является продуктом щелочного гидролиза 1,2,4,5-тетрахлорбензола (растворитель – смесь этиленгликоля и ксилола, 1600С)
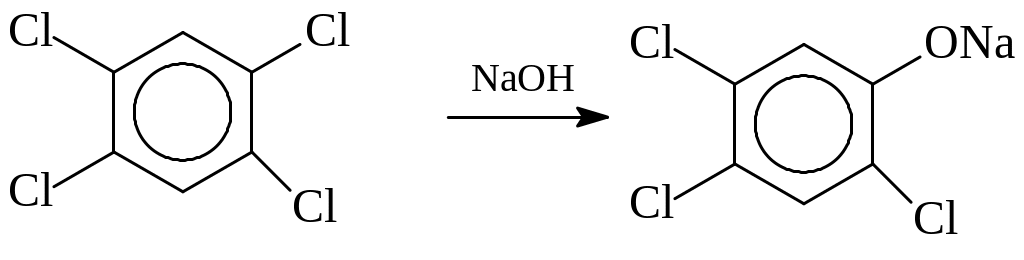
Эта достаточно простая реакция печально известна тем, что ее практическое осуществление часто сопровождается взрывами и химическим загрязнением окружающей среды диоксинами (Севезо в Италии, 1976 г.).
