
- •Часть вторая Циклические соединения
- •Глава 10
- •Алициклические соединения
- •10.1. Способы получения
- •10.2. Химические свойства
- •10.3. Кислородсодержащие производные
- •10.4. Пяти- и шестичленные циклы
- •10.4.1. Способы получения
- •10.5. Циклопентан и его производные
- •10.5. Циклогексан и его производные
- •10.3. Взаимопревращения циклов
- •10.2.4. Полициклические алифатические соединения
- •Способы получения
- •10.2.6. Средние циклы и макроциклы
- •10.2.6.1. Производные циклогептана
- •10.2.6.2. Производное циклооктана
- •10.2.6.3. Макроциклы
- •10.2.6.4. Каркасные алициклы
- •10.2.6.5. Терпеноиды
- •Ароматический ряд
- •Глава 11 Арены
- •11.1. Строение бензола
- •11.2. Ароматичность
- •11.3. Изомерия и номенклатура
- •11.4. Способы получения
- •11.5. Химические свойства
- •Реакции замещения
- •Реакции присоединения
- •Реакции боковой цепи
- •11.5.10. Закономерности реакций электрофильного замещения
- •-Nh2, -nhr, -nr2, -oh, -nhcor, -or, -c6h5, , алкилы, галогены
- •11.5.10.1. Теория резонанса
- •11.5.10.2. Механизм электрофильного замещения в ароматическом ряду
- •11.5.10.2.1. Генерирование электрофильных частиц
- •11.5.10.2.2. Общий механизм электрофильного замещения
- •11.5.10.2.3. Влияние заместителей на скорость замещения
- •11.5.10.2.4. Влияние заместителей на ориентацию
- •11.5.10.2.5. Передача электронных эффектов при замещении
- •Глава 12 арилгалогениды
- •12.1. Методы получения
- •12.2. Химические свойства
- •12.3. Механизмы замещения ароматически связанного галогена
- •Глава 13 Сульфокислоты
- •13.1. Методы получения
- •13.2. Химические свойства
- •13.2.1. Реакции бензольного кольца
- •13.2.2. Реакции сульфогруппы
- •13.2.3. Замещение сульфогруппы
- •Ароматические соединения кислорода
- •Глава 14 Фенолы
- •14.1. Одноатомные фенолы
- •14.1.1. Методы получения
- •14.1.2. Химические свойства
- •Реакции с участием гидроксильной группы
- •Реакции с участием бензольного кольца
- •14.2. Многоатомные фенолы
- •14.2.2. Химические свойства
- •14.3. Хиноны
- •14.4. Ароматические спирты
- •Глава 15 Ароматические альдегиды и кетоны
- •15.1. Альдегиды
- •15.1.1. Методы получения
- •15.1.2. Химические свойства
- •15.2. Кетоны
- •15.2.1. Способы получения
- •15.2.2. Химические свойства
- •15.3.4. Карбоновые кислоты
- •15.3.1. Методы получения
- •15.3.2. Химические свойства
- •Ароматические азотсодержащие соединения
- •Глава 16 Нитросоединения
- •16.1. Получение нитросоединений нитрованием
- •16.2. Химические свойства
- •Глава 17 Амины
- •17.1. Методы получения
- •17.2. Химические свойства
- •Реакции по аминогруппе
- •17.2.1. Основность
- •Реакции с участием бензольного кольца
- •17.3. Соли диазония
- •17.3.1. Методы получения
- •17.3.2. Химические свойства
- •Реакции с выделением азота
- •Глава 18 Полициклические ароматические соединения
- •18.1. Ароматические соединения с изолированными бензольными кольцами
- •18.1.1. Группа дифенила
- •18.1.2. Полифенилалканы
- •18.2. Ароматические соединения с конденсированными бензольными ядрами
- •18.2.1. Нафталин
- •18.2.2. Антрацен и фенантрен
- •Глава 11 Гетероциклические соединения
- •11.2. Гетероциклические ароматические соединения
- •11.2.1. Фуран
- •Реакции электрофильного замещения
- •Реакции присоединения
- •Обмен гетероатома
- •Раскрытие кольца
- •Превращения функциональных производных
- •11.2.2. Пиррол
- •Реакции замещения
- •Реакции присоединения
- •Кислотно-основные свойства
- •Реакции окисления и восстановления
- •Биологически активные соединения на основе пиррола
- •11.2.3. Индол
- •11.4. Тиофен
- •Реакции присоединения
- •11.5. Пиридин
- •Реакции электрофильного замещения
- •Реакции нуклеофильного замещения
- •Пиридин как основание
- •Окисление, восстановление и раскрытие кольца пиридина
- •Оглавление
- •Глава 1. Общие положения органической химии………..
- •Глава 2. Углеводороды
- •Глава 3. Галогенпроизводные углеводородов………………..
- •Глава 4. Спирты и простые эфиры……………………………………
- •Глава 5. Альдегиды и кетоны………….
- •Глава 6. Карбоновые кислоты….
- •Глава 7. Азотсодержащие органические соединения
- •Глава 8. Углеводы….
- •Глава 9. Аминокислоты и белки…
- •Глава 10…
- •Глава 11..
- •Глава 12
- •Глава 13
- •Глава 14
- •Глава 15
- •Глава 16
- •Глава 17
- •Глава 18
- •Глава 19
Реакции боковой цепи
В аренах в качестве боковых цепей выступают остатки предельных или непредельных углеводородов. Понятно, что в некоторых случаях арены могут участвовать в химических реакциях за счет своих боковых цепей. При этом алкильные заместители придадут арену способность реагировать как алканы, для которых наиболее характерными реакциями являются реакции свободно-радикального замещения. Если в боковой цепи арена находится алкенильная группа, то для него становятся возможными реакции электрофильного присоединения. Бензольное кольцо, сохраняющееся в ходе этих реакций, влияет на скорость и направление соответствующих превращений.
Некоторые из реакций с участием боковой цепи уже рассматривались. Это реакции свободно-радикального хлорирования, восстановления жирно-ароматических кетонов и дегидрирование алкилбензолов. Расширим круг этих реакций новыми примерами.
Окисление аренов. Само бензольное кольцо отличается необыкновенной устойчивостью к действию окислителей. В этом проявляется так называемый ароматический характер. Обычные окислительные реагенты: CrO3, KMnO4, H2O2, OsO4, которые применяются при окислении алкенов, окислить бензол не могут. Конечно, в очень жестких условиях можно окислить и бензольное кольцо. Для этого требуется 450-5000C и наличие катализатора – пятиокиси ванадия. При окислении бензола кислородом воздуха в указанных условиях бензольное кольцо разрушается и получается малеиновый ангидрид

Возможно, это один из лучших технических способов получения малеинового ангидрида.
Все сказанное относительно устойчивости к действию окислителей касается самого бензольного кольца, но не боковых цепей в аренах. Алкильные боковые заместители, в отличие от самих алканов, способны окисляться даже перманганатом калия в водном растворе щелочи.

Толуол окисляется уже при 950C количественным выходом в бензойную кислоту.
Интересно отметить, что при окислении аренов действие окислителя всегда направлено на ближайший к бензольному кольцу атом углерода боковой цепи. Поэтому алкилбензолы независимо от длины боковой цепи окисляются в бензойную кислоту

В то же время если этот углерод является четвертичным и не содержит водородного атома, то такой арен в обычных условиях окисления боковой цепи не способен окисляться

Если бензольное кольцо содержит несколько алкильных групп, то подбором окислителя и условий проведения реакции можно выборочно окислить только один из алкилов. Например, горячей азотной кислотой можно окислить только один из метилов в о-ксилоле

или изопропильную группу в п-цимоле
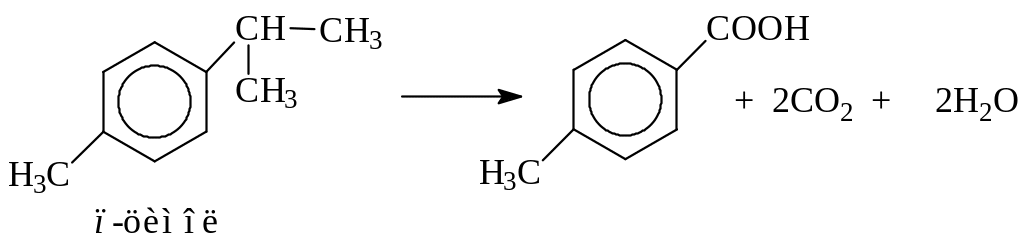
![]()
Окисление алкилбензолов широко используется для получения терефталевой кислоты из п-ксилола (мировое производство около 5 млн. т). Окисление ведут кислородом воздуха в присутствии солей кобальта

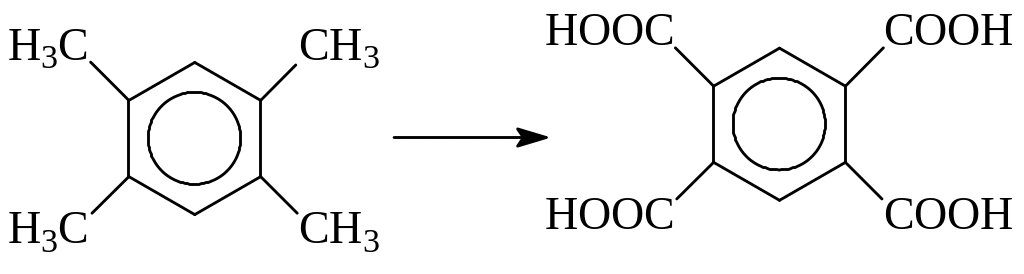
При окислении 1,2,4,5-тетраметилбензола (дурола) образуется весьма ценная четырехосновная ароматическая кислота (пиромеллитовая кислота), которая используется при получении полиэфиров
11.5.9. Реакции присоединения к алкенилбензолам. В молекуле алкенилбензолов имеется бензольное кольцо и в качестве боковой цепи – остаток непредельного углеводорода. Эти две функциональные группы относительно друг друга могут занимать различное положение. В том случае, если двойная связь далека от кольца, то эти структурные единицы будут слабо влиять на реакционную способность друг друга. Наиболее интересным представляется случай, когда кольцо и двойная связь сопряжены. При этом бензольное кольцо в наибольшей степени будет влиять на скорость и направление реакции электрофильного и радикального присоединения к кратной связи.
Рассмотрим гидробромирование 1-фенилпропена. В результате этой реакции получается 1-бром-1-фенилпропан (в отсутствии перекисей) или 2-бром-1-фенилпропан (в присутствии перекисей)

Понятно, что в случае проведения реакции в присутствии перекисей она протекает с промежуточным образованием радикалов

Ранее уже обсуждалось, что бензиловый радикал, а также радикалы бензилового типа, относятся к наиболее устойчивым радикалам. Поэтому нет ничего удивительного в том, что гомолитическое присоединение протекает через наиболее устойчивый радикал с образованием 2-бром-1-фенилпропана

Ионное присоединение также протекает с промежуточным образованием наиболее стабильного карбокатиона бензилового типа. Подсчитаем расход энергии при получении бензилового карбокатиона из толуола. Эта энергия будет складываться из энергии диссоциации толуола (326,59 кДж) и энергии ионизации бензилового радикала (749,47 кДж). Отсюда видно, что для получения бензилового карбокатиона надо затратить 1076,06 кДж. Для сравнения: для метильного карбокатиона – 1390,08 кДж, для трет-бутильного карбокатиона – 1096,99 кДж. Сравнение вышеприведенных величин показывает, что бензильный карбокатион должен обладать почти такой стабильностью, что и трет-бутильный карбокатион. Считается, что устойчивость рассматриваемого карбокатиона связана с его резонансной стабилизацией с участием бензольного ядра. Другими словами, положительный заряд бензилового иона рассредоточен с участием бензола настолько эффективно, что этот ион относится к числу наиболее устойчивых. Вспомним правило - то, что устойчиво, легче образуется. Поэтому реакция ионного гидробромирования пропенилбензола протекает с промежуточным образованием катиона бензилового типа с получением 1-бром-1-фенилпропана

Рассматривая реакции алкенилбензолов, в которых двойная связь сопряжена с бензольным ядром, отметим, что подобные соединения легко полимеризуются. Общеизвестный пример – стирол, который в присутствии следов инициатора – перекиси бензоила, полимеризуется в полистирол

