
Хирургия пищевода руководство для врачей. Черноусов А.Ф
..pdf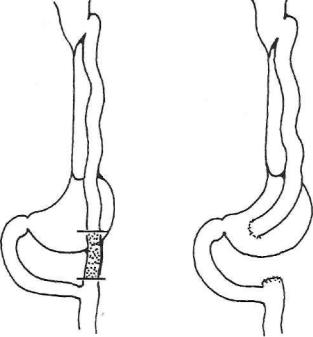
Рис. 56. Операция вклю чения желудка в пище варение после тонкоки шечной эзофагопластики по Ру— Герцену— Юдину.
торику желудочно-кишечного тракта (церукал, реглан, мотилиум), антацидные средства (алмагель, фосфалюгель, маалокс, гастрофарм, викалин). При высокой желудочной секреции назначают блокаторы Н2-ре- цепторов (ранисан или зантаг, квамател), блокаторы мускариновых ре цепторов париетальных клеток (гастроцепин).
При агастральной астении полезны внутривенные вливания глюкозы с инсулином и витамином С, плазмы, а при необходимости и крови (эритроцитной массы), комплекс витаминов группы В, общеукрепляю щие и тонизирующие средства (женьшень, золотой корень, китайский лимонник, элеутерококк, прополис и пр.). При отсутствии значительного эффекта показана реконструктивная операция — включение желудка в акт пищеварения одним из оперативных способов (рис. 56).
При рубцовой стриктуре анастомоза пищевода или глотки с транс плантатом лечение следует начинать с консервативных мероприятий — бужирования и эндоскопической баллонной гидродилатации. Если по каким-либо причинам такое лечение не удается (полное заращение анас томоза, невозможность провести через стриктуру направляющую струну или дилататор, быстрый рецидив стриктуры), возникают показания к ре конструктивной операции. При короткой стриктуре анастомоза «бок в бок» на шее стриктуру циркулярно иссекают через разрез на транспланта те. В других случаях, например при стриктуре пищеводно-тощекишечно- го анастомоза по типу «конец в конец», предпочтительнее выполнить его резекцию с формированием нового анастомоза такого же типа.
При стриктуре внутриплеврального пищеводного анастомоза задача сильно усложняется. По понятным причинам реконструктивная опера-
130
medwedi.ru
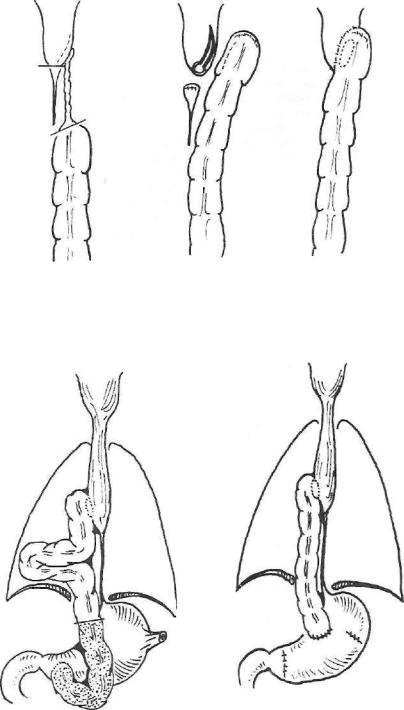
Рис. 57. Реконструкция шейного анастомоза после эзофагопластики из илеоколон, осложнившейся рубцеванием и облитерацией отрезка подвздошной кишки в результате ишемии.
Рис. 58. Операция резекции избыточной петли толстокишечного трансплантата после внутриплевральной эзофагопластики.
131
ция в такой ситуации представляет значительные трудности, поэтому таких пациентов обычно пытаются как можно настойчивее лечить кон сервативно (длительные курсы бужирования или дилатации).
После эзофагопластики правой половиной толстой кишки с участком подвздошной иногда из-за недостаточности кровообращения сегмент подвздошной кишки, соединенный с пищеводом или глоткой, замещает ся соединительной тканью и полностью облитерируется. В таких случаях альтернативы оперативному вмешательству нет. Обнажают пищевод на шее и верхний отрезок трансплантата, который по возможности мобили зуют. Облитерированный участок подвздошной кишки резецируют и формируют новый пищеводно-кишечный анастомоз по одной из наибо лее подходящих методик (рис. 57).
При значительных перегибах и сдавлениях трансплантата пища кон трастная масса может задерживаться в нем до нескольких суток. Это на блюдается, например, после загрудинной толстокишечной пластики, когда при формировании загрудинного тоннеля ранят медиастинальную плевру, вследствие чего в плевральную полость попадает часть трансплан тата и постепенно формируется «колено», вызывающее непроходимость. В таких случаях трансплантат мобилизуют из плевральной полости (пред почтительнее — абдоминальным доступом) и его избыточную петлю резе цируют (рис. 58).
Пептические язвы развиваются при желудочной гиперсекреции и в тонко- и в толстокишечном трансплантате в области анастомоза с желудком. Пептическая язва является абсолютным показанием к операции, так как опасна тяжелыми осложнениями (в основном профузное кровотечение). Наиболее простой операцией является стволовая ваготомия с пилоропластикой или выключение желудка с колоеюноанастомозом (рис. 59, а,б).
Свищи (обычно это наружние свищи анастомоза пищевода с транс плантатом на шее) при отсутствии тенденции к самостоятельному закры тию при консервативном лечении (перевязки, промывания, прижигания грануляций и пр.) лечат хирургическими методами (реконструктивные операции). Операцию проводят по общим правилам: выделяют свищевой ход до самого устья, иссекают его и ушивают дефект в стенке анастомоза двумя рядами узловых швов, при необходимости (стриктура анастомоза) делают соответствующую реконструкцию. Следует только иметь в виду, что свищ часто поддерживается тем, что дистальнее существует какоелибо препятствие пассажу пищи (сдавление или перегиб трансплантата).
При «слепом мешке» собственного пищевода с выраженными клини ческими проявлениями лечение может быть только оперативным. Если анастомоз пищевода с трансплантатом сформирован на шее по типу «бок в бок», лучше пересечь собственный пищевод ниже анастомоза и наглухо ушить его аборальный конец. Условием для этого является хотя бы мини мальная проходимость собственного пищевода в области стриктуры, иначе выключенный недренируемый «слепой мешок» представляет собой значительную опасность: например, может возникнуть нагноение с пос ледующим прорывом гнойника в средостение, образоваться свищ и пр. В таких ситуациях предпочтительнее произвести реконструктивную опе рацию: загрудинный или подкожный искусственный пищевод провести внутриплеврально, для чего необходимо снять анастомоз, ушить дефект в пищеводе и резецировать избыток трансплантата.
132
medwedi.ru
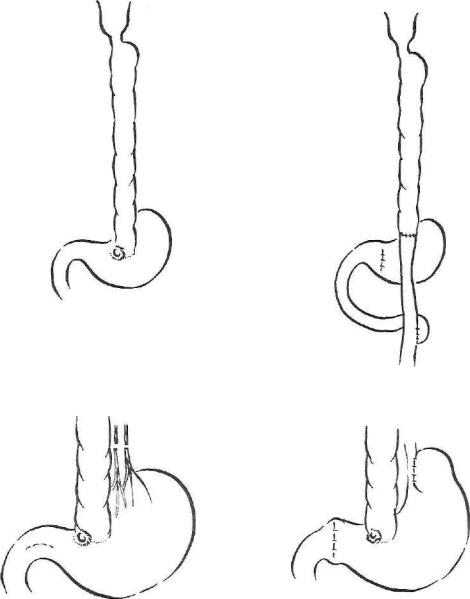
Рис. 59. Операция при пептической язве толстокишечного трансплантата.
а — наложение нового анастомоза трансплантата с петлей тощей кишки, сформированной по Ру; б — стволовая ваготомия с пилоропластикой.
В любом случае следует иметь в виду, что двух одинаковых больных с патологией искусственного и оперированного пищевода не бывает. Для каждого пациента приходится планировать его собственную операцию, причем этот план нередко приходится менять непосредственно во время
133
вмешательства. Тщательное предоперационное обследование, соответст вующая подготовка больного, а главное — опыт хирурга играют в таких случаях решающую роль для достижения успеха.
Профилактика болезней оперированного и искусственного пищевода состоит в правильном установлении показаний к операции и в выборе ее адекватной методики. Следует избегать неоправдавших или уже изжив ших себя методов, таких как, например, подкожная пластика тонкой кишкой с кожными надставками, наложение анастомозов по типу «бок в бок» с преднамеренным оставлением слепого мешка собственного пище вода и пр. Наконец, очень важное значение имеет правильная и скрупу лезная оперативная техника при мобилизации желудка или кишки, выкраивании трансплантата, формировании анастомозов и пр.
medwedi.ru
Ч а с ть в т о р а я
ТЕХНИКА ОПЕРАЦИЙ НА ПИЩЕВОДЕ
(атлас)
Глава 15
ТЕХНИКА ОПЕРАЦИЙ НА ПИЩЕВОДЕ
15.1. Местная эзофагопластика
Показания: короткая рубцовая стриктура пищевода (особенно шей ной локализации) протяженностью до 2—2,5 см при отсутствии эффекта или при невозможности консервативного лечения (бужирование и эндо скопическая баллонная гидродилатация).
Специальная подготовка. При вскрытии просвета любых полых орга нов желудочно-кишечного тракта существует реальная опасность обсеме нения операционного поля (аэробная, анаэробная флора), что грозит развитием гнойно-септических послеоперационных осложнений. Поэто му в схему специальной подготовки к операции включают антибактери альную профилактику: это прежде всего антибиотики — макролиды (ам пициллин) и цефалоспорины (цефамезин), а также производное ДИ-N-OK- сихинолина — диоксидин. Инъекции антибиотиков начинают одновре менно с премедикацией, чтобы достигнуть оптимальной концентрации в тканях к основному моменту операции по следующей схеме:
—в начале операции (после интубации трахеи): внутривенно капельно 60 мл 0,5 % раствора диоксидина, растворенного в 90 мл изотонического раствора хлорида натрия, со скоростью 60—80 ка пель в 1 мин;
—в течение последующих 72 ч после операции: диоксидин (в тех же дозах внутривенно) каждые 8 ч; ампициллин 1 г каждые 6 ч внутримышечно; цефамезин 1 г каждые 8 ч внутримышечно.
В остальном предоперационная подготовка каких-либо специфичес ких особенностей не имеет.
Анестезия: эндотрахеальный наркоз.
Позиция больного зависит от локализации стриктуры.
Доступ: верхняя срединная лапаротомия, если стриктура локализует ся в абдоминальном отделе пищевода или в его нижней трети на уровне или непосредственно над диафрагмой; при внутригрудной локализации лучшим доступом является переднебоковая торакотомия справа в IV— VI межреберьях в зависимости от уровня расположения стриктуры.
Техника операции
При стриктуре протяженностью менее 1,5 см мобилизуют верхний и нижний концы пищевода, стриктуру резецируют и накладывают одноряд ный эзофагоэзофагоанастомоз по типу «конец в конец» узловыми атравматическими швами (викрил 3/0—4/0, дексон 3/0—4/0 и т.п.). При стрик туре протяженностью менее 1 см делают продольный разрез стенки пище вода в области стриктуры через все слои, растягивают его края в стороны и ушивают в поперечном направлении однорядными узловыми швами (рис. 60, а, б). Может встретиться вариант, когда верхний отрезок пищевода на-
136
medwedi.ru

Рис. 60. Местная эзофагопластика.
а — продольное рассечение стриктуры с поперечным ушиванием; б — резекция стриктуры с анастомозом «конец в конец».
Рис. 61. Местная эзофагопластика при нависании мешковидного верхнего отрез ка пищевода над короткой стриктурой.
висает над короткой стриктурой в виде мешка. В таком случае формируют косопоперечный двухрядный анастомоз в обход стриктуры (рис. 61).
Если стриктура распространяется только на слизистый и подслизистый слои пищевода, то делают поперечный разрез мышечной оболочки, затем иссекают переднюю и часть боковых стенок стриктуры, формируют заднебоковые стенки елизисто-подслизистого слоя узловыми швами, а затем ушивают переднюю стенку раны пищевода через все слои одноряд ными узловыми швами (рис. 62).
При всех вариантах местной эзофагопластики необходимы внутрипросветная декомпрессия с помощью тонкого зонда на протяжении трех первых послеоперационных суток и адекватное дренирование области операции. На 5-е сутки проводят рентгеновское исследование (контроль) с водорастворимым контрастом. При отсутствии признаков несостоятель ности швов разрешают пить и постепенно расширяют диету. В сомни тельных случаях повторяют рентгеноконтрастное исследование после первых приемов пищи.
При выявлении хотя бы частичной несостоятельности швов пищево-
137
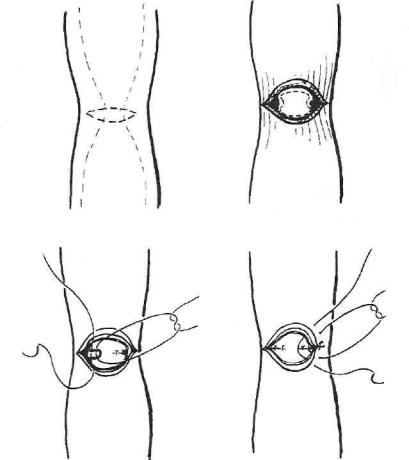
Рис. 62. Иссечение стриктуры слизисто-подслизистого слоя пищевода. Объясне ния в тексте.
да запрещают глотание (даже слюны). Зонд для питания вводят в желу док, а еще лучше — в двенадцатиперстную кишку из-за опасности воз никновения желудочно-пищеводного рефлюкса, препятствующего за живлению раны пищевода; далее проводят консервативное лечение, как и при любых свищах пищевода.
В отдаленном периоде в области местной пластики пищевода могут возникать рубцовые стриктуры, требующие бужирования или эндоскопи ческой баллонной гидродилатации.
15.2. Субтотальная пластика пищевода тонкой кишкой
Показания: все доброкачественные (не поддающиеся лечению блоки рованием) и злокачественные стриктуры пищевода (если для его шунти-
138
medwedi.ru
рования или замещения нельзя использовать толстую кишку или же лудок).
Противопоказания: состояние после резекции кишки, резекции же лудка по Бильрот-П, особенно на длинной петле с брауновским соустьем, когда тонкую кишку для формирования трансплантата использовать не возможно.
Специальная подготовка: антибактериальная профилактика по опи санной выше схеме.
Специальный инструментарий: ложки (копья) С.С.Юдина.
Позиция больного: на спине с валиком под поясницей. Анестезия: эндотрахеальный наркоз.
Доступ: широкая верхняя срединная лапаротомия с обходом пупка слева.
15.2.1. Основные этапы и техника операции
Если у больного имеется гастростома, трубку удаляют, свищ закрыва ют плотно свернутым марлевым тампоном. После лапаротомии и рассе чения спаек выводят в рану поперечную ободочную кишку. Ее растя гивают и запрокидывают вверх, обнажая нижнюю поверхность брыжей ки. Выводят в рану начальный отдел тощей кишки и натягивают ее книзу. После этого хорошо визуализируется трейтцева связка. Здесь рассекают сращения тощей кишки с брыжейкой поперечной ободочной кишки, ос вобождают начальный отдел тощей кишки до ее забрюшинной части. Впереди от тощей кишки и справа от трейтцевой связки находят верхние брыжеечные сосуды, после этого поперечную ободочную кишку погружа ют в брюшную полость. Осматривают тощую кишку и ее сосуды в прохо дящем свете; перебирая петлю за петлей, выявляют анастомозы между радиальными сосудами и вторичными аркадами.
С.С.Юдин не рекомендовал использовать для формирования тощекишечного трансплантата 1-й радиальный сосуд, так как, по его данным, он весьма короток и сразу делится на мелкие ветки в виде «кисточки», кото рая препятствует распрямлению конца будущего трансплантата. Однако, по данным А.А.Русанова (1974), между 1-м и 2-м еюнальными сосудами в 90 % случаев имеется достаточно мощный анастомоз. Если же он отсут ствует, тогда действительно необходимо начинать мобилизацию со 2-го еюнального (радиального) сосуда. Таким образом, на начальном этапе не обходима ревизия сосудистой сети брыжейки: а) анастомозов между арка дами 1-й и 2-й тощекишечных артерий; б) основных стволов 2-й тонко кишечной артерии; в) анастомозов между ее ветвями; г) анастомозов между ветвями 2-й и 3-й тощекишечных артерий; д) анастомозов между ветвями 3-й артерии; г) анастомозов между 3-й и 4-й артериями. По А.А.Русанову, наиболее часто встречаются 2 варианта ветвления 1-го ею нального сосуда, благоприятствующие формированию трансплантата, а также 2 варианта ветвления 2-го сосуда (рис. 63, а—г).
Если обнаружен достаточно мощный анастомоз между 1-й и 2-й ар териями, как это указано на рис. 63, приступают к их обнажению. Рассе кают оба брюшинных листка над сосудами, тщательно предохраняя их от травмы (особенно вены, которые тонки и непрочны), рассекают и час-
139
