
- •Содержание
- •Сущность титриметрического анализа
- •Классификация методов титриметрического анализа
- •1) По процессам, лежащим в основе:
- •2) По способу выполнения:
- •3) По методу:
- •Стандартные растворы
- •Кривые титрования
- •Кислотно-основное титрование
- •Вывод формул для расчета pH
- •1) Вывод формул для расчета pH в начальной точке титрования:
- •2) Вывод формул для расчета pH до точки эквивалентности
- •3) Вывод формул для расчета pH в точке эквивалентности
- •4) Вывод формул для расчета pH после точки эквивалентности
- •Выбор индикатора
- •Индикаторные погрешности титрования
- •Окислительно-восстановительное титрование
- •Вывод формул для расчета кривой окислительно-восстановительного титрования
- •Вывод формул для расчета е до точки эквивалентности
- •Вывод формул для расчета e в точке эквивалентности
- •Вывод формул для расчета e после точки эквивалентности
- •Влияние pH
- •Влияние конкурирующей реакции комплексообразования
- •Влияние разбавления на скачок титрования
- •Влияние температуры на скачок титрования
- •Выбор индикатора
- •Индикаторные погрешности титрования
- •Литература
Индикаторные погрешности титрования
Индикаторная погрешность вызвана несовпадением конечной точки титрования с точкой эквивалентности.
Общий вид форму для расчета ПТ такой же, как и в кислотно-основном титровании:
или
Знак “+” означает, что раствор перетитрован, “–” – что недотитрован.
Рассмотрим случай, когда раствор будет недотитрован, т.е. f < 1. Получится, что значение потенциала в КТТ меньше, чем значение в ТЭ.
, т.е. потенциал в КТТ будет определяться по этой формуле, он будет равен значению показателя титрования
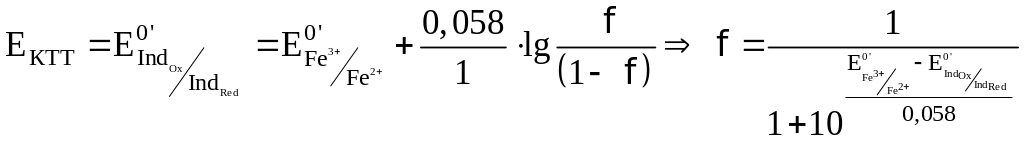
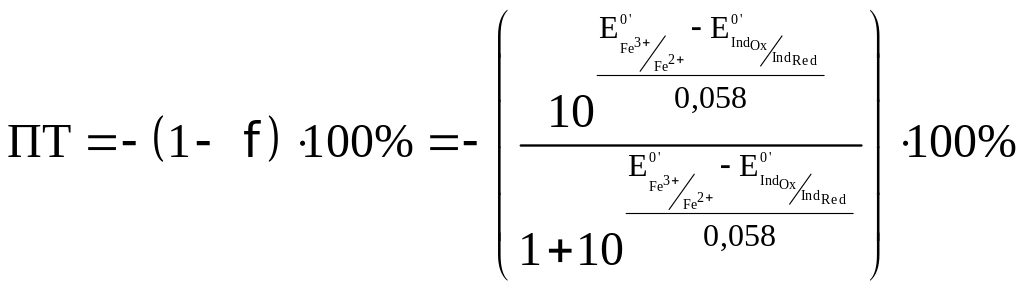
Подставим вместо значение для дифениламина (0,75 В) для двух случаев – с H3PO4 и без нее.
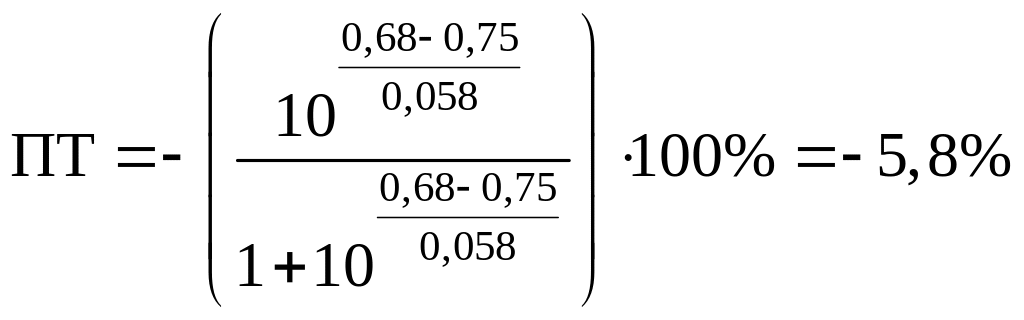 - без H3PO4.
- без H3PO4.
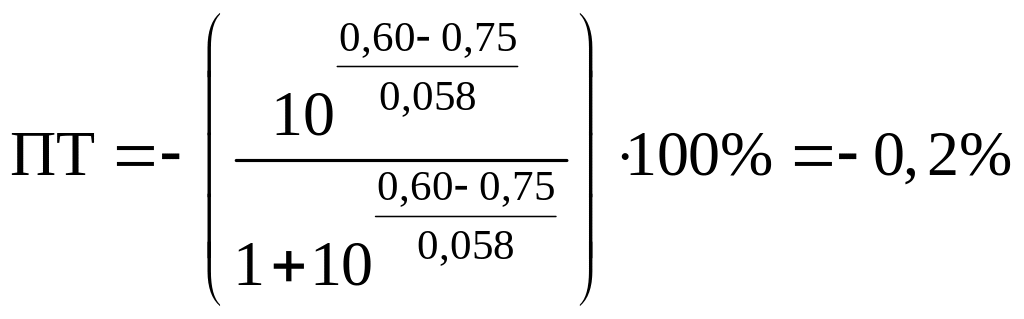 - с участием H3PO4,
что как раз удовлетворяет нашему условию.
- с участием H3PO4,
что как раз удовлетворяет нашему условию.
Подсчитаем то же самое для дифениламинсульфонат натрия или бария:
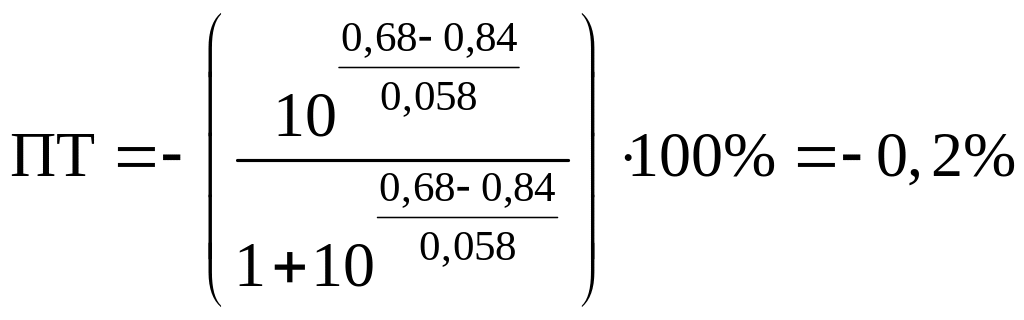 - без H3PO4
- без H3PO4
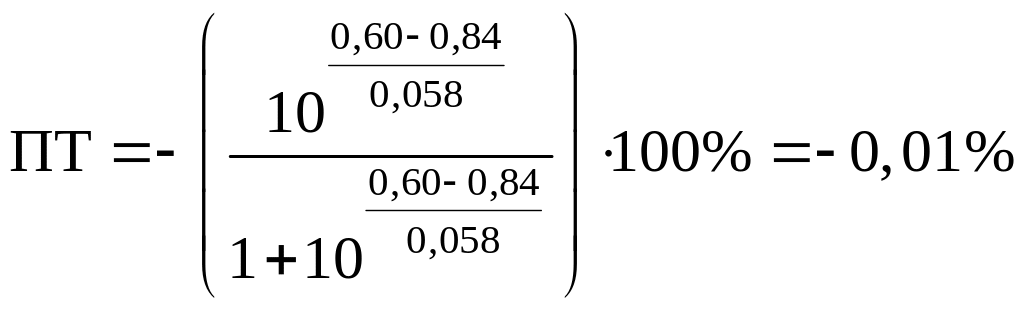 - с H3PO4
– еще более удовлетворяет нашей
задаче, причем можно даже не добавлять
в раствор фосфорную кислоту.
- с H3PO4
– еще более удовлетворяет нашей
задаче, причем можно даже не добавлять
в раствор фосфорную кислоту.
Для N-фенилантраниловой кислоты ПТ и вовсе имеет еще более низкие значения.
Т.е., из всех предложенных наиболее подходящим является последний индикатор.
Выводы
По кривой титрования железа(II) можно сделать ряд выводов.
В ходе титрования заметно плавное уменьшение значений E и заметен скачок в области точки эквивалентности.
Точка эквивалентности расположена при E 1,25 В, причем при использовании защитной смеси с добавлением фосфорной кислоты он уменьшается до 1,24 В. Скачок титрования 0,1 М железа(II) в пределах ±0,1% от точки эквивалентности находится в пределах значений E от 0,85 до 1,31 В и составляет 0,46 В, причем при добавлении защитной смеси он увеличивается. Теперь он уже лежит в пределах значений от 0,77 В до 1,31 В и составляет примерно 0,54 В, что больше скачка титрования того же раствора железа(II), но уже без защитной смеси.
Для определения конечной точки титрования железа(II) методом бихроматометрии используют редокс-индикаторы такие как, дифениламин, N-фенилантраниловая кислота и другие производные дифениламина. Причем в некоторых случаях уже можно будет обходиться без добавления в титруемый раствор фосфорной кислоты.
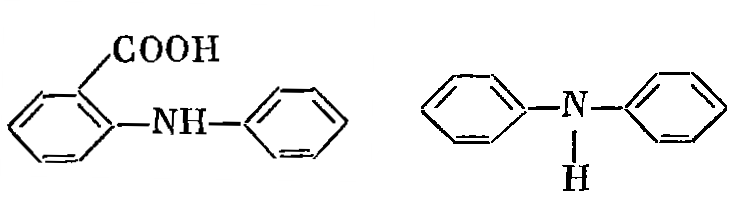
Рисунок 4. Редокс-индикаторы N-фенилантраниловая кислота и дифениламин
Литература
Ю.А Золотов, Е.Н.Дорохова, В.И.Фадеева и др.; под ред. Ю.А.Золотова. – Основы аналитической химии: Кн. 2. Методы химического анализа. – М.: Высш. шк., 1996. – 461 с.
В.П.Васильев. – Аналитическая химия: Кн. 1: Титриметрические и гравиметрический методы анализа. – М.: Дрофа, 2004. – 368 с.
А.Т.Пилипенко, И.В.Пятницкий. – Аналитическая химия: кн. 1. – М.: Химия, 1990. – 480 с.
Ф.Х.Кудашева, Е.С.Кручкова, А.В.Сидельников. – Расчет кривых титрования по степени оттитрованности. Методические указания. – Уфа: Изд-е Башкирского ун-та, 2002. – 36 с.
Ф.Х.Кудашева, Е.С.Кручкова, В.М.Пухова, Г.Б.Боголюк, Р.Н.Ширяева, А.В.Сидельников. – Справочное пособие по аналитической химии. – Уфа: Изд-е Башкирского ун-та, 2001. – 60 с.
