
- •Содержание
- •Сущность титриметрического анализа
- •Классификация методов титриметрического анализа
- •1) По процессам, лежащим в основе:
- •2) По способу выполнения:
- •3) По методу:
- •Стандартные растворы
- •Кривые титрования
- •Кислотно-основное титрование
- •Вывод формул для расчета pH
- •1) Вывод формул для расчета pH в начальной точке титрования:
- •2) Вывод формул для расчета pH до точки эквивалентности
- •3) Вывод формул для расчета pH в точке эквивалентности
- •4) Вывод формул для расчета pH после точки эквивалентности
- •Выбор индикатора
- •Индикаторные погрешности титрования
- •Окислительно-восстановительное титрование
- •Вывод формул для расчета кривой окислительно-восстановительного титрования
- •Вывод формул для расчета е до точки эквивалентности
- •Вывод формул для расчета e в точке эквивалентности
- •Вывод формул для расчета e после точки эквивалентности
- •Влияние pH
- •Влияние конкурирующей реакции комплексообразования
- •Влияние разбавления на скачок титрования
- •Влияние температуры на скачок титрования
- •Выбор индикатора
- •Индикаторные погрешности титрования
- •Литература
Индикаторные погрешности титрования
При титровании возможны случайные и систематические погрешности. Случайные погрешности связаны с измерением объема и массы навески, но и значительную часть погрешности титрования составляют систематические погрешности, в частности, индикаторная.
Случайные погрешности обрабатываются по законам математической статистики.
Индикаторные погрешности связаны с тем, что pT индикатора не совпадает со значением pH в ТЭ. Конечная точка титрования с данным индикатором не совпадает с ТЭ.
При недотитровывании:
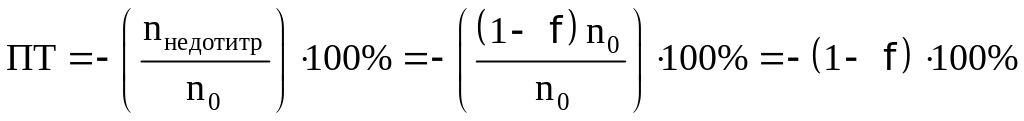
При перетитровывании:
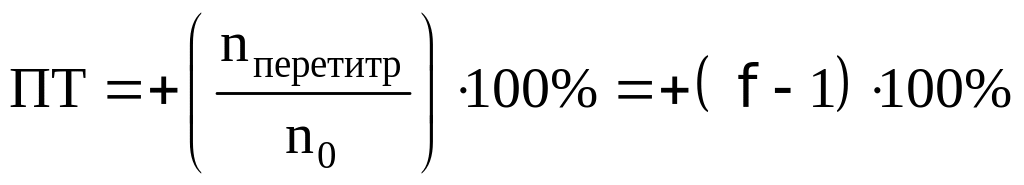
Возьмем индикаторы хризоидин (pT=5,50) и хлорфеноловый красный (pT = 5,80). В данном случае в КТТ pH будет больше, чем pH в ТЭ (pH = 5,28), а, следовательно, в растворе будет неотитрованное основание. Эта погрешность, обусловленная содержанием неоттитрованного основания, называется щелочной, будет определяться уравнением
![]() .
.
На данном этапе титрования pH
будет определяться по формуле
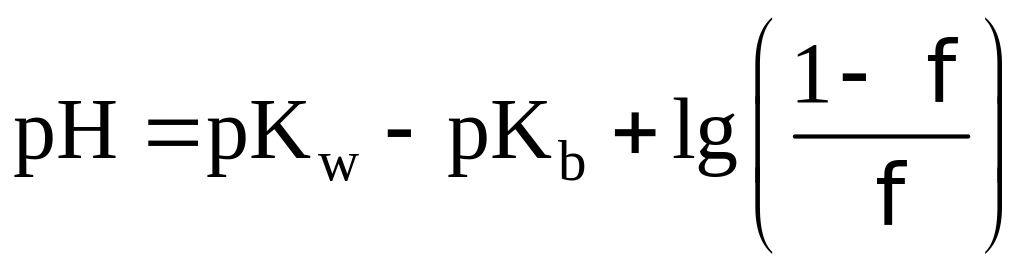 .
В КТТ pH раствора равен
pT. Следовательно, можно
найти и f
в КТТ:
.
В КТТ pH раствора равен
pT. Следовательно, можно
найти и f
в КТТ:
![]() .
.
Отсюда,
 .
.
Посчитаем ПТ для данных индикаторов:
хризоидин:
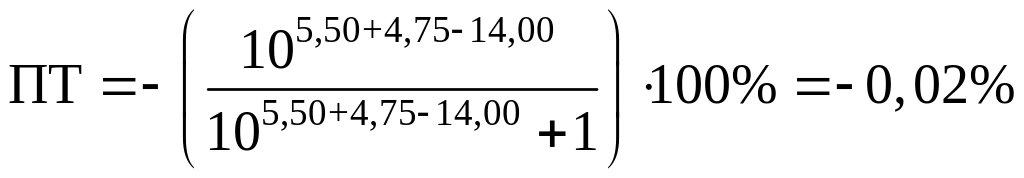
хлорфеноловый красный:
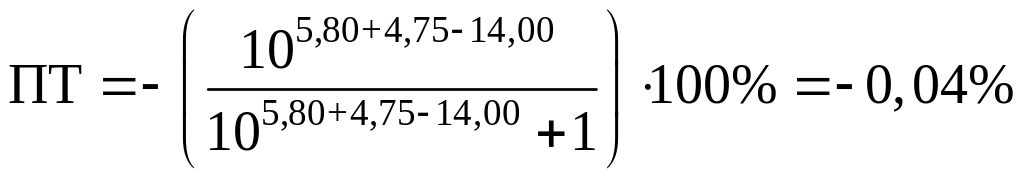
Оба эти индикатора подойдут для нашего титрования. Рассмотрим ПТ для индикатора розоловая кислота (pT=7,1). По данной формуле получается ПТ=–0,70%, что превышает обычно задаваемое значение погрешности (±0,2%).
Рассмотрим же теперь случай, когда мы используем индикаторы с pT меньшим, чем pH в ТЭ. В КТТ раствор будет перетитрован, и pH будет определяться концентрацией сильной кислоты (водородная погрешность), и в нашей задаче определяться уравнением
.
Погрешность будет определяться по
формуле
![]()
Возьмем для примера индикаторы лакмоид (pT=5,20), ализариновый красный C (pT=4,45) и бромфеноловый синий (pT=3,80).
pH раствора в КТТ равен
pT:
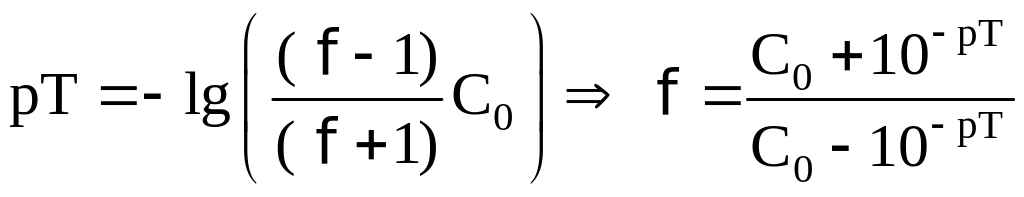 .
.
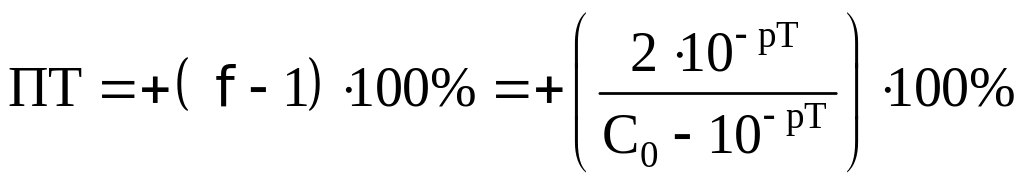 .
.
Рассчитаем ПТ для наших индикаторов:
Лакмоид:

Ализариновый красный C:
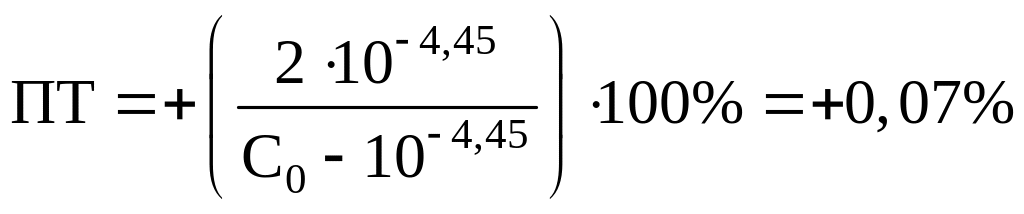
Бромфеноловый синий:

Вполне очевидно, что из двух предложенных индикаторов наиболее подходящим является ализариновый красный C.
Учитывая все расчеты, приходим к выводу, что самыми подходящими для нашего опыта индикаторами являются хризоидин (с интервалом перехода 4,0 – 7,0, оранжевая – желтая) и лакмоид (4,0 – 6,4, красная – синяя).
Выводы
По кривой титрования аммиака можно сделать ряд выводов.
В ходе титрования заметно плавное уменьшение pH и заметен скачок в области точки эквивалентности. Скачок титрования полностью находится в кислой области.
Точка эквивалентности расположена при pH 5,28 и, очевидно, не совпадает с точкой нейтральности. Скачок титрования 0,1 М аммиака в пределах ±0,1% от точки эквивалентности находится в пределах pH от 6,25 до 4,30 и составляет примерно 2 единицы pH, что намного меньше скачка сильной щелочи (6 единиц pH). С уменьшением концентрации и увеличением температуры скачок уменьшается.
В нашем случае одними из самых подходящих являются лакмоид и хризоидин.
Окислительно-восстановительное титрование
Метод основан на реакциях окисления-восстановления. Их называют по применяемому тированному раствору реагента, например: перманганатометрия, йодометрия, бихроматометрия. В этих методах в качестве титрантов применяют, соответственно, KMnO4, I2, K2Cr2O7.
В основе метода лежит изменение окислительно-восстановительного потенциала, обусловленного протеканием окислительно-восстановительной реакции между титрантом и определяемым веществом.
![]()
В процессе титрования происходит изменение концентраций окисленной и восстановленной форм, а, следовательно, изменяется окислительно-восстановительный потенциал титруемого раствора, включающей две редоксопары.
В соответствии с уравнением Нернста окислительно-восстановительный потенциал для любой редоксопары:
![]()
Для каждого отдельного метода окислительно-восстановительного титрования используются свои стандартные растворы.
Рассмотрим наш случай – перманганатометрия. Рабочим раствором этого метода является раствор перманганата калия KMnO4, он неустойчив из-за реакции с водой, катализируемый диоксидом марганца и на свету:
![]()
Поэтому растворы перманганата калия
следует готовить, используя чистую воду
(органические примеси в воде могут
реагировать с
![]() и давать MnO2, ускоряющий
разложение реагента), отфильтровать от
диоксида марганца и хранить в темных
склянках; раствор следует выдержать
несколько недель для окончания протекания
всех процессов. Очевидно, что раствор
следует стандартизировать, для чего
используют оксалат натрия и другие
восстановители. Реакция
и давать MnO2, ускоряющий
разложение реагента), отфильтровать от
диоксида марганца и хранить в темных
склянках; раствор следует выдержать
несколько недель для окончания протекания
всех процессов. Очевидно, что раствор
следует стандартизировать, для чего
используют оксалат натрия и другие
восстановители. Реакция
![]()
катализируется ионами Mn2+. Первые капли перманганата даже в горячем растворе обесцвечиваются очень медленно. В ходе титрования концентрация ионов Mn2+ возрастает и скорость реакции увеличивается: реакция автокаталитическая.
Титр перманганата калия можно установить также по оксиду мышьяка(III) или металлическому железу.
В перманганатометрии применяют также растворы восстановителей – слои Fe(II), щавелевую кислоту и некоторые другие – для определения окислителей методом обратного титрования. Соединения Fe(II) на воздухе медленно окисляются, особенно в нейтральном растворе. Подкисление замедляет процесс окисления, однако обычно рекомендуется перед применением раствора Fe(II) в анализе проверить его титр. Оксалаты и щавелевая кислота в растворе медленно разлагаются. Этот процесс ускоряется на свету, поэтому растворы оксалатов рекомендуется хранить в темных склянках. Подкисленные растворы оксалатов более устойчивы, чем нейтральные или щелочные.
