
- •Содержание
- •Сущность титриметрического анализа
- •Классификация методов титриметрического анализа
- •1) По процессам, лежащим в основе:
- •2) По способу выполнения:
- •3) По методу:
- •Стандартные растворы
- •Кривые титрования
- •Кислотно-основное титрование
- •Вывод формул для расчета pH
- •1) Вывод формул для расчета pH в начальной точке титрования:
- •2) Вывод формул для расчета pH до точки эквивалентности
- •3) Вывод формул для расчета pH в точке эквивалентности
- •4) Вывод формул для расчета pH после точки эквивалентности
- •Выбор индикатора
- •Индикаторные погрешности титрования
- •Окислительно-восстановительное титрование
- •Вывод формул для расчета кривой окислительно-восстановительного титрования
- •Вывод формул для расчета е до точки эквивалентности
- •Вывод формул для расчета e в точке эквивалентности
- •Вывод формул для расчета e после точки эквивалентности
- •Влияние pH
- •Влияние конкурирующей реакции комплексообразования
- •Влияние разбавления на скачок титрования
- •Влияние температуры на скачок титрования
- •Выбор индикатора
- •Индикаторные погрешности титрования
- •Литература
Вывод формул для расчета кривой окислительно-восстановительного титрования
Окисление Fe(II) будет идти по реакции:
![]()
Мы имеем две редоксопары
![]() и
и
![]() .
.
![]() ,
,
![]()
![]() ,
,
![]()
На кривой титрования будет одна точка эквивалентности, т.к. в ходе титрования протекает одна титриметическая реакция. Расчет кривой титрования делится на три этапа: до точки эквивалентности, в точке эквивалентности, после достижения точки эквивалентности.
Мы не будем учитывать конкурирующие реакции комплексообразования, ионную силу раствора, изменение объема раствора в процессе титрования.
![]() =0,2
М – исходная концентрация титруемых
ионов железа,
=0,2
М – исходная концентрация титруемых
ионов железа,
![]() =0,2
М – молярная концентрация эквивалента
титранта.
=0,2
М – молярная концентрация эквивалента
титранта.
Вывод формул для расчета е до точки эквивалентности
До точки эквивалентности
![]() и f
< 1.
и f
< 1.
В растворе остались недотитрованные ионы железа(II) и образовались ионы железа(III) и ионы марганца(II). Также в растворе имеется очень маленькая концентрация перманганат-ионов.
После прибавления титранта в любой момент времени устанавливается равновесие. Из условия равновесия следует, что потенциалы обеих редоксопар в любой момент титрования имеют равные значения. Однако, практически, удобнее рассчитывать потенциал до ТЭ по полуреакции с участием титруемого вещества, а после ТЭ – по полуреакции с участием титранта.
Потенциал в уравнении Нернста для бихромат-ионов зависит от pH. Поэтому для создания кислой среды и поддержания pH постоянным в титруемый раствор вводят избыток серной кислоты (1 М).
![]()
![]() ,
где
,
где
![]() –
формальный потенциал редоксопары,
равный 1,51 В.
–
формальный потенциал редоксопары,
равный 1,51 В.
ОВ-потенциал для ионов железа:
![]() ,
где
,
где
![]() -
формальный потенциал для ОВ пары железа,
равный в 1 М серной кислоте 0,68 В.
-
формальный потенциал для ОВ пары железа,
равный в 1 М серной кислоте 0,68 В.
В соответствии с уравнением Нернста
для полуреакции окисления железа(II),
учтя перед этим, что до ТЭ [Fe2+]
– это недотитрованные катионы
![]() ,
а [Fe3+] – это
оттитрованные ионы железа(II)
,
а [Fe3+] – это
оттитрованные ионы железа(II)
![]() ,
найдем выражение для потенциала всей
системы:
,
найдем выражение для потенциала всей
системы:

Данная формула является конечной для расчета значений E до точки эквивалентности.
Вывод формул для расчета e в точке эквивалентности
Точка эквивалентности достигается в
том случае, когда к титруемому раствору
прибавлено эквивалентное количество
титранта:
![]() ,
f
= 1.
,
f
= 1.
Выведем формулу для расчета потенциала системы в точке эквивалентности.
В растворе: ионы трехвалентного железа и хрома, а также в ничтожных количествах титрант и титруемы ион железа(II). В растворе наступает химическое равновесие и ОВ потенциалы двух редоксопар равны.

Таким образом, мы получили систему двух уравнений.
По реакции получается
![]() .
Подставим в систему:
.
Подставим в систему:
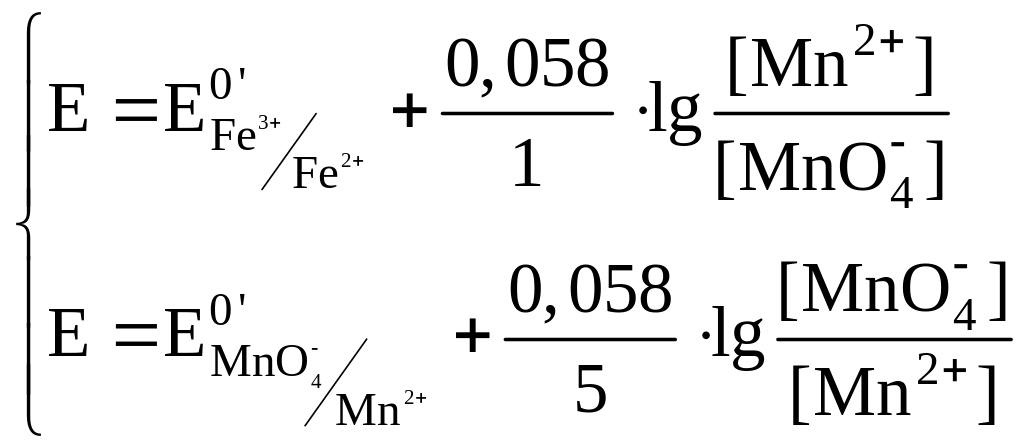
Умножим второе уравнение на 5 и сложим левую и правую части уравнений:
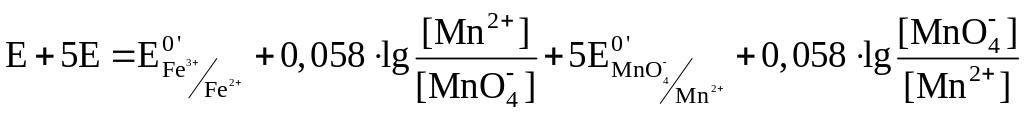
![]()
 ,
,
Получаем конечную формулу для расчета E в точке эквивалентности:
 .
.
Вывод формул для расчета e после точки эквивалентности
После точки эквивалентности
![]() ;
f >
1.
;
f >
1.
Как уже было ранее отмечено, расчет E после ТЭ будем рассчитывать по полуреакции титранта, полагаясь на уравнение Нернста для титранта.
Концентрация ионов двухвалентного
марганца определяется, как и в ТЭ:
![]()
А концентрация ионов титранта есть:
 ,
где
,
где
![]() -
количество эквивалентов титранта,
прибавленное после ТЭ.
-
количество эквивалентов титранта,
прибавленное после ТЭ.
![]()
Подставим выражение для равновесной концентрации ионов титранта в уравнение Нернста для расчета потенциала системы после ТЭ, т.е. в уравнение Нернста для титранта:

Подставим выражение для концентрации ионов марганца(II):

Эта формула является конечной для расчета значения потенциала системы после ТЭ.
Таблица 2. Расчет значений потенциалов системы при титровании 0,1 М раствора Fe2+ 0,1 М раствором K2Cr2O7
Этапы титро-вания |
f |
Состав раствора |
Формула для расчета |
E1 |
E2 |
1 |
0,1 |
Fe2+,
Fe3+,
Mn2+,
|
|
0,62 |
0,54 |
0,2 |
0,65 |
0,57 |
|||
0,3 |
0,66 |
0,58 |
|||
0,4 |
0,67 |
0,59 |
|||
0,5 |
0,68 |
0,60 |
|||
0,6 |
0,69 |
0,61 |
|||
0,7 |
0,70 |
0,62 |
|||
0,8 |
0,71 |
0,63 |
|||
0,9 |
0,74 |
0,66 |
|||
0,99 |
0,80 |
0,72 |
|||
0,999 |
0,85 |
0,77 |
|||
2 |
1 |
(Fe2+), Fe3+, Mn2+, |
|
1,37 |
1,36 |
3 |
1,001 |
(Fe2+), Fe3+, Mn2+, |
|
1,48 |
1,48 |
1,01 |
1,49 |
1,49 |
|||
1,1 |
1,50 |
1,50 |
|||
1,5 |
1,50 |
1,50 |
|||
2 |
1,51 |
1,51 |
E1 – значения потенциалов системы без H3PO4, E2 – c H3PO4.
Рис 3. Кривая титрования 0,1 М Fe2+ 0,1 М раствором K2Cr2O7.
По таблице 2 и кривой титрования видим, что скачок титрования лежит в области потенциалов от 0,85 до 1,31 В и составляет 0,46 В. Рассмотрим, какие факторы влияют на величину скачка.
Величина скачка зависит от тех же факторов, от которых зависят формальные потенциалы
