
2 курс / Гистология / РУКОВОДСТВО_ИММУНОГИСТОХИМИЧЕСКИЕ_ММУНОГИСТОХИМИЧЕСКИЕ_МЕТОДЫ
.pdfГлава 5 |
Фиксация и проводка материала |
вится непригодным, не обеспечивает полной депарафинизации срезов, и оставшийся в них
парафин образует артефакты при дальнейшем окрашивании.
Детализованный протокол депарафинирования
1.Обвести и пометить образец карандашом.
2.Поместить стекла в термостат (60°С) на 30 минут.
3.Перенести немедленно в свежий ксилол на 3 минуты.
4.Повторить процедуру в п. 3 с новой порцией ксилола.
5.Поместить в абсолютный спирт на 3 мин.
6.Повторить процедуру в п. 5 с новой порцией спирта.
7.Поместите стекла в раствор 95% спирта на 3 минуты.
8.Вторая смена 95% спирта, 3 минуты.
9.Промыть в проточной воде.
10.Не давая стеклам высохнуть, сразу переместить стекла в буфер для демаскировки антигена или начать окрашивание.
Литература:
1.Immunochemical Staining Methods, 4th Edition, Key,
M.editor, Dako Corporation, Carpinteria, 2001.
2.Mies, C. Molecular biological analysis of paraffinembedded tissues; Hum Pathol. 1994;25;555-560.
3.Gillespie. J.W., et al. Evaluation of Non-Formalin Tissue Fixation for Molecular Profi ling Studies, Am J. Pathol. 2002;60:449-457.
4.Herman GE, Chlipala E, Bochenski G, Sabin L, Elfont
E.Zinc formalin fi xative for automated tissue processing. J Histotechnol 1988;11:85-89.
5.Morales, AR, et al. Continuous-specimen-fl ow, highthroughput, 1-hour tissue processing. A system for rapid diagnostic tissue preparation. Arch Pathol lab Med 2002;126(5):583-590.
6.Ni C, Chang TC, Searl SS, Coughlin-Wilkinson E, Albert DM. Rapid paraffin fi xation for use in histological examination. Ophthalmology (Rochester) 1981;88:1372-1374.
7.Pearse AGE. Histochemistry. Theory and applied. 4th ed. Edinburgh: Churchill Livingstone, 1980.
8.Leong, Anthony. Extract from Woods and Ellis, Laboratory Histopathology: AComplete Reference, 1994, Churchill Livingstone.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 59

Глава 6 | Идентификация ткани при иммуногистохимии
James F. Happel DLM (ASCP) HTL
перевод Н.В. Даниловой
Сохранение информации о пациенте во время проводки, заливки, микротомии, сушке стекол, окраске, заключении срезов и других операций остается одной из главных задач в патоморфологической лаборатории сегодня. Большое количество этапов обработки материала от проводки до заключения, которые до сих пор в некоторых лабораториях выполняются вручную, создает предпосылки для ошибок в наименовании и идентификации кассет, стекол и заключений.
Важность понятной системы идентификации образцов в патоморфологической лаборатории невозможно переоценить. Такие организации как College of American Pathologists (CAP) [1] и The Joint Commission (JCAHO) [2] обратились к этому вопросу и выпустили директивы, которые касаются преаналитической, аналитической и постаналитических фаз диагностического процесса. Инициатива по безопасности пациентов возникла в 1990-х годах и затем сформировалась в Национальную Организацию Безопасности Пациентов (National Patient Safety Foundation) [3]. Эти документы стали основой большинства программ по контролю качества и безопасности в лабораториях и представляют собой великолепную базу для процедур, которые обеспечивают безопасность и точную идентификацию образцов в процессе обработки ткани и выдачи гистологического заключения.
Сбор и идентификация образцов
Правильная идентификация образца и пациента чрезвычайна важна в каждой больнице. Несмотря на все усилия руководства больниц, среднего медицинского персонала и персонала лабораторий, неправильная идентификация пациентов является трудно разрешимой проблемой и становится причиной 13% ошибок хирургов и 67% ошибок при переливании крови [4]. В попытке смягчить эту многолетнюю проблему должна быть разработана и принята понятная четкая система «перемещения» образца. Данная система должна быть основана на практике лучших лабораторий и начи-
наться во время сбора образца. Вне зависимости от того, происходит ли обработка доставленного материала в том же учреждении, где производился его забор или материал должен транспортироваться в другое учреждение для дальнейшей проводки, необходимо, чтобы каждый сотрудник, ответственный за маркировку и передвижение образцов (начиная от забора, заканчивая выдачей заключения) был уверен, что маркировка каждого контейнера содержит на себе как минимум два параметра, позволяющих идентифицировать пациента (имя, дата рождения, номер истории болезни или карты) [1,2].
Как только сотрудник, производящий забор образца, правильно его пометил и данный материал был доставлен в гистологическую лабораторию, оснащенную системой HLIS (Histology Laboratory Information System), ему присваивается его индивидуальный номер. Этот номер не должен изменяться в процессе проводки, заливки, микротомии, окраски H&E, заключения и последующей отправки к врачу-патологоанатому для постановки диагноза. Иногда может потребоваться дополнительная обработка материала в другой клинической лаборатории, например, микробиологическое
исследование. В этом случае персонал, производящий забор материала, должен быть заранее пред-
60 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 6 |
Идентификация ткани при иммуногистохимии |
|
|
|
|
упрежден, насколько это возможно, в идеале до забора материала. Необходимо пытаться собирать отдельные образцы для разных лабораторий, с целью синхронизированной обработки материала в разных лабораториях и минимизации времени между получением материала и выдачей заключения. Материал, поступающий в клиническую лабораторию, традиционно имеет другой идентификационный код, отличный от кода, присваиваемого HLIS и генерируется CLIS (Clinical Laboratory Information System).
В случае, если врачу патологоанатому для постановки диагноза требуется больше данных, чем
он может получить при просмотре базовой окраски гематоксилином-эозином, существует множество дополнительных специфических окрасок, проясняющих определенные гистологические черты процесса. В большинстве гитологических лабораторий сегодня используются хромофильные (легкоокрашиваемые) методы окраски, начиная от Acid fast и заканчивая Ziehl-Neelsen. Иммуногистохимия быстро становится стандартной методикой во многих лабораториях и доступна в виде флуоресцентной in situ гибридизации (FISH), хромогенной in situ гибридизации (CISH) и in situ гибридизации серебрением (SISH). Но вне зависимости от используемого метода окраски, точная идентификация пациента должна поддерживаться во всем процессе обработки образца, с тем чтобы быть уверенным, что каждый полученный результат относится к конкретному пациенту, что необходимо для правильной постановки диагноза и правильного лечения.
Контроль забора и регистрации образцов
Чрезвычайно важно контролировать весь процесс идентификации образца на всех этапах лабораторной обработки, в том числе – на преаналитическом, аналитическом и постаналитическом. Метки, используемые для идентификации контейнера, должны быть напечатаны в момент забора материала и сразу же наклеены на контейнер. Все другие метки, нанесенные позже, должны быть отбракованы. Чтобы уменьшить ошибки в идентификации в месте забора материала, необходимо быть уверенным, что одни и те же сотрудники ответственны за идентификацию материала (приклеивают метку на
контейнер) и перемещение забранного образца в данный (фиксирующий и транспортный) контейнер [5]. Прекрасно, если при заборе материала будет присутствовать второй сотрудник, проверяющий правильность и дающий знак, что контейнеры проверены и соответствуют содержимому. На этом этапе необходимо также подтверждение, что образец ткани является видимым в данном контейнере. Это подтверждение должно фиксироваться в направлении на исследование (бланк-заявка) или в отдельном журнале.
Как только образец был помещен в контейнер и правильно помечен, он должен быть доставлен
влабораторию так быстро, как это возможно. Многие из образцов «исчезают» и никогда не находятся
вхаосе. Протокол процедуры доставки должен быть таковым, чтобы минимизировать потенциальные источники путаницы и исключить потерю образцов. Немедленная доставка образца и направления
влабораторию (имеется ввиду сразу после забора, путем пневмопочты, например) будет значительно снижать процент потерянных или перепутанных образцов. Накопление в одном транспортировочном контейнере материала от нескольких пациентов, особенно при наличии дефектов маркировки флаконов и направления, может стать источником путаницы и потерь.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 61
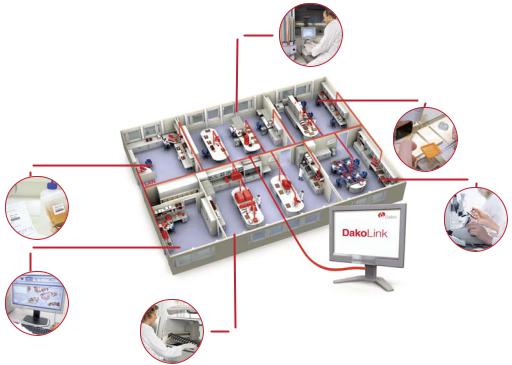
Идентификация ткани при иммуногистохимии |
Глава 6 |
Вырезка
Проводка и заливка
образцов
Прием материала
Просмотр и интерпретация |
Микротомия |
|
Окрашивание
Рис. 6.1. Организация рабочего процесса от приема материала до формулировки заключения.
Даже самый потрясающе правильно организованный механизм работы в лаборатории может стать жертвой неожиданной ошибки, например случайного падения контейнера с образцом в
мусорное ведро. Ликвидация всех мусорных ведер в зоне, где находится большое количество образцов, решит проблему потери образцов таким способом раз и навсегда. В мусорных ведрах обнаруживаются образцы ткани наряду с уже напечатанными (ненаклеенными) этикетками, которые были выброшены в попытке предотвратить их использование в других случаях. Кроме того, рекомендуется не выбрасывать мусорные ведра как минимум по 3 рабочих дня. Это дает вам возможность проверить мусор, если какой-то образец был случайно выброшен с материалами для заливки, такими как марля, губка или бумагой для протирки оптических стекол, которая использовалась для изготовления маленьких кусочков ткани. Большинство лабораторий имеют определенное время полного цикла, в течение которого пропавший образец может быть обнаружен.
Как только образцы готовы к транспортировке в лабораторию, они должны быть отправлены со всей поспешностью. Быстрая доставка материала в лабораторию снижает риск потери или перепутывания образцов. Какую бы процедуру не использовала ваша лаборатория, необходимо поддерживать цепь ответственности и обеспечения сохранности путем ведения журналов или других записей, где фиксируется время, в которое каждый образец был запечатан и отправлен.
Чем более ясными и точными будут эти записи, тем лучше. Например, иметь запись о том, что он
62 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 6 |
Идентификация ткани при иммуногистохимии |
или она погрузила и отправила образцы в точно определенное время без упоминания о количестве образцов в каждом случае – полезно, но совсем не специфично. Каждый образец должен учитываться на каждом этапе технологической цепочки. Предпочтительной будет запись, отражающая количество и тип образца.
Прежде чем принять образец в лабораторию сотрудник должен проверить контейнер и направление на полноту содержащейся в них маркировки и прочей информации. Персонал, который доставляет принимает образцы должен следить за тем, чтобы каждый образец был учтен. Любые расхо-
ждения должны выявляться, документироваться и устраняться немедленно. Образцы, пришедшие с несоответствующими им направлениями, не должны приниматься в лабораторию за редким исключением. Одним из таких исключений является случай, если задержка в обработке образца приведет к сопутствующей задержке в постановке диагноза и является критичной для выживания пациента или сохранения образца. Любой другой образец с неправильно оформленным направлением должен быть отправлен назад.
Образцы, принимаемые в лабораторию должны быть немедленно отсортированы в зависимости от того, требуют ли какие-то из них специфические условия хранения. Например, свежая ткань для приготовления свежезамороженных срезов, чувствительность ко времени проводки или окраски, необходимость фиксации специальными растворами, такими как глютаральдегид для электронной микроскопии и др. Кроме того необходимо следить за тем, чтобы объем формалина превышал объем ткани в 20 раз. Теперь образец готов к занесению в LIS.
Регистрация материала
Большинство лабораторий используют программы LIS, специально созданные для регистрации материала в процессе работы лаборатории. Данная система без труда осуществляет связь с другими внутригоспитальными базами данных, содержащими истории болезней или амбулаторные карты пациентов. Поэтому чрезвычайно важно, чтобы пациент, а также его медицинская и другая информация, идентифицировались правильно. Опытный медрегистратор ответственен за ввод правильных данных по каждому случаю, включающих, но не ограничивающихся именем пациента, информацией о страховке, историей болезни, перенесенных хирургических вмешательствах, взятых образцах и послеоперационных находках. Большинство LIS обычно присваивают пациенту свой номер во время ввода информации, поэтому на направлениях и контейнерах с образцами отмечается этот же номер. Этот номер пишется вручную или печатается принтером на кассетах для проводки образца. Также применяются некие универсальные практические правила, чрезвычайно важные для уменьшения количества ошибок и путаницы в идентификации
образцов. Например, насколько это возможно, не регистрировать два похожих образца друг за другом (две толстоигольные биопсии предстательной железы или две секторальные резекции молочной железы и др.). Важно иметь этап проверки как часть рабочего процесса, то есть должен присутствовать второй специалист-наблюдатель, контролирующий процесс регистрации материала, компетентность и аккуратность регистратора.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 63
Идентификация ткани при иммуногистохимии |
Глава 6 |
Вырезка
Когда образцу присвоен номер, направление на исследование и контейнер с образцом помечены, номера перенесены на кассеты, наступает время для вырезки.
Вырезка хирургически полученного образца включает в себя описание и рассечение ткани с целью постановки предварительного морфологического диагноза. В лаборатории в этот процесс вовлечены врач-патологоанатом, ординатор, ассистент патологоанатома или лаборант вырезки, который правильно и внимательно сопоставляет регистрационный номер и имя пациента с представленным образцом ткани [6]. В конце концов, прозектор является ответственным за то, чтобы положить правильный образец ткани в правильно пронумерованную кассету.
Здесь также применяются некие практические правила для уменьшения количества ошибок и путаницы в идентификации образцов. До того момента, как кассеты будут заполнены и закрыты, на рабочей поверхности должно находиться только одно направление и только кассеты, имеющие отношение к образцу, с которым ведется работа. После вырезки одного образца все кассеты, относящиеся к нему, должны быть убраны с рабочей поверхности. Все неиспользованные кассеты должны быть незамедлительно выброшены, для исключения случайной возможности их использования при работе со следующим случаем [6].
Проводка ткани и микротомия
Даже самый аккуратный и внимательный лаборант может случайно перепутать номера случаев при переносе номеров с кассет на стекла. Таким образом необходимо осваивать и применять методы, снижающие возможность ошибки. Например, неизменное правило: не открывать более одной кассеты при заливке, – правильная и доказавшая себя на практике позиция для исключения случайного переноса ткани из одной кассеты в другую. Подобным образом необходимо тщательно вытирать пинцет, использующийся для переноса ткани из кассет во время заливки, чтобы исключить попадание ткани
одного образца в другой, которая может прилипать к браншам пинцета.
В отношении микротомии также существует ряд правил, позволяющих уменьшить ошибки. Существует две различные точки зрения в отношении маркировки стекол и дискуссия до сих пор продолжается: маркировать ли стекла перед микротомией или непосредственно во время нее.
Во многих лабораториях стекла подписывают до микротомии, используя либо специальный принтер для стекол или вручную. Оба способа имеют свои преимущества и недостатки. Преимущество использования принтера для стекол, который печатает партии стекол, заключается в том, что этот процесс может быть осуществлен в любое время, например когда в лаборатории мало работы. Использование принтера во время интенсивной работы также позволяет лаборантам не тратить время на подписывание каждого стекла и увеличивает производительность. Однако печать партиями имеет изначальную опасность: если номера на стеклах печатаются последовательно и соответствуют заливаемым блокам, но по какой-то причине маркировка стекол и блоков вдруг теряет синхронность, образцы в партии перепутаются. В лабораториях, где стекла нумеруются заранее, должен существовать этап, на котором сверя-
ются номера стекла и блока. Обычно это осуществляют посредством визуальной верификации или с
64 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 6 |
Идентификация ткани при иммуногистохимии |
помощью лазерного сканера и программы для распознавания. Эта программа сканирует штрих-код на кассете и такой же штрих-код на стекле и когда стекло и блок совпадают, подает звуковой и световой сигнал лаборанту. Многие из таких систем не ассоциированы с LIS и поэтому не позволяют использовать эту информацию для отслежевания образца (на каком этапе обработки находится конкретный блок или конкретное стекло в данный момент). Система идентификации и слежения за гистологическим материалом (True Positive Identifi cation, TPID) имеет программные средства, которые интегрируют различные гистологические процессы от приема материала до заключения врача. Также TPID пред-
лагает разнообразные варианты отчетов или данных по слежению, для заведующих лабораторией, которые могут использоваться для оценки индивидуальной продуктивности или снижения количества ошибок в лаборатории.
Стекла, подписываемые от руки, также несут в себе определенные ошибки идентификации. Если стекла подписываются партиями (перед микротомией, на основе предварительной информации об ожидаемом количестве стекол для данного случая), то существует такая же потенциальная проблема с последовательностью, описанная выше. В ситуации, когда стекло подписывается непосредственно во время микротомии, когда парафиновый блок находится в руке лаборанта, опять вступает в силу императивное правило «не более одного блока в один момент». Стекла подписывают, когда блок уже порезан и срезы уже помещены на стекла, таким образом снижается риск взять не то заранее подписанное стекло, не относящееся к этому блоку.
Во время расправления срезов на водяной бане, если в емкости находятся ленты сразу с нескольких блоков, возникает вероятность перепутать срезы. Один из лучших способов снизить этот риск – полностью очищать воду во флотационной емкости после нарезки блока от лишних парафиновых лент. Постоянное поддержание чистоты воды во флотационной емкости устраняет возможность кросс-контаминации среза тканями из другого блока.
Как только срезы смонтированы на стекла и правильно подписаны, их традиционно сушат на воздухе несколько минут для испарения всей воды со среза. Готовые стекла затем помещаются в кассету и ставятся в термостат для дальнейшей просушки. Нагревание стекол в термостате несет двойную выгоду. Со стекла удаляется избыток парафина, адгезия среза к стеклу возрастает. В завершении этого этапа стекла готовы к окраске.
Обзорная окраска и заключение под покровное стекло
Окраска гематоксилином-эозином – источник жизненной силы гистологической лаборатории. В действительности любой случай, поступающий в лабораторию, будет покрашен таким способом.
Сегодня в большинстве лабораторий процесс окраски гематоксилином-эозином полностью автоматизирован. Однако вне зависимости от того, используете ли вы автостейнер или красите вручную, вероятность перепутать стекла во время этой процедуры остается минимальная из-за того, что стекла обычно окрашиваются в кассетах с небольшим нарушением того порядка, в котором они были порезаны. Тем не менее остается вероятность, того что небольшие кусочки срезов оторвутся
от своих стекол и прикрепятся к стенкам емкости с реагентом или на другие стекла. Существуют
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 65
Идентификация ткани при иммуногистохимии |
Глава 6 |
|
|
меры предосторожности, которые помогут предупредить подобную кросс-контаминацию. Убедитесь, что стекла достаточное время находились в термостате при адекватной температуре. Это даст вам уверенность в надежной адгезии на стекле и уменьшит потенциальную вероятность кроссконтаминации.
После того как стекла покрашены, на них поместят покровные стекла, прикрепив их гистологической средой, с целью защитить ткань и обеспечить большую четкость при исследовании под микроскопом.
Сопоставление стекол и блоков с направлениями на гистологическое исследование
Финальным этапом обработки хирургических образцов в гистологической лаборатории является сопоставление запрашиваемых исследований при приеме материала с уже готовыми блоками и стеклами из лаборатории, чтобы удостовериться, что все необходимые операции закончены и учтены. Эта необходимая работа включает в себя точную интерпретацию данных направления на исследование, а также полное понимание этапов технологического процесса. Необходимость определять, закончен ли случай полностью, ложится на плечи того, кто просматривает стекла перед отправкой их врачу-патологоанатому.
Для выполнения этой задачи персонал лаборатории должен сперва найти направление на исследование, затем оценить правильность его заполнения. Когда идентификация пациента (и/или номера случая) закончена, требуется проверить соответствие количества блоков, изготовленных с образца, правильному количеству стекол и окрасок. Для этой задачи требуется опытный сотрудник, внимательный к деталям и хорошо понимающий весь технологический процесс в лаборатории. Если случай выполнен не до конца, данный специалист должен выявить причину проблемы и найти потерянные материалы.
Отслеживание активов лаборатории и управление рабочим процессом
Цель каждого заведующего лабораторией – развивать безопасный технологический процесс, который приносит пользу пациентам, упрощает постановку диагноза, увеличивает продуктивность и снижает ошибки. Эти задачи усложняются в условиях нехватки квалифицированного персонала и сокращения бюджетных расходов. От лабораторий никогда раньше не требовали так много при столь низких затратах, как сейчас. Необходимость в помощи никогда не была сильнее.
Как отмечалось выше, TPID предоставляют готовые решения для более четкой организации рабочего процесса от получения образца через все этапы гистологической обработки до доставки врачу-патологоанатому. Система TPID предлагает точный и аккуратный метод идентификации образцов на всех этапах обработки. И CAP, и The Joint Commission требуют, чтобы образец мог быть идентифицирован не менее, чем по двум параметрам [1,2]. TPID достигает этого с помощью системы, которая идентифицирует пациента и печатает штрих-код, содержащий информацию не менее, чем по двум параметрам, на каждом направлении, контейнере с образцом, кассете и стекле. Любое из
упомянутых действий может быть выполнено на соответствующей рабочей станции, что уменьшит
66 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 6 |
Идентификация ткани при иммуногистохимии |
|
|
ошибки, возникающие при обработке документации, переносе кассет или стекол из принтера на рабочую станцию. Повышение точности и идентификации приводит к уменьшению времени, затрачиваемого на поиск неправильно помеченных или «пропавших» блоков, сокращению времени исследования (время от получения образца до выдачи заключения), дает каждому лаборанту чувство безопасности и уверенности в процессе работы с образцом.
Информация по времени обращения, а также по многим другим деталям технологического процесса доступна в базах данных TPID. Эта информация позволяет руководителю мониториро-
вать рабочую нагрузку и производительность, и таким образом корректировать работу персонала, использование оборудования, чтобы соответствовать каждодневным требованиям. При оснащении приборов программными средствами TPID, становится проще локализовать каждый конкретный случай на любом этапе гистологической обработки.
Что делать и не делать
Делать:
1.Организуйте четкие и краткие технологические процедуры в соответствии с рекомендациями CAP и JCAHO по идентификации образцов.
2.Уберите мусорные ведра из мест, где производится забор образцов.
3.Не выбрасывайте весь мусор как минимум 3 дня.
4.В один момент времени маркируйте только один случай.
5.Держите все материалы по одному случаю вместе (направление на исследование, контейнеры с образцами, кассеты и др.).
6.Имейте сотрудника, который будет ответственен за помещение образца в емкость для транспортировки (образцы забираемые во время хирургической операции, образцы для микробиологического исследования, пробирки с кровью и др.), а также за маркировку материалов по одному случаю.
7.Имейте второго сотрудника, который будет проверять, что отправлено в лабораторию.
8.Во время вырезки на рабочей поверхности держите только те кассеты, которые имеют отношении к данному случаю. Незамедлительно убирайте с рабочей поверхности и выбрасывайте все кассеты, которые не имеют отношения к данному образцу.
9.Все остальные кассеты должны быть рядом с их образцами ткани.
10.При заливке вытирайте бранши пинцета
после каждого образца, чтобы убрать остатки ткани, которые могут быть перенесены на другой образец.
11.Работайте в тесном контакте с теми, кто имеет отношение к образцу: хирургами и операционными сестрами, транспортным персоналом, медрегистраторами, ассистентами врачей-патологоанатомов, ординаторами, врачами-патологоанатомами, лаборантами, секретарями и др.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 67
Идентификация ткани при иммуногистохимии |
Глава 6 |
||
|
|
|
|
Не делать: |
|
|
|
1. Не маркируйте заранее направления, контей- |
5. |
Не оставляйте ленты срезов во флотаци- |
|
неры с образцами или кассеты. |
|
онной емкости после монтажа срезов на |
|
2. Не регистрируйте два похожих образца |
|
стекла. |
|
|
|
|
|
подряд. |
6. |
Не оставляйте отпечатанные этикетки на |
|
рабочей поверхности. Выбрасывайте все
3. При заливке не открывайте более одной
неиспользованные этикетки, как только
кассеты одновременно.
становится понятно, что они уже не нужны.
4. При микротомии никогда не начинайте резать следующий парафиновый блок, пока работа с предыдущим не завершена.
Литература:
1. CAP |
website: |
www.cap.org. |
Laboratory |
Patient |
Safety |
Plan.http//www.cap.org/apps/ |
|
cap.por tal?_ nfpb =true&cnt v wrPtit _ actionOv erride=%2Fpor tlets%2FcontentViewer%2Fsh ow& _windowLabel= cnt v wrPtit&cnt v wrPtit%7 BactionForm.contentReference%7D=patient _ safety%2Flaboratory_patient_safety_plan.html&_ state=maximized&_pafeLabel=cntvwr
2.The Joint Commission Website: http//www.jointcommission.org. National Patient Safety Goals document.
3.The National Patient Safety Foundation Website: http://www.npsf.org/
4.Ohio University Center for Automatic Identifi cation: Executive Summary: Datamatrix and PDF417 Data Integrity Test, Russ, Fritz J, Russ, Dolores H.
5.Clinical and Laboratory Standarts Institute: Collection, Transport, Preparation and Storage off Speciments for Molecular Methods; Approved Guidelines; MM12-A, Vol. 25 No.31
6.Allen, Derek C., Histology Speciments: Clinical, Pathological and Laboratory Aspects, Springer; 2004
68 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
