
2 курс / Гистология / РУКОВОДСТВО_ИММУНОГИСТОХИМИЧЕСКИЕ_ММУНОГИСТОХИМИЧЕСКИЕ_МЕТОДЫ
.pdf
Антитела
лизированной антисыворотки или дополнительно очищен (рис. 1.5). Очистка иммуноглобулина для удаления других сывороточных белков
может быть выполнена с помощью фракционирования сульфатом аммония и ионообменной хроматографии, очистки белком А или G или выделением методом аффинной хроматографии.
Моноклональные антитела
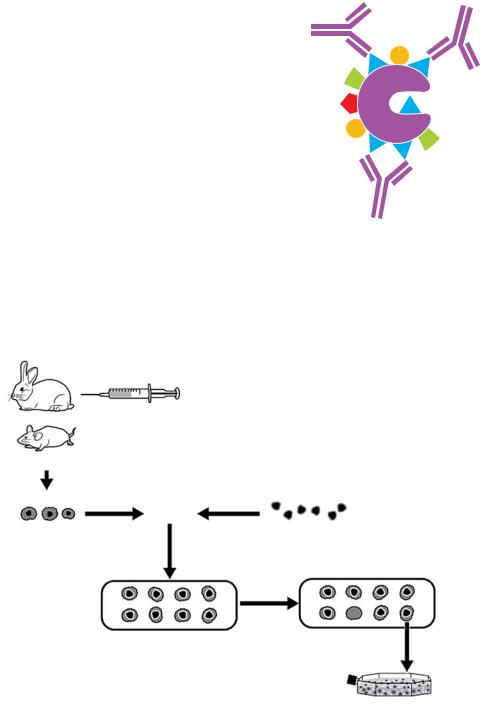
Моноклональные антитела являются гомогенной популяцией иммуноглобулинов, направленных против одного эпитопа (рис. 1.6). Антитела образуются одним клоном В-клеток одного животного и поэтому являются сходными по иммунохимическим свойствам. Моноклональные антитела чаще всего образуются у мышей и кроликов, но также могут быть образованы и другими видами, такими как крыса и верблюд. Животные иммунизируются с помощью внутрибрюшинной инъекции иммуногена, после которой в течение 2 месяцев для мышей и двух-четырех месяцев для кроликов животным каждые две недели проводятся бустер-инъекции. Мониторинг за иммунным ответом животного осуществляется посредством периодического исследования сыворотки крови. По достижении приемлемого иммунного ответа животное умерщвляется, из селезенки выделяются В-лимфоциты, которые
сливаются с иммортализованной линией клеток (миеломная клеточная линия/ сливающиеся клетки). В-лимфоциты обладают способностью продуцировать специфический иммуноглобулин, в то время как сливающаяся клеточная линия обеспечивает возможность «бессмертного» существования и неограниченного роста в культуре. Слитая и иммортализованная клеточная линия обозначается как гибридома. Клеточная линия гибридомы культивируется, отбирается и пересеивается методом серийных разве-
дений для получения стабильного клона с высокой способностью к продукции антител. Для продукции супернатанта культуры ткани, клеточная линия гибридомы культивируется во флаконах, предназначенных для множества культур тканей. Для роста гибридомы и образования антител в крупном масштабе могут быть использованы биореакторы. Биореактор является системой, которая постоянно пополняет запасы свежей среды для клеток и стимулирует рост для культивации концентрированных антител. Асцитическая жидкость образуется путем введения клеток гибридомы в брюшную полость животного (обычно мыши), которая формирует опухоль. Иммуноглобулин секретируется в брюшную полость, после чего производится забор асцитической жидкости. Асцитическая жидкость имеет очень высокую концентрацию антител по сравнению с супернатантом культуры ткани. Тем не менее, в препаратах асцитической жидкости будут представлены загрязненные антитела. По этическим соображениям (правила обращения с животными), некоторые избегают производства асцитической жидкости и предпочитают применять альтернативные методы. В качестве препаратов моноклональных антител могут быть использованы как стабилизированный супернатант культуры ткани, так и асцитическая жидкость. Дополнительная очистка иммуноглобулина может быть выполнена с помощью хромато-
графии с белком А или G или с помощью аффинной очистки.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 19
Антитела |
Глава 1 |
|
|
|
|
В подавляющем большинстве случаев производятся мышиные антитела, однако, в настоящее время возрастает количество кроличьих моноклональных антител (рис. 1.7). Использование кроликов для продукции моноклональных антител имеет некоторые преимущества по сравнению с мышиными моноклональными антителами. Эти преимущества также распространяются и на кроличьи поликлональные иммуноглобулины. Описано, что кролики имеют более разнообразные области распознавания эпитопа, чем мыши (меньше иммунодоминирование) и улучшенный иммунный ответ на эпитопы малого размера. Кроме того, у кроликов есть тенденция к продукции антител с более высокой аффинностью и общей авидностью. Полученные кроличьи антитела также обладают улучшенными связывающими свойствами из-за выраженного гликозилирования. Тем не менее, в мышиных гибридомах наблюдается тенденция к образованию большего количества иммуноглобулинов, чем в кроличьих гибридомах, и клеточные линии мышиной гибридомы обычно более стабильны в культуре.
Иммунизация и бустер-иммунизация
Рис. 1.6. Определенный клон моноклональных антител реагирует со специфическим эпитопом антигена.
|
Слияние |
Выделенные |
Миеломные клетки |
В-лимфоциты |
|
Клон каждой положительной Размножение
культуры
Супернатант культуры клеток: гомогенная популяция антител
Рис. 1.7. Процесс производства моноклональных антител.
20 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Глава 1 |
Антитела |
|
|
Сравнение поликлональных и моноклональных антител
При сравнении преимуществ и недостатков поликлональных и моноклональных антител, у обоих
имеются преимущества. Из-за своей мультиклональности поликлональные антитела обычно являются более надежными реагентами при использовании на гистологических препаратах, обрабатываемых обычным способом. Способность поликлонального реагента узнавать множество эпитопов на одной молекуле означает, что реагент не так подвержен вредным воздействиям обработки ткани пациента до проведения анализа, как моноклональные антитела, действие которых направлено против одного
эпитопа. Наличие антител к множеству эпитопов, тем не менее, может повысить вероятность перекрестной реактивности (см. «Перекрестная реактивность антитела») с другими белками.
Преимущество моноклональных антител состоит в их единообразии в различных партиях и отсутствии вариабельности, присущей поликлональным антителам, которая связана с иммунологическим состоянием животного. Использование гибридомы в производстве моноклональных антител позволяет получить стабильную продукцию антитела и не зависит от жизни животного, как в случае продукции поликлональных антител.
Аффинность антител
Антитела от гипериммунизированных животных различаются не только по детерминантам, которые они узнают на мультивалентных антигенах, но также по их аффинности к ним. Термин «аффинность» используется для описания как истинной, так и функциональной аффинности [4].
Истинная аффинность антитела связана с HV областью и определяется той же последовательностью аминокислот, которая определяет специфичность. Основными факторами истинной аффинности между паратопом антитела и эпитопом антигена являются в первую очередь ионные (электростатические) взаимодействия, но также и водородная связь и ван-дер-ваальсовы силы межмолекулярного взаимодействия. Гидрофобность формируется последней и оказывает стабилизирующий эффект
на образованный иммунный комплекс, при этом она обычно приводит к преципитации растворимых реактантов. Ковалентная связь между антителом и антигеном не образуется. Показателем аффинности антитела является константа ассоциации (Ка) связывания между антителом и его антигенной детерминантой. Ее значение может варьировать от 103 до 1010 л/моль и является обратной величиной концентрации, выраженной в моль/л. Чем выше истинная аффинность антитела, тем меньшая концентрация антигена необходима для насыщения доступных мест связывания (достигается равновесие). Точно также как во время иммунизации со временем увеличивается титр антител, так же и повышает их аффинность. Это явление было названо «созреванием аффинности» [5]. Более низкие дозы иммуногена увеличивают скорость созревания аффинности, но могут привести к образованию меньших титров антител, и наоборот.
В иммуногистохимии функциональная аффинность антитела или антисыворотки может быть приблизительно определена по времени, которое требуется для достижения равновесия с тканевым антигеном. Если одинаковые аликвоты двух растворов антител или антисывороток, имеющих одина-
ковый титр, инкубируются с антигеном на ткани в течение увеличивающихся промежутков времени,
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 21
Антитела |
Глава 1 |
|
|
большей функциональной аффинностью обладает то антитело, которое первым достигает значения
плато максимальной интенсивности окраски. Термин «авидность» используется как синоним функциональной аффинности [5], а также для обозначения прочности связывания между антителом и его антигеном [6]. Термин авидность также используется для описания общей суммы всех значений истинной аффинности, полученных в популяции поликлональных антител.
Поскольку реакции антиген-антитело являются обратимыми, простые иммунные комплексы, образованные в ткани, могут периодически диссоциировать во время циклов отмывки, применяемых в иммуногистохимии. Легкость и степень этой диссоциации различается у разных антител, при этом низкие концентрации солей, а также низкие температуры будут уменьшать вероятность слабой окраски в связи с диссоциацией уже сформированного иммунного комплекса. Таким образом, желательно использовать антитела с высокой аффинностью, преимущество которых состоит в том, что во время промывки имеется меньшая вероятность диссоциации иммунного комплекса по сравнению с антителами, имеющими низкую аффинность. Как было упомянуто ранее, поликлональная популяция антител содержит более или менее постоянный спектр значений аффиности (от низкой до высокой) к нескольким эпитопам на конкретном антигене. Поэтому маловероятно, что чрезмерная промывка после инкубации с первичными антителами этого типа приведет к какому-либо значительному уменьшению интенсивности окраски.
С другой стороны, моноклональные антитела обладают одинаковой аффинностью, и если она
является низкой, уменьшение интенсивности окраски может быть связано с диссоциацией антитела и его эпитопа. Поэтому по возможности необходимо выбирать моноклональные антитела, обладающие высокой аффинностью. Как указано выше, необходимо избегать факторов, которые ослабляют связь антиген-антитело, таких как высокие концентрации солей, высокая температура и очень низкое значение рН во время промывки тканей. Опыт работы с антителами в иммуногистохимии показал, что продолжительность промывки и инкубации в ваннах с буфером можно безопасно уменьшить и что легкое взбалтывание помогает ослабить фоновую окраску [7].
Аффинность антител также связана с их способностью образовывать нерастворимые иммунные комплексы. В целом, чем больше аффинность антитела, тем больше он имеет склонность к формированию преципитата. Преципитация происходит быстро в одну стадию, в которой формируются растворимые комплексы антиген-антитела с последующей более медленной агрегацией и, в конечном счете, преципитацией. Не преципитирующие антитела в основном обладают более низкой аффинностью и не способны к формированию решетчатых структур, необходимых для осуществления преципитации.
Моноклональные антитела вне зависимости от того, обладают они высокой или низкой аффинно-
стью, не формируют решетчатых структур с антигеном и поэтому только изредка образуют нерастворимые преципитаты. В иммуногистохимии способность первичного антитела образовывать преципитирующие иммунные комплексы имеет небольшое значение, поскольку реакция с иммобилизованным тканевым антигеном приводит скорее к захвату антитела в ткани, чем к преципитации.
22 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Глава 1 |
Антитела |
|
|
Прозона является состоянием, которое было впервые отмечено при агглютинациях, вызванных
антителом. Имеется наблюдение, что некоторые антитела при недостаточном разведении не агглютинируют клетки даже при условии, что более высокие разведения вызывают агглютинацию. Несмотря на то, что прозона может также наблюдаться в реакциях преципитации, в иммуногистохимии она встречается редко [7].
Так как большинство антител несут положительный электростатический заряд, степень аффинности антитела к конкретному тканевому антигену также зависит от наличия и избытка результирующих отрицательных электростатических зарядов, представленных на антигене. Доказано, что нарушение этих зарядов и, как следствие, непредсказуемо изменчивая иммунная реактивность с первичным антителом в значительной степени связаны с чрезмерным временем фиксации многих тканей в формалине. Тем не менее, утраченные аффинности ко всем антигенам, как правило, восстанавливаются путем обычной температурной демаскировки [8].
Перекрестная реактивность антител
Термин «перекрестная реактивность» обозначает иммунохимическую активность, которая может наблюдаться как между антителом и двумя или более антигенами, так и, наоборот, при реакции антигена с несколькими различными антителами. Типовыми примерами перекрестной реактивности являются взаимодействие антитела против L- (или К-) цепи со всеми пятью классами Ig, а также реакция раково-эмбрионального антигена (CEA) с антителами против СЕА, антигенами группы крови и нормальными тканевыми белками соответственно. Причиной в каждом случае является наличие, по крайней мере, одного общего эпитопа у нескольких антигенов.
Другое допустимое использование понятия перекрестной реактивности связано с экспермиментально или случайно вызванными изменениями в одном или нескольких эпитопах в ходе демаскировки антигена [9], которые приводят к возможной утрате специфичности заданного моноклональ-
ного антитела к этому антигену. Термин перекрестная реактивность также отражает взаимодействие антитела со сходными или различными эпитопами на неродственных антигенах. Этот последний феномен, тем не менее, часто характерен для антител с низкой аффинностью и обычно изменяется при созревании аффинности во время иммунизации.
Перекрестная реактивность антител против человеческих антигенов с идентичными или сходными антигенами других видов или межвидовая перекрестная реактивность может быть интересна из-за недостатка антигенов, специфичных для животного. Чтобы преодолеть эту проблему, в двух публикациях сообщались результаты исследований межвидовой реактивности с использованием имеющихся на рынке античеловеческих поликлональных и моноклональных
антител [10, 11]. Было продемонстрировано, что у подавляющего большинства отобранных антигенов животных наблюдалась выраженная реакция с античеловеческими антителами. Тем не менее, для получения более подробной технической информации по использованию данного мышиного первичного антитела на тканях животных читателю следует обратиться к испытанию продуктов на животных.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 23
Антитела |
Глава 1 |
|
|
Термин перекрестная реактивность, однако, неуместен при описании любой наблюдаемой окраски тем же антителом различных клеток или компонентов ткани вне зависимости от того, содержат ли они общие антигены или нет, так как это бы искажало строгое иммунохимическое определение термина.
Скорость реакции антител
Хотя при идеальных условиях антитела реагируют со своими антигенами очень быстро, в имму-
ногистохимии условия редко бывают идеальными. В зависимости от продолжительности фиксации ткани, концентрации антител, температуры окружающей среды и других факторов, для достижения максимальной реактивности может потребоваться до 48 часов инкубации первичного антитела [12]. Поскольку иммуногистохимические процедуры становятся все более востребованы в хирургической биопсийной патологии, была также озвучена необходимость укорочения времени обработки ткани. Очень короткие периоды инкубации становятся возможными при относительно высоких скоростях реакции, которые наблюдаются при использовании более высоких концентраций первичных и связанных антител, обладающих высокой аффинностью.
В таких ситуациях равновесие между связанным с антигеном и свободным антителом достигается редко. Для достижения равновесия требуются очень длительные периоды инкубации с более
разведенными препаратами антител. Не известно, установится ли равновесие раньше при более кратковременных инкубациях с более концентрированными препаратами антител, поскольку, как правило, в таких условиях может возникнуть неспецифическая фоновая окраска, препятствующая однозначной интерпретации результатов. Инкубированные первичные антитела в экспериментах были сохранены после первого использования путем аспирации из одного среза и переноса на дополнительные срезы [7]. При использовании некоторых первичных антител в концентрациях, требуемых для обычных 10-минутных инкубаций, может быть покрашено с одинаковым качеством до семи одинаковых препаратов ткани. Это предполагает, что во время таких относительно коротких времен инкубации в действительности используются очень маленькие фракции имеющихся в растворе антител. Не приходится говорить и о том, что после выбора времени инкубации необходимо постоянно придерживаться этого времени, иначе нельзя будет получать стабильно воспроизводимые результаты окраски.
Как правило, размер и форма молекулы антитела и его конъюгатов или комплексов, играет несущественную роль в иммуногистохимии. Вне зависимости от того, использовались ли первичные антитела класса IgM (900 кДа), крупные комплексы, такие как PAP (400-430 кДа) или APAAP (около 560 кДа) или сшитые декстраном реактивы (см. главу 10, «Методы иммуногистохимической окраски»)
никогда не наблюдалось недостаточного проникновения антитела в ткани, даже при окраске внутри-
ядерных или цитоплазматических антигенов. Тем не менее, разумно предположить, что чрезмерная фиксация ткани может затруднить проникновение в ткани антител и их комплексов.
Стабильность антител
Поликлональные антитела, если их хранить в незамороженном состоянии и использовать впослед-
ствии в иммуногистохимии, являются до некоторой степени менее стабильными по сравнению с цельной
24 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Глава 1 |
Антитела |
|
|
|
|
антисывороткой [7]. Тем не менее, эта сниженная стабильность, значительно зависит от метода очистки и условий хранения, а также от способа применения. Если во время очистки антитела подвергаются воздействию экстремальных значений рН, а также высоких или очень низких концентраций солей, отмечается тенденция к снижению их стабильности в большей степени, чем при очистке в мягких условиях, таких как ионообменная хроматография. Среди изменений, отмеченных после длительного хранения, чаще всего встречается образование растворимых агрегатов и впоследствии преципитирующихся полимеров. Эти изменения, вероятно, являются результатом гидрофобного взаимодействия между молекулами IgG в растворе. Несмотря на то, что наличие растворимых агрегатов может усилить преципитирующие свойства антител, было показано, что повышенная гидрофобность антител в иммуногистохимии вызывает усиление неспецифического связывания (см. главу 16, «Фоновая окраска») [7]. По этой причине перед использованием фракций IgG в иммуногистохимическом анализе будет предусмотрительным удалить из них эти агрегаты и полимеры.
Хранение очищенных антител может не только увеличивать их гидрофобность в связи с агре-
гацией и полимеризацией, но и может способствовать их конъюгации с другими молекулами [13]. Конъюгация с глютаральдегидом затрагивает Е-аминогруппы лизина и α-аминогруппы N-концевых аминокислот, приводя к их перекрестной реактивности. Поскольку в молекулах IgG имеется много участков, которые могут прореагировать с глютаральдегидом, гидрофобность конъюгированных антител может значительно повыситься, приводя к усилению притяжения к гидрофобным областям фиксированной ткани и усилению фоновой окраски.
Методы очистки и хранения могут также повлиять и на характеристики моноклональных антител: в 42% препаратов моноклональных антител, исследованных РА Underwood и PA Bean, наблюдались изменения специфичности, аффинности и перекрестной реактивности [14]. Особенно чувствительными были антитела класса IgM и lgG2b.
Необходимо отметить, что определение действительного срока годности белковых реагентов
практически невозможно. Несмотря на широкое использование в фармацевтической практике метода ускоренного исследования распада при высокой температуре [15, 16], его применение при анализе иммунохимических реактивов, таких как антисыворотки и антитела, может быть неподходящим или даже вводить в заблуждение [17, 18].
Стабильность антител в серийно выпущенных реагентах наилучшим образом определяет каждый производитель при исследовании в реальном времени и при реальной температуре. Большинство производителей демонстрируют стабильность антител путем анализа реагентов в течение заранее определенного периода времени, то есть срока годности.
Кроме того, по опыту автора, условия для хранения реагентов в лаборатории пользователя часто не идентичны условиям, которые применяет производитель при исследованиях в течение срока годности. Учитывая возможность хранения продукта после его покупки при нежелательных условиях, производитель может нести только ограниченную ответственность за эффективность реагента вместо того, чтобы прогнозировать действительный срок годности продукта.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 25
Антитела |
Глава 1 |
|
|
|
|
Единственно возможным следствием этих требований является рекомендация документировать активность продукта до ее утраты. В качестве альтернативы можно рекомендовать аликвотировать и замораживать неразведенные антитела при температуре -20°C, чтобы использовать из позднее. Настоятельно рекомендуется подтверждать активность реагента до использования антитела в каком-либо исследовании.
В настоящее время практикуется использование срока годности для проверки соответствия нормативным требованиям. Нормативные рекомендации, действующие в Соединенных Штатах
Америки для клинических лабораторий, были установлены законом о клинических лабораторных исследованиях (1988), и Коллегией американских патологов (IFCAP). Согласно этим требованиям, в клинической диагностической лаборатории при исследовании человеческой ткани не должны использоваться реактивы с истекшим сроком годности.
Обращение с антителами
Для достижения оптимальной эффективности реактивов, используемых в иммуногистохимии, необходимо следовать основным правилам обращения с ними и хранения. При строгом соблюдении правил большинство реагентов останутся стабильными в течение месяцев или даже лет. Необходимо всегда принимать во внимание рекомендации, приведенные производителем в листках спецификации и на этикетках пробирок.
Получение
Хотя стабильность большинства серийно выпущенных иммунохимических реагентов гарантируется в течение нескольких лет, готовые к использованию (RTU) антитела имеют более короткий срок годности (см. «Стабильность антител»). По получении, иммунохимические реагенты должны быть помещены на хранение согласно рекомендациям производителя. Учет реактивов рекоменду-
ется производить путем сбора информации о номерах партий производителя, дате истечения срока годности, дате получения реактива и номере счет-фактуры. Учет данных предоставит пользователю важную информацию, особенно если позднее потребуется подача рекламаций.
Хранение
Пожалуй, двумя самыми важными факторами, которые необходимо учитывать при хранении антител, являются контейнер для хранения и температура хранения.
Контейнеры для хранения
В идеальном случае предпочтительные материалы контейнеров для хранения растворов белка должны иметь незначительную способность адсорбировать белок. Рекомендуется использовать и широко используется полипропиленовое, поликарбонатное или боросиликатное стекло. В растворы, содержащие очень низкие концентрации белка (то есть менее 10-100 мкг/мл), необходимо добавлять иммунохимически инертный белок. В целом, для предотвращения снижения концентрации белка в результате его полимеризации и адсорбции на стенках контейнера используется 0,1%-1,0% бычий
26 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Глава 1 |
Антитела |
|
|
альбумин. Предпочтительнее использовать контейнеры, сделанные из прозрачных бесцветных материалов, так как это позволит проводить быстрый осмотр содержимого. Этикетки контейнера также должны позволить провести осмотр содержимого.
Температура хранения
За соблюдением должной температуры хранения, рекомендованной производителем, следят, вероятно, в большей степени, чем за каким-либо другим фактором. Проводится контроль за соблю-
дением точных и постоянных температур в холодильниках и морозильных камерах, используемых для хранения иммунохимических реактивов. Дорогостоящие и большие количества иммунохимических реактивов следует хранить в оборудовании, имеющем сигнализатор перегрева и систему аварийного резервного электроснабжения.
Большинство RTU антител и растворов их конъюгатов хранятся при температуре 2-8°C, поскольку замораживание и размораживание, как известно, отрицательно влияет на их эффективность. Такие условия применяются также при хранении всех наборов, содержащих готовые к использованию реактивы, включая моноклональные антитела. Концентрированные растворы белка, такие как антисыворотка и фракции иммуноглобулинов, хранятся в виде аликвот в замороженном виде при температуре -20°C или ниже, чтобы избежать циклов повторного замораживания и размораживания. При разморозке температуру замороженных растворов белка медленно доводят до комнатной, избегая нагревания растворов до температур свыше 25°C.
Использование и уход
Надлежащий уход за реактивом может уменьшить проблемы, возникающие в результате контаминации, нагревания или избыточного воздействия света. Загрязнения реактива можно избежать путем использования чистых наконечников пипетки. Быстрое возвращение реактивов в надлежащие
условия хранения продлит их срок годности.
Внешний вид иммунохимических реактивов, в особенности неразведенной антисыворотки, не всегда является показателем их эффективности. Хотя β-липопротеины обладают сильными гидрофобными свойствами, ни липемия, ни липолиз не были систематически изучены на предмет нарушения иммуногистохимической окраски. При случайном выявлении выраженной липемии в антисыворотке и при подозрении на то, что липемия является причиной нарушения успешной окраски, рекомендуется устранение липидов из раствора с помощью декстран сульфата и кальция [19] или путем экстракции органическими растворителями. В качестве альтернативы оказалось полезным добавление 2 г аэросила (компании «Degussa», New York, USA) к 100 мл антисыворотки с последующей инкубацией в течение четырех часов при температуре 37°C.
Гемолиз легкой или умеренной степени в антисыворотке, связанный с дефектами методик забора крови, вероятно, не препятствует проведению большинства иммуногистохимических процедур окраски, однако следует избегать использования растворов с выраженным гемолизом. При случайном выявлении выраженного гемолиза или липемии может понадобиться выделение фракции иммуно-
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 27
Антитела |
Глава 1 |
|
|
глобулина из антисыворотки. Такие изоляты, как правило, будут иметь вид бесцветного прозрачного раствора. Нельзя использовать все иммунохимические реактивы, включая антисыворотку и нормальную не иммунную сыворотку, в которых наблюдается рост бактерий. Их использование в иммуногистохимических исследованиях вероятнее всего приведет к появлению артефактов и неспецифической окраски.
Знания природы антител, их возможностей и ограничений, позволят пользователю лучше использовать эти реактивы и эффективнее решать возникающие проблемы. Следующие главы дополнительно помогут понять природу и принципы работы антител. В них также приводится подробная информация о дополнительных реактивах и процедурах, применяемых в иммуногистохимии.
Литература:
1.Atassi MZ et al. Molecular Immunology. Marcel Decker, Inc. New York, 1984.
2.Harboe NMG and Ingild A. // Scand J Immunol. – 1983.
–17. – p. 345-351.
3.Boenisch T // Appl. Immunohistochem. – 1999. – 7(4).
–p. 300-306.
4.Hornick CL and Karush F. // Immunochemistry. – 1979.
–9. – p. 325-340.
5.Steward MW and Steensgaard J Antibody Affinity: Thermodynamic Aspects and Biological Signifi cance.
–Boca Raton CRC Press, 1983.
6.Herschowitz HID Irnmunophysiology: Cell function and cellular interactions in antibody formation // In: Bellanti JA Immunology III. – Philadelphia: Saunders, 1985.
7.Boenisch T // Appl Immunohistochem. – 2001. – 9(2).
–p. 176-179.
8.Boenisch T // Appl Immunohistochem. – 2005. – 13(3).
–p. 283-286.
9.Alexander J and Dayal Y. // Appl Immunohistochem. – 1997. – 5(4). – p. 252-253.
10.Smith RA // J Histoteeh. – 1990. – 13(4). – p. 255-269.
11.Martin CA and Badran AF // Appl Immunohistochem. – 1998. – 6(2). – p. 84-88.
12.Boenisch T // Appl Immunohistochem. – 2002. – 10(4).
– p. 363-367.
13.Sternberger LA // Immunocytochemistry (2nd ed). – New York: Wiley, 1979.
14.Underwood PA and Bean PA // J Immunol Meth. – 1985. – 80. – p. 89-97.
15.Kirkwood TBL et al // Biometrics. – 1977. – 3. – p. 38-48.
16.Tydeman MS and Kirkwood TBL. // J Biol Standard. – 1984. – 12. – p. 195-206.
17.Jackson CM. // IVD Technology. – 1997. – 3. – p. 38-48
18.vanErp R et al // J Biotech. – 1991. – 20. – p. 249-262.
19.Kim YC and Nishida // TJ Biol Chem. – 1979. – 254. – 9621. – p.26-64.
28 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
