
2 курс / Гистология / РУКОВОДСТВО_ИММУНОГИСТОХИМИЧЕСКИЕ_ММУНОГИСТОХИМИЧЕСКИЕ_МЕТОДЫ
.pdf
Глава 16 |
Оптимизация иммуногистохимических исследований |
|
|
Блокаторы эндогенных ферментов
Чаще всего в иммуногистохимии для генерирования хромогенного сигнала используются два фермента: пероксидаза хрена и щелочная фосфатаза. Оба фермента проявляют эндогенную активность в образцах клеток и тканей. Если эндогенные ферменты по специфичности схожи с ферментами, использующимися в системе иммунодетекции, активность эндогенных ферментов может обусловить появление ложноположительного сигнала, пересекающегося, а в некоторых случаях и перекрывающего сигнал иммуногистохимической реакции, чем обусловлено выраженное фоновое окрашивание. Для снижения активности эндогенных ферментов в клетках и тканях применяются блокаторы эндогенных ферментов.
В табл. 16.2 перечислены некоторые распространенные источники эндогенной активности. С помощью простых реагентов можно полностью подавить активность эндогенных ферментов, ингибируя их или инактивируя кислотой (см. табл. 16.3 и главу 17, «Фоновое окрашивание»).
Таблица 16.2.
ЭНДОГЕННЫЕ ФЕРМЕНТЫ, ОБНАРУЖИВАЕМЫЕ В РАЗНЫХ КЛЕТКАХ И ТКАНЯХ
Пероксидаза |
|
Щелочная фосфатаза* |
Эритроциты |
|
Плацента |
|
||
|
Тонкая кишка |
|
|
|
|
|
|
|
Гранулоциты |
|
Проксимальные отделы канальцев почек |
|
|
|
Эозинофилы |
|
Остеобласты кости |
|
|
|
Гепатоциты |
|
Эндотелиальная выстилка артерий и капилляров |
|
|
|
Мышцы |
|
Ретикулярные клетки стромы |
|
|
|
Почка |
|
Нейтрофилы |
|
|
|
Моноциты |
|
Фолликулы и мантийная зона в большинстве лимфоидных органов |
|
|
|
*Щелочная фосфатаза разрушается в процессе обычной фиксации и заливки ткани в парафин
Таблица 16.3.
РАСПРОСТРАНЕННЫЕ БЛОКАТОРЫ ЭНДОГЕННЫХ ФЕРМЕНТОВ
ДЛЯ ПЕРОКСИДАЗЫ ХРЕНА И ЩЕЛОЧНОЙ ФОСФАТАЗЫ
Двойной блок эндогенных ферментов |
Пероксидаза хрена и щелочная фосфатаза |
|
|
|
|
Перекись водорода |
Пероксидаза хрена |
|
|
|
|
Левамизол + хромоген, кроме кишечной |
Щелочная фосфатаза |
|
щелочной фосфатазы |
||
|
||
|
|
|
Слабая кислота (0,3 N HCl), включая |
Щелочная фосфатаза |
|
кишечную щелочную фосфатазу |
||
|
||
|
|
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 159

Оптимизация иммуногистохимических исследований |
Глава 16 |
|
|
В качестве общей рекомендации к протоколу окраски: блокаторы ферментов следует применять перед нанесением антител. Однако, в некоторых случаях блокаторы ферментов могут влиять на ход иммуногистохимической реакции. Например, слабые растворы кислот, применяемые для блокирования эндогенной щелочной фосфатазы, могут менять пространственную ориентацию эпитопов, снижая интенсивность специфического взаимодействия. В этих случаях блокирование активности эндогенных ферментов необходимо проводить после нанесения первичных антител, но обязательно до системы иммунодетекции, меченной ферментом.
Протеиновый блок
Эти белоксодержащие реагенты применяются для подавления неспецифического реаги-
рования, возникающего в результате связывания антител и других используемых реагентов с различными компонентами ткани.
Антитела и системы детекции, применяемые в иммуногистохимии, в большинстве представлены белковыми компонентами, что создает возможности для неспецифического реагирования. Протеиновый блок вступает в конкурентное взаимодействие с неспецифическими сайтами связывания образца, тем самым уменьшая неспецифическое связывание антител. Так как места связывания блокируются перед (или во время) инкубации образца с другими иммуногистохимическими реагентами, неспецифический сигнал, который мог бы проявиться, полностью подавляется. Более развернутое обсуждение различных неспецифических белок-белковых взаимодействий, происходящих при IHC исследовании в тканях, и протеиновых блоков, которые можно применять для предотвращения этих взаимодействий, приведено в главе 17, «Фоновое окрашивание».
160 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 16 |
Оптимизация иммуногистохимических исследований |
|
|
Растворители антител (дилюэнты, diluents)
Растворители антител (дилюэнты) – это забуференные растворы, применяемые для приготовления рабочих растворов антител для IHC. Так как конформация антител сильно зависит от растворителя, состав последнего может в значительной мере повлиять на стабильность и специфичность антител, способность к специфическим и неспецифическим взаимодействиям. Различия в заряде, гидрофобности, гликозилировании и других физико-химических свойствах молекул антител могут изменить предполагаемые свойства комбинации антитело-дилюэнт. При подборе растворителя для коммерческих антител рекомендуется следовать рекомендациям производителя.
Ионные взаимодействия являются одним из основных факторов, определяющим взаимодействие антитела и антигена (рис. 16.3), но эти взаимодействия зависят от рН среды. В общем случае буферные системы с рН 7,3-7,4 подходят для большинства первичных антител и могут служить хорошей основой для подбора оптимальных условий. Изоэлектрическая точка, или pI (кислотность среды, при которой суммарный заряд молекулы равен нулю), иммуноглобулинов находится в диапазоне 5,8-8,5, в зависимости от антител. Если рН раствора слишком близок к pI антитела, растворимость может понизиться, что негативно отразится как на реакции, так и на фоновом окрашивании. Если при исходном рН обнаруживается слабый сигнал и выраженное фоновое окрашивание, можно попытаться уменьшить или увеличить рН растворителя на 0,5. Взаимодействия антител также зависят от ионной силы. Большинство растворителей содержат милимоллярные концентрации хлористого натрия или других солей, которые снижают неспецифические взаимодействия между заряженными молекулами. Следует избегать слишком высокого ионного заряда, так как он может повлиять на специфические ионные взаимодействия, необходимые для эффективного связывания антитела и эпитопа.
Некоторые базовые дилюэнты доступны в коммерческих сетях, что упрощает процесс подбора
растворителя для новых
антител или исследо - |
Антитело |
|
|
|
|
|
|
|
|
|
Антиген |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ваний и, кроме этого, повы- |
|
CH2 |
OH |
C |
CH2CH2 |
Гидрофобные мостики |
|||||
шает стабильность рабо- |
|
|
|
|
|
NH2 |
|
|
|
|
|
чего раствора первичных |
|
|
|
|
|
-O |
|
|
|
|
Ионные взаимодействия |
|
|
CH2CH2CH2CH2NH3+ |
C |
|
CH2 |
||||||
антител. Многие коммерче- |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|||
ские дилюенты основаны |
|
CH3 |
|
|
|
|
|
||||
|
|
|
CH |
CH2 Гидрофобные взаимодействия |
|||||||
|
CH2CH |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||
на трис-HCl буфере, содер- |
|
CH3 |
|
CH3 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
жащем детергент и особый |
|
|
|
|
|
CH3 |
CH |
|
Van-der-Waals |
||
|
|
CH2 CH2 CH |
|
CH3 |
|
|
|
||||
|
|
|
|
|
|||||||
стабилизатор. В состав |
|
|
CH3 |
CH3 |
взаимодействия |
||||||
|
|
|
|||||||||
некоторых буферов также |
|
|
|
|
|
|
|
|
|
|
|
входят белковые компо- |
|
|
|
|
|
|
|
|
|
|
|
ненты, снижающие фоновое |
|
|
|
|
|
|
|
|
|
|
|
окрашивание, например, |
Рис. 16.3. Антитела взаимодействуют с антигенами посредством |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
электростатических сил, |
в особенности |
Van-der-Waals и гидрофобных |
||||||||
с ы в о р о т о ч н ы й б ы ч и й
взаимодействий.
альбумин или другие сывороточные белки. При приме-
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 161
Оптимизация иммуногистохимических исследований |
Глава 16 |
|
|
нении последних буферов следует помнить, что эти белки могут связываться с первичными антителами, снижая их чувствительность, а взаимодействие с вторичными антителами, применяемыми для IHC детекции, может обусловить появление ложноположительного результата.
Стабильность антител в растворе не может быть определена без проведения специальных исследований, которые направлены на валидацию стабильности первичных антител в растворе соответствующими методами и соблюдение срока их использования. Одно из преимуществ использования коммерческих разведенных (готовых к употреблению, RTU) первичных антител состоит в защите покупателя, что обеспечивается списком нормативных требований, предъявляемых к производителям реагентов. Производитель должен продемонстрировать устойчивость коммерческих реагентов в течение определенного периода, на основании чего устанавливается срок годности антител.
Важные моменты при выборе растворителя
•рН растворителя может играть определяющую роль в эффективности реакции;
•высокие концентрации хлорида натрия и азидов, часто применяемых в качестве консервантов коммерческих растворителей, могут снизить активность антител. Большая ионная сила может снизить специфическое окрашивание, изменяя взаимодействие антитела и антигена;
•в общем случае менее концентрированный раствор антител является менее стабильным.
•применение сильно разведенных растворов антител лучше прекратить за несколько дней до установленного срока снижения их стабильности;
•рН трис-буферов изменяется в зависимости от температуры. Всегда готовьте буферы при той температуре, при которой они будут использоваться и помните, что нагревание или охлаждение может привести к изменению рН ряда буферов, всегда используйте реагенты комнатной температуры;
•фосфатный буфер (PBS) стоит применять в качестве растворителя только в тех случаях, когда это оговорено производителем антител.
Промывочный буфер
Промывочный буфер следует использовать для удаления остатков реагента с образца ткани после каждого этапа реакции. Наиболее распространенные промывочные буферы, в том числе и коммерческие, состоят из смеси растворов трис-буфера (TBS) и фосфатного буфера (PBS).
Раствор трис-буфера (TBS)
Промывочные буферы, основанные на трис(гидроксиметил)аминометане, часто комбинируются с неионным детергентом Tween 20. В состав коммерческих промывочных буферов могут также входить консерванты, например, 0,01% азид натрия, которые предотвращают рост микроорганизмов в растворе и увеличивают срок годности реагента.
162 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 16 |
Оптимизация иммуногистохимических исследований |
|
|
Растворы трис-буфера рН чувствительны. При нагревании, рН раствора возрастает в среднем на 0,03 каждые 0,01°С. В связи с этим необходимо следить за сохранением рабочей температуры раствора буфера для обеспечения устойчивого рН (табл. 16.4).
Таблица 16.4.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА РН РАСТВОРА ТРИС-БУФЕРА
Температура |
pH |
5 °C |
8.18 |
|
|
25 °C |
7.60 |
|
|
37 °C |
7.30 |
|
|
Промывочные буферы могут применяться для предупреждения неспецифического связывания реагентов с образцом ткани. При необходимости проведения высокоспецифических реакций с применением очень чувствительных методов детекции, увеличение объема промывочного буфера и концентрации детергентов может снизить неспецифическое связывание. Добавление солей в высокой концентрации (например, NaCl) или детергентов (например, Tween 20) к раствору промывочного буфера значительно снизит неспецифическое взаимодействие многих иммуногистохимических реагентов, в том числе антител и систем детекции, например, меченых полимеров.
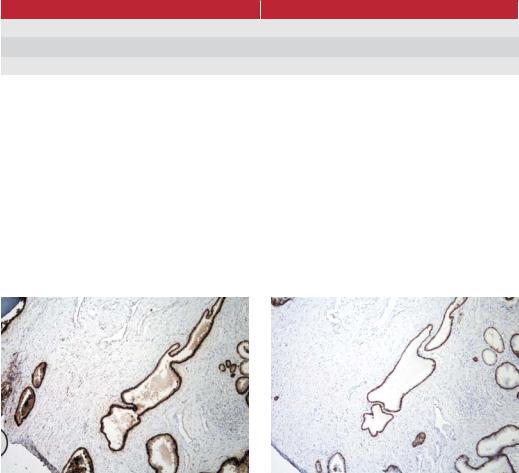
Рис. 16.4а. Предстательная железа, окраска антицитокератином, клон 34BE12, Dako Code M0630. Ткань обрабатывалась 150 mM NaCl, 0,05% Tween 20, раствором трис-буфера, Dako Cede S3006, ph 7.6 при температуре 25°С. Неспецифическое окрашивание в просвете желез и строме.
Рис. 16.4b. Предстательная железа, окраска антицитокератином, клон 34BE12, Dako Code M0630. Ткань обрабатывалась 300 mM NaCl 0,05% Tween 20 раствором трис-буфера, Dako Cede S3006, ph 7.6 при температуре 25°С. Окрашены только клетки эпителия желез.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 163
Оптимизация иммуногистохимических исследований |
Глава 16 |
|
|
Раствор фосфатного буфера (Phosphate-Buffered Saline, PBS)
PBS широко применяется в качестве промывочного буфера в IHC. Преимуществами фосфатного буфера является его способность снижать аутофлуоресценцию ткани при проведении иммунофлуоресцентного анализа и меньшая стоимость, чем Трис-буфера. Однако, в некоторых случаях PBS увеличивает неспецифическое окрашивание и может снижать специфичность некоторых антител (например, анти-CD30).
Советы по приготовлению и использованию промывочных буферов
•не рекомендуется использовать буферы по истечении срока годности, и смешивать старый и свежий растворы;
•не следует разводить реагенты более того, что указано производителем – при слишком сильном разведении может быть нарушена буферная емкость, ионная сила не будет оптимальной;
•на емкостях с растворами рекомендуется писать дату их приготовления, или когда они были распечатаны;
•нельзя смешивать разные типы буферов;
•для приготовления и разведения буферов следует использовать дистиллированную, деио-
низированную воду или воду высокой степени очитки. Не рекомендуется использовать проточную воду, так как в ней содержатся примеси металлов, неорганические ионы и другие примеси, которые могут взаимодействовать с иммуногистохимическими реагентами.
Усилители хромогенного сигнала для DAB
Хромоген DAB часто используется для визуализации продукта реакции в системах детекции, основанных на пероксидазе. Интенсивность реакции DAB, продукт которой обычно представляет
светло-коричневый преципитат, может быть усилена добавлением одного или смеси металлов. Добавление металла повышает осаждение продукта реакции DAB и придает осадку более темный цвет. Для этих целей используют медь, серебро, никель, золото и кобальт.
Осаждение металлами можно произвести непосредственно при реакции с DAB или отдельно, после обработки ткани DAB, после чего следует промыть ткань дистиллированной водой. Позднее применение предпочтительнее в тех случаях, когда необходим точный контроль интенсивности окрашивания; оптимальное время инкубации с «усилителями» окрашивания определяется эмпирически при контроле интенсивности осаждения хромогена (окрашивания) под микроскопом. Цвет
иинтенсивность конечного продукта реакции с DAB сильно зависит от использованного металла и концентрации его соли, но в большинстве случаев, обработанный преципитат интенсивнее окрашен
иболее выражен, чем необработанный (рис. 16.5). Так как соли металлов взаимодействуют только с продуктом реакции хромогена и пероксидазы, они не вносят значительного вклада в фоновое окрашивание. Время инкубации с осадителями должно определяться индивидуально в каждой лабора-
тории с учетом желаемого оттенка хромогена.
164 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 16 |
Оптимизация иммуногистохимических исследований |
|
|
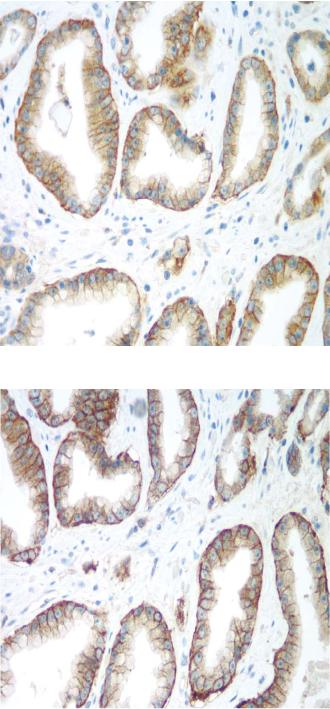
Рис. 16.5a. Стандартный хромоген DAB без усиления.
Рис. 16.5b. Стандартный DAB, инкубированный с Dako DAB Enhancer.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 165

Глава 17 | Фоновое окрашивание
Helle Grann Wendelboe MS и Kristen Bisgaard BSc
перевод Л.В. Москвиной
Фоновое окрашивание – одна из самых распространенных проблем в иммуногистохимии, что связано с появлением новых иммуноферментных методов обработки гистологических образцов и
повышением чувствительности систем детекции. Фоновое окрашивание образцов ткани может быть обусловлено несколькими факторами, одни из которых специфичны для антител или систем иммунодетекции, другие носят общий характер. В этой главе используются такие термины, как «нежелательное специфическое окрашивание» – окрашивание, вызванное взаимодействием антител со специфическим эпитопом, – и «неспецифическое окрашивание», вызванное любым другим взаимодействием. Ниже описаны большинство причин фонового окрашивания, обусловленного антителами, методами детекции и общими факторами, а также предложены возможные пути решения этой проблемы.
Фоновое окрашивание, вызванное системами детекции
Иммунодетекция с использованием пероксидазы хрена
Активность эндогенной пероксидазы
В практических целях в иммуногистохимии активность эндогенной пероксидазы может быть определена как любая активность, приводящая к расщеплению H2O2. Эта активность свойственна большинству гемопротеинов, например, гемоглобину (эритроциты), миоглобину (мышечные клетки), цитохрому (моноциты, гранулоциты) и каталазам (печень и почки). Пероксидазная активность может выявляться в васкуляризированных областях тканей, в результате гемморагического пропитывания нефиксированной ткани.
Для подавления активности эндогенной пероксидазы в образцах тканей, фиксированных формалином, срез чаще всего инкубируют с 3% раствором H2O2 от пяти до десяти минут (рис. 17.1). Также применяется обработка ткани смесью метанола и перекиси водорода (11 частей 3% H2O2 и 4 части 100% CH3OH) в течение 20 минут, но этот метод не рекомендуется применять при выявлении поверхностных антигенов. В результате обработки метанолом, замороженные срезы могут слететь с предметного стекла. Активность эндогенной пероксидазы блокируется также при обработке смесью азида натрия и перекиси водорода [1]. В большинстве случаев при работе с тканью, фиксированной в формалине, активность эндогенной пероксидазы не влияет на интерпретацию специфического окрашивания. Если в ткани, фиксированной формалином, много кровь-содержащих элементов, то все же стоит провести блокирование активности эндогенной пероксидазы. Стоит также блокировать эндогенную пероксидазу при работе с выделенными клетками и замороженными срезами.
Для обработки образцов, содержащих много пероксидазы, можно использовать систему детекции, основанную на щелочной фосфатазе, а не на пероксидазе хрена, что позволит избежать
фонового окрашивания (рис. 17.1).
166 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 17 |
Фоновое окрашивание |
|
|
a |
b |
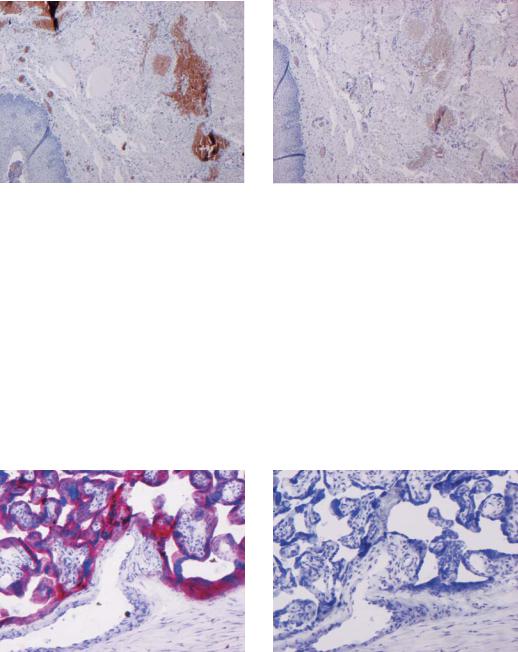
Рис. 17.1. Пероксидазная активность эритроцитов (a) до и (b) после обработки 3% раствором перекиси водорода,
иммунодетекция с помощью щелочной фосфатазы.
Эндогенная щелочная фосфатаза
Активность эндогенной щелочной фосфатазы высока в тонкой кишке, почках, остеобластах, эндотелиоцитах, нейтрофилах, стромальных ретикулярных клетках, лимфатической ткани, плаценте. При работе с замороженными срезами рекомендуется подавлять активность эндогенной щелочной фосфатазы, так как в свежей ткани она очень высока. Большинство форм щелочной фосфатазы можно блокировать, добавив в раствор субстрата хромогена 5 mM левамизоля (рис. 17.2). Щелочная фосфатаза тонкой кишки, как исключение, устойчива к такой обработке. Перед добавлением первичных антител эти срезы стоит обработать слабым раствором кислоты.
a |
b |
Рис. 17.2. Активность эндогенной щелочной фосфатазы в препарате плаценты до (a) и после (b) обработки среза
левамизолем.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 167
Фоновое окрашивание |
Глава 17 |
|
|
Двойное окрашивание
Комбинация эндогенной пероксидазы и щелочной фосфатазы
Двойное окрашивание с использованием этих ферментов требует блокирования эндогенной активности обоих. Для достижения хорошего результата рекомендуется использовать Н2О2 для блокирования эндогенной пероксидазы и слабую кислоту для щелочной фосфатазы. Строгой последовательности в обработке нет: методика работает не зависимо от выбора первого шага. Также можно использовать реагенты, одноэтапно блокирующие эндогенную активность обоих ферментов.
Биотин-стрептавидиновые методы иммунодетекции
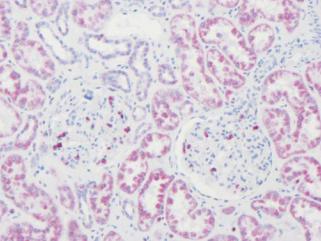
Эндогенная активность биотин-авидинового комплекса (EABA) регистрируется при использовании любой техники окрашивания, основанной на биотине, так как последний встречается во многих тканях. Биотин связан с ферментами и другими белками печени (гепатоциты), почек (эпителий канальцев) и лимфатических узлов (паракортикальные гистиоциты) (рис. 17.3). EABA обычно выявляется в цитоплазме, больше в замороженных срезах. Ткани, залитые в парафин, также сохраняют эндогенный биотин. Другие примеры EABA включают неиммунохимическое окрашивание миелина [2] и тучных клеток [3] (рис. 17.4) в замороженных и парафиновых срезах [3]. J.-I. Guesdon с соавт. [4] обнаружили EABA в гранулоцитах селезенки мыши.
EABA лучше всего подавляется последовательной обработкой срезов в течение 10-20 мин. перед окрашиванием: сначала 0,01-0,1% раствором авидина, затем 0,001-0,01% раствором биотина [5]. Молекула авидина имеет четыре сайта связывания с биотином, биотин может присоединить только одну молекулу авидина. В результате первого шага обработки срезов авидином, эндогенный биотин эффективно блокируется, вместе с тем в образце становится в три раза больше
сайтов связывания для биотина.
Это может привести к взаимодействию с антителами или системой детекции, обусловливая фоновое окрашивание. Вот почему важно блокировать эти дополнительные сайты связывания, инкубируя срез со свободным биотином.
Авидин – гликопротеин, на 10% состоящий из углеводов, имеет pl 10, – при физиологическом значении рН он связывается с лектиноподобными и отрицательно заряженными компонентами ткани.
Стрептавидин не содержит угле-
Рис. 17.3. Эндогенная экспрессия биотина в почке.
водов и имеет pl 5. Его применение
168 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
