
2 курс / Гистология / РУКОВОДСТВО_ИММУНОГИСТОХИМИЧЕСКИЕ_ММУНОГИСТОХИМИЧЕСКИЕ_МЕТОДЫ
.pdf
Глава 20 | Виртуальная микроскопия и анализ изображений
Kenneth J. Bloom MD (под редакцией Joachim Schmid PhD и Mark Verardo PhD)
перевод Л.В. Москвиной
Историческая справка
Автоматизация ручной микроскопии началась с первой телепатологической демонстрации в 1968 году. Развитие идеи шло по двум разным направлениям, одно из которых определялось технологическим прогрессом, другое – требованиями специалистов. Технологи использовали достижения разных областей науки, чтобы доказать возможность автоматизации морфологического исследования. Увеличение разрешения цифровых камер, скорости и точности, изобретение автоматизированных микроскопов, развитие интернета и стремительное развитие компьютерных технологий, в том числе увеличение скорости процессора, памяти и средств хранения информации, позволили разрушить барьеры на пути создания автоматической системы микроскопии. Другая группа сконцентрировалась на решении проблем патологической анатомии, таких как возможность быстрого получения заключения другого специалиста, решение проблем замороженных срезов, снижение себестоимости лабораторий их стандартизации, обучение студентов и ординаторов, непрерывное медицинское образование, облегчение системы хранения и поиска препаратов [1-7].
Концепция развития функциональной автоматизированной телепатологической сети с возможностью оценки в реальном времени замороженных срезов и трудных случаев была выдвинута Ronald Weinstein в середине 1980-х годов [8, 9]. Все выполненные исследования подтверждают возможность развития телепатологии, а специальный проект для министерства обороны США показал, как микропрепараты, приготовленные в El Passo (Texas), могут быть переданы через спутник и удаленно оценены в Armed Force Institute of Pathology в Washington (Columbia). Несмотря на то, что прототип был успешен, на пути коммерциализации системы стояло множество ограничений, большинство из которых сводилось к отсутствию телекоммуникационных систем и стандартов. Однако основной причиной было отсутствие необходимости в данной технологии. Так как не было финансовой выгоды в запуске передачи изображений через спутник, начались поиски более доступных вариантов, в качестве альтернативы была предложена идея «статической телепатологии». Идея статической телепатологии заключается с том, что врач при помощи фотокамеры, установленной на микроскопе, фотографирует и сохраняет изображение среза или серии срезов в цифровом виде, после чего через компьютер их можно отправить по электронной почте другому патологу. Доступность е-mail и других сервисов упростила передачу данных и способствовала разработке стандартов изображений, однако, статический характер изображения сильно ограничивал их практическое использование. Для полного представления стандартного микропрепарата требуется тысячи статических изображений, что делает метод неприменимым в практике. Однако, несмотря на то, что лишь немногие пользуются системой в диагно-
стических целях, она широко применяется для оценки краев опухолей, обучения и образования.
Следующим этапом развития технологии было создание программного обеспечения по «склеиванию» фотографий. Эта технология позволяет произвести цифровое представление всего микропрепарата, оцифровывая каждое поле зрения, собирая их в единый рисунок – виртуальный препарат.
Это был трудоемкий и затратный по времени процесс, лимитируемый развитием компьютерных техно-
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 189
Виртуальная микроскопия и анализ изображений |
Глава 20 |
|
|
логий и возможностями хранения информации. Из-за этих ограничений, следующая предложенная система содержала элементы статической и динамической телепатологии. Эта система оцифровывала весь препарат на небольшом увеличении, патолог выбирал интересующие его участки, после чего эти участки фотографировались на большем увеличении и передавались как статические изображения.
Сканирование микропрепарата
Первый шаг виртуальной микроскопии – оцифровка микропрепарата. Перед сканированием система должна определить фокальную плоскость. Сканируемое изображение или изображения сохраняются как двухмерный цифровой файл, в то время, как микропрепарат и срез имеют трехмерную структуру. При сканировании микропрепарата на малом увеличении (например, объектив х5) одной фокальной плоскости обычно хватает для передачи трехмерной структуры изображения, но при работе с большими увеличениями (например, х40) глубина резкости уменьшается, что требует постоянной фокусировки сканирующей системы на выбранном поле зрения. Все сканирующие системы имеют автофокусировку, но они все делают это немного по-разному. Вторую камеру можно установить на мониторе, что позволяет непрерывно приспосабливать фокусировку при сканировании микропрепарата. Кроме того, можно создать карту сканируемого среза, что позволит выбрать «точки фокусировки». После сканирования препарата, система наводит резкость в каждой выбранной точке фокусировки. Таким образом решается ряд проблем, например, различия в толщине ткани или складки препарата.
Процесс сканирования микропрепарата на разных системах также различается. Все технологии подразумевают получение изображения препарата в некоторой форме и склеивание этих
изображений, чтобы создать репрезентативный слайд. Некоторые системы непрерывно получают изображение, в то время как другие используют метод «линейного сканирования» или матрицу линз [10].
Системы сканирования в основном оцениваются по двум критериям: скорость и разрешение. Общая скорость сканирования изображения складывается не только из времени, затраченного на получение отдельных изображений, но может включать также временные затраты на склеивание снимков и сохранение конечного изображения на компьютере. С тех пор, как целью оцифровки микропрепаратов стала оценка их в будущем, часто предпринимается дополнительное действие для упрощения процесса просмотра. Например, для того, чтобы удовлетворять стандартам изображения с простого светового микроскопа, изображение должно быть отсканировано с увеличением стандартных объективов, а именно, 1х, 2,5х, 10х, 20х и/или 40х. Полагая, что препарат был отсканирован, смонтирован и сохранен в качестве, эквивалентном объективу 40х, просмотр изображения на об. 40х не потребует дополнительной обработки. Однако, при просмотре изображения, эквивалентного объективу 5х, перед выводом его на экран, необходимо конвертировать его из увеличения 40х. Это сопровождается огромной задержкой между выбором участка изображения и выводом его на экран. Чтобы избежать этой задержки, полученное изображение конвертируется в формат, в котором заранее просчитаны и сохранены средние степени увеличения изображения. Уменьшая временные
затраты на загрузку изображения среднего увеличения, данный формат, называемый пирамидальным
190 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 20
(pyramidal format), увеличивает
время обработки изображения, необходимое для получения изображения, и его размер [11].
Способность сканирующей системы предоставлять изображение, полностью совпадающее с микропрепаратом, называется точечным разрешением и зависит от объек тивов микроскопа, объективов фотоаппарата и системы оцифровки изобра-
жения. Более важным критерием является фактическое разрешение изображения, которое зависит от оборудования и архиватора изображения, видеокарты и монитора, на котором воспроизводится изображение. Например, многие коммерческие цифровые фотоаппараты имеют систему «очистки» изображения, делая края четче.
Демонстрация виртуальных препаратов
Виртуальный препарат – цифровое представление классического микропрепарата, который можно оценивать удаленно. В настоящее время нет утвержденных критериев демонстрации
виртуальных препаратов. У каждого продавца программного обеспечения есть программа для просмотра изображений, созданных по его технологиям. Все программные средства предоставляют схожие возможности: смену объектива, перемещение препарата в любом направлении,
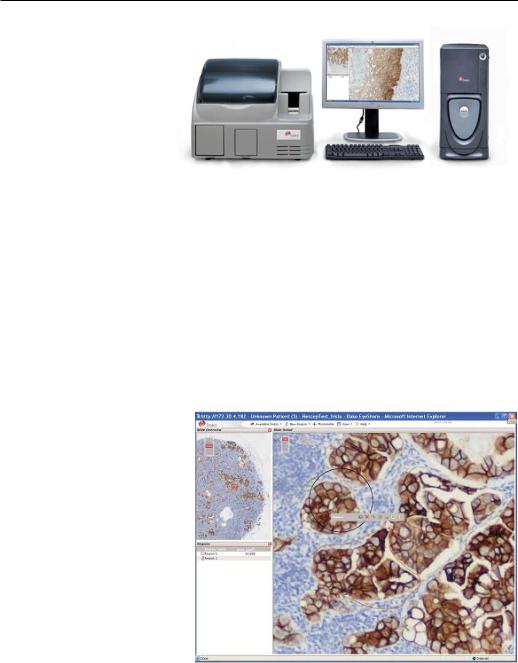
сохранение поля зрения в файл как изображения, аннотирование специфических участков препарата (рис. 20.2).
Рис. 20.2. Пример представления виртуального препарата в интернете.
Конкретно это изображение сделано при помощи программного
обеспечения EyeShare.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 191

Виртуальная микроскопия и анализ изображений |
Глава 20 |
Возможности применения виртуальной микроскопии в иммуногистохимии (список не ограничен перечисленным):
•анализ изображения;
•телепатология;
•получение быстрого консультативного ответа;
•образование;
•контроль качества.
Получение изображения для анализа
Требования, предъявляемые к системе для получения и анализа изображения, гораздо выше, чем к системе, только воспроизводящей. Так как изображение будет анализироваться, необходимо удостовериться, что полученное изображение воспроизводимо и что рабочий диапазон системы позволяет обнаружить анализируемое изображение. Например, если в изображении обнаружено какое-то количество белка HER2/neu, то это же изображение должно быть получено с препарата, отсканированного сегодня, завтра или шесть месяцев назад. Воспроизводимость таких изображений зависит от ряда факторов, среди которых то, как камера ведет себя с течением времени, колебания источника света и изменения в процессе оцифровки изображения. Кроме того, использование разных увеличений (объективов) может усложнить процесс. Чтобы избежать этих проблем, необходимо калибровать изображение стандартным образом.
Любой источник света может колебаться, уровень колебаний может быть настолько значительным, что потребуется ежедневная калибровка. Стоит позаботиться о создании такой калибровки, чтобы она не насыщала полностью какой-либо из каналов, так как насыщение канала может способствовать появлению ложного единообразия.
Системы анализа изображения перед использованием надо калибровать. Как минимум, калибровка должна проводиться по всем указанным ниже параметрам, и включать процедуры, позволяющие определить минимальное количество хромогена, которое можно определить; максимальное количество хромогена, которое можно определить перед насы-
щением сигнала; и поможет уста- Рис. 20.3. Пример кассеты с калибровочными образцами.
новить, что система может опре-
делять специфический хромоген
192 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Глава 20 |
|
Виртуальная микроскопия и анализ изображений |
||||
|
|
|
|
|
в линейной форме свыше заяв- |
|
|
|
|
|
|
ленного уровня. Это идентичная |
|
Качество |
|
Качество |
форма калибровки, по которой |
|||
окраски |
|
изображения |
налаживается оборудование в |
|||
|
|
|
|
|
отделении патоморфологии. |
|
|
|
|
|
|
||
|
|
|
|
|
Один из способов калибровки |
|
|
|
|
|
|
системы – использование набора |
|
|
|
Анализ |
|
контрольных препаратов, контро- |
||
|
|
изображения |
|
лирующих различные уровни кали- |
||
|
|
|
|
|
бровки. Пример кассеты с калибро- |
|
|
|
|
|
|
вочными образцами представлен |
|
|
|
|
|
|
на рис. 20.3. |
|
Выбор участка |
Алгоритм |
Система освещения препа- |
||||
рата обеспечивает неодина- |
||||||
препарата |
|
|
||||
|
|
ковое освещение разных стекол. |
||||
|
|
|
|
|
||
Рис. 20.4. Диаграмма, |
отражающая |
важность качества окраски, |
Если не сделать поправку на это, |
|||
результат оценки различных полей |
||||||
качества изображения, |
алгоритм и |
выбор области препарата для |
зрения будет разным. Система |
|||
анализа изображения. Объяснение в тексте. |
||||||
должна получить калибровочные |
||||||
|
|
|
|
|
||
|
|
|
|
|
изображения, которые заведомо |
|
|
|
|
|
|
стабильны, чисты (без пыли) и |
|
изображение пустого поля зрения, чтобы было достаточно данных для «адаптации» полученного изображения к плоскости. Так как калибровка изображений на разных увеличениях будет различаться, необходимо откалибровать каждый объектив.
Анализ изображения
Анализ изображения играет важную роль в стандартизации и интерпретации препаратов патологоанатомом [12]. Создать приложения для анализа изображения непросто. Перед использованием, система анализа изображения для клиники, как и фармакологический препарат, проходит процедуру валидации. Эти системы должны дополнять патологоанатома, а не замещать его. Соответственно, системы не должны пытаться соревноваться с патологом в том, что он может делать хорошо, а призваны помочь ему в тех моментах, которые не доступны человеческому глазу. Патологоанатом очень хорошо выбирает важные участки в микропрепарате, основываясь на морфологии ткани;
система анализа хорошо подсчитывает интенсивность сигнала и процент окрашенных структур.
Кроме того, нельзя преувеличить принцип «что посеешь, то и пожнешь». Нет смысла определять качество IHC препаратов, до тех пор, пока нет уверенности в воспроизводимости окрашивания. Автоматизация и стандартизация процесса приготовления IHC препаратов очень важна для успешного анализа изображения.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 193
Виртуальная микроскопия и анализ изображений |
Глава 20 |
|
|
|
|
Как показано на рис. 20.4, качество окраски, качество изображения, алгоритм и выбор области препарата – важные и необходимые составляющие оценки изображения. Качество окраски можно стандартизировать, используя автоматизированную систему окраски и установленный протокол. Специфическая предварительная обработка, качестенные антитела и стандартизированный протокол окрашивания – ключ к устойчивому результату. Стабильно воспроизводимое стандартизованное окрашивание необходимо для успешного анализа изображения: различия в окраске приводят к различиям в цифровых изображениях, что влияет на их анализ. О важности качества изображения сказано выше. Необходимо создать алгоритм, который дает результат, соответствующий созданному изображению окрашенных препаратов. Выбранная область препарата зависит от опыта патологоанатома. Области, которые необходимо оценить (такие как очаг опухоли). должны быть выбраны таким образом, чтобы они соответствовали патологии. Таким образом, систему анализа изображения следует рассматривать как помощь патологоанатому.
Обобщая сказанное, виртуальная микроскопия – важная новая технология, которая уже внедряется в образование патологов. После улучшения технологии, появится большое количество новых пользователей. Если серьезно подходить к анализу изображения, стоит уделить внимание выбору системы сбора данных, которая имеет калибраторы, подходящие для выполнения данного типа анализа [13].
Использование анализа изображений в морфологии
•определение уровня экспрессии Her2;
•определение уровня экспрессии ER/PR;
•определение плоидности ДНК;
•определение уровня экспрессии Ki67;
•определение уровня экспрессии p53.
Литература:
1.Demichelis F, Della Mea V, Forti S, Dalla Palma P, Beltrami CA. Digital Storage of glass sliders for quality assurance in histology and cytology // J Telemed Telecare. – 2002. – 8. – p. 138-42.
2.Harris T, Leaven T, Heidger P, Kreiter C, Duncan J, Dick F. Comparison of a virtual microscope laboratory to a regular microscope laboratory for teaching history. Anat Rec. – 2001. – 26 5. – p. 10-4.
3.Heidger PM Jr, Dee F, Consoer D, Leaven T, Duncan J, Kreiter C. integrated approach to teaching and testing in history with real and virtual imaging // Anat Rec. – 2002. – 26 9. – p. 107-12.
4.Helin H, Lundin M, Lundin J, Martikainen P, Tammela T. van der Kwast T, Isola J. Webbased virtual microscopy in teaching and standardizing Gleason grading. // Hum Pathol. – 2005. – 36. – p. 381-6.
5.Kumar RK, Velan GM, Korell SO, Kandara M, Dee FR, Wakefi eld D. Virtual microscopy for learning and assessment in pathology // J Pathol. – 2004. – 204.
– p. 613-8.
6.Marchevsky AM, Wan Y, Thomas P, Krishnan L, Evans-Simon H, Haber H. Virtual microscopy as a tool for profi ciency testing in cytology: a model using multiple digital images of Papanicolau tests // Arch Pathol Lab Med. – 2003. – 127. – p. 1320-4.
7.Okada DH, Binder SW, Felten CL, Strauss JS, Marchevsky AM. “Virtual microscopy” and the internet as telepathology consultations tools: diagnostic accuracy in evaluating melanocytic skin lesions // Am J Dermatopathol. – 1999. – 21. – p. 525-31.
8.Weinstein RS. Prospects for telepathology // Hum Pathol. – 1986. – 17. – p. 433-4.
194 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 20 |
Виртуальная микроскопия и анализ изображений |
|
|
9.Weinstein RS, Bloom KJ, Rozek LS. Telepathology and the networking of pathology diagnostic services // Arch Pathol Lab Med. – 1987. – 111. – p. 646-52.
10.Weinstein RS, Descour MR, Liang C, Barker G, Scott KM, Richter L, et al. An array microscope for ultrarapid virtual slide processing and telepathology. Design, fabrication, and validation Study // Hum Pathol. – 2004. – 35. – p. 1303-14.
11.Glatz-Krieger K, Glatz D, Mihatsch MJ. Virtual slides: high-quality demand, physical limitations, and affordability // Hum Pathol. – 2001. – 34. – p. 968-74.
12.Bloom K, Harrington D. Enhanced Accuracy and Reliability of HER-2/neu Immunohistochemical Scoring Using Digital Microscopy. // Am. J. Clin Pathol. – 2004. –121. – p. 620-630.
13.Glatz-Krieger K, Spornitz U, Spatz A, Mihatsch M, Glatz D. Factors to keep in mind when introducing virtual microscopy // Virchows Arch. – 2006. – 448. – p. 248-55.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 195

Глава 21 | Устранение неисправностей
Karen N Atwood и Dako Technical Support Group
перевод Л.В. Москвиной
Иммуногистохимия – сложный многошаговый процесс, требующий определенных навыков проводки ткани, выбора реагентов и интерпретации результатов окрашивания. В целом, техника IHC позволяет выявлять антигены путем последовательной инкубации ткани со специфическими антителами, вторичными антителами, ферментным комплексом и хромогеном-субстратом. Результатом ферментной активации хромогена является видимый продукт реакции в месте локализации антигена. Причины неожиданного отрицательного окрашивания или нежелательного фонового окрашивания могут быть трудно устранимы из-за сложной природы их образования. Информация, представленная в этой главе, позволит вам быстро уточнить и решить некоторые проблемы, возникающие при окраске тканей.
Впервом разделе рассмотрены самые распространенные проблемы, возникающие при работе
симмуногистохимическими реагентами, основные причины слабого окрашивания ткани и рекомендации по их устранению. Таблица содержит подразделы, посвященные слабому или отрицательному окрашиванию, тотальному и ограниченному фоновому окрашиванию.
Второй раздел описывает метод систематического введения одного IHC реагента для того, чтобы определить, на какой стадии окрашивания появляется неспецифическое или нежелательное окрашивание в пероксидазной или срептовидин-биотиновой системе.
Третий раздел представляет собой шаблон для ведения протокола окраски. Вы можете скопировать эту таблицу и использовать ее для решения ряда проблем, возникающих при окраске.
Четвертый раздел учит читать заводскую спецификацию IVD антител. Туда входит информация о способе фиксации ткани, рекомендуемая система визуализации, рекомендуемое разведение и растворитель антител, условия предварительной обработки ткани и необходимые контроли.
196 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Глава 21 |
Устранение неисправностей |
|
|
Первый раздел
Неадекватное окрашивание
Недостаточное или отрицательное окрашивание контрольных или диагностических образцов, кроме докрашивания (контрастирующего окрашивания).
Случаи недостаточного или отрицательного окрашивания.
Возможная причина |
Решение |
Страницы |
|
Не добавлены первичные анти- |
Повторите процедуру окраски, используя |
91-96 |
|
тела или меченные реагенты. |
инструкцию производителя системы окраски |
|
|
Неверная последовательность |
или стандартный протокол реакции, принятый |
|
|
применения реагентов. |
в лаборатории. |
|
|
|
|
|
|
Слишком разведенные или |
Определите верное разведение каждого |
24, 29, 30 |
|
слишком концентрированные |
реагента. В зависимости от результата окра- |
|
|
реагенты; |
несоблюдение |
шивания, если таковое имеется, допустимо |
|
времени или температуры инку- |
изменение разведения в 2-5 раз. Время и |
|
|
бации. |
|
температура инкубации находятся в обратно |
|
|
|
пропорциональной зависимости и влияют на |
|
|
|
результат окрашивания. Для того, чтобы подо- |
|
|
|
брать оптимальные условия инкубации ткани, |
|
|
|
меняйте как температуру, так и время инку- |
|
|
|
бации для каждого ИХГ реагента. Время инку- |
|
|
|
бации можно увеличить при отсутствии или |
|
|
|
слабом фоновом окрашивании. |
|
|
|
|
|
Неверно подобранный буфер |
Проверьте формулу и совместимость раство- |
91-96 |
|
для разведения первичных |
рителя для антител. Ионная сила и/или рН |
|
|
антител. Использование PBS |
растворителя антител может привести к |
|
|
или TBS |
для разведения |
уменьшению чувствительности антитела. |
|
первичных антител. Потеря |
Следует избегать добавления NaCl. В первую |
|
|
стабилизирующих белков |
очередь, проблема актуальна для монокло- |
|
|
и белков - пе рен о с чиков. |
нальных антител. |
|
|
Детергенты в растворителях. |
|
|
|
|
|
|
|
Некачественные первичные |
Замените неработающее или просроченное анти- |
24-25 |
|
антитела; некачественный один |
тело; повторите процедуру окраски, заменив |
|
|
или несколько вторичных или |
один из реагентов свежим, годным. |
|
|
вспомогательных реагентов. Не |
• Соблюдайте условия хранения реагентов, ука- |
|
|
используйте реагенты по исте- |
занные в описании или на упаковке. |
|
|
чении срока годности, указан- |
• При использовании чистых или концентрирован- |
|
|
ного на флаконе. |
ных антител, которые надо хранить в заморо- |
|
|
|
|
женном виде, важно предотвратить их повтор- |
|
|
|
ное размораживание и замораживание. |
|
|
|
• Замороженные реагенты храните при темпера- |
|
|
|
туре от -70°С до -80°С или используйте обычные |
|
|
|
морозильники с температурой -20°С. Ненамер- |
|
|
|
зающие морозильники работают циклами, и вы- |
|
|
|
ключаются, в результате чего антитела могут |
|
|
|
повредиться. |
|
|
|
• Не замораживайте готовые к использованию |
|
|
|
или разведенные антитела. |
|
|
|
• Следуйте рекомендациям производителя реа- |
|
|
|
гентов, приведенным в сопроводительной лите- |
|
|
|
ратуре или на упаковке. |
|
|
|
|
|
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 197

Устранение неисправностей |
|
|
Глава 21 |
|
|
|
|
|
|
Возможная причина |
|
Решение |
Страницы |
|
Д и с с оц иац ия первичных |
|
Причины низкой аффинности антител: |
|
|
|
22, 23 |
|||
антител во время промывки или |
|
• Поликлональная первичная иммунная |
|
|
инкубации с меченными анти- |
|
сыворотка: попробовать слабое разведение |
|
|
телами. |
|
|
для окраски. |
|
|
|
|
• Моноклональные первичные антитела: |
|
|
|
|
заменить антитела на более аффинные при той |
|
|
|
|
же специфичности. |
|
|
|
|
• Подобрать новое время инкубации для |
|
|
|
|
меченных антител и просывочного буфера. |
|
|
|
|
|
|
Использование |
алкоголь- |
|
• Повторите процедуру окраски, используя во- |
34-35 |
содержащих красителей для |
|
дный краситель и бальзам. |
|
|
докрашивания препаратов или |
|
|
||
|
• Используйте стойкий хромоген, такой как DAB/ |
|
||
алкоголь-содержащих баль- |
|
|
||
|
DAB+, который не зависит от органических рас- |
|
||
замов для заключения среза под |
|
|
||
покровное стекло в сочетании |
|
творителей. |
|
|
с хромогеном на водной основе. |
|
|
|
|
|
|
|
|
|
Слишком выраженное докра- |
|
Используйте дополнительные красители, которые |
166-176 |
|
шивание может ухудшить инре- |
|
• Не слишком интенсивно окрашивают срез. |
|
|
претацию результата. |
|
• Можно развести, чтобы они не перебивали спец- |
|
|
|
|
|
ифический сигнал. |
|
|
|
|
• Уменьшите время окрашивания в дополнитель- |
|
|
|
|
ном красителе. |
|
|
|
|
|
|
Неправильное приготовление |
|
• Повторите обработку правильно приготовлен- |
Специ- |
|
смеси хромоген-субстрат. |
|
ным хромогеном-субстратом. |
фикация |
|
|
|
|
|
|
|
|
|
• Интенсивность окрашивания возрастает, если |
|
|
|
|
рабочий реагент содержит DAB/DAB+. |
|
|
|
|
|
|
Использование |
несовме - |
|
Проверьте совместимость ингредиентов буфера с |
91-96 |
стимого буфера для приго- |
|
ферментом и субстрат-хромогеном. |
|
|
товления смеси фермента и |
|
• Повторите окрашивание. |
|
|
хромоген-субстрата: |
|
• Коммерческий фосфатный буфер может содер- |
|
|
Использование PBS промывоч- |
|
жать добавки, снижающие активность щелочной |
|
|
|
фосфатазы. |
|
||
ного буфера в системе окраски |
|
|
||
|
• Избегайте присутствия азида натрия в раство- |
|
||
щелочной фосфатазой. |
|
|
||
|
рителях и буферах. Концентрация азида натрия |
|
||
|
|
|
|
|
Использование азида натрия |
|
15mM/л, который обычно добавляется в IHC рас- |
|
|
для разведения или в качестве |
|
творы для подавления роста бактерий, не осла- |
|
|
буферного раствора в имммуно- |
|
бит метку, конъюгированную с HRP. |
|
|
пероксидазном методе. |
|
|
|
|
|
|
|
|
|
Уровень антигена слишком мал |
|
• Используйте более чувствительную систему де- |
91-96 |
|
для используемой системы |
|
текции. |
|
|
иммунодетекции. Это может |
|
|
||
|
• Увеличьте время инкубации первичных антител. |
|
||
быть вызвано потерей анти- |
|
|
||
|
• Проверьте время инкубации и разведения вспо- |
|
||
геных детерминант в некоторых |
|
|
||
опухолях или снижением анти- |
|
могательных реагентов. |
|
|
генности из-за неоптимальной |
|
• Измените способ демаскировки антигенов, если |
|
|
фиксации ткани. |
|
|
|
|
|
|
это допустимо, применив различные значения |
|
|
|
|
|
|
|
|
|
|
рН. |
|
|
|
|
|
|
Пространственные помехи, |
|
Проверьте концентрации первичных антител и |
166-176 |
|
обусловленные |
высоким |
|
вспомогательных реагентов. Возможно, слишком |
|
уровнем антигена и, возможно, |
|
высокая концентрация первичных антител. |
|
|
эффектом прозоны. |
|
|
|
|
|
|
|
|
|
198 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
