
2 курс / Гистология / РУКОВОДСТВО_ИММУНОГИСТОХИМИЧЕСКИЕ_ММУНОГИСТОХИМИЧЕСКИЕ_МЕТОДЫ
.pdf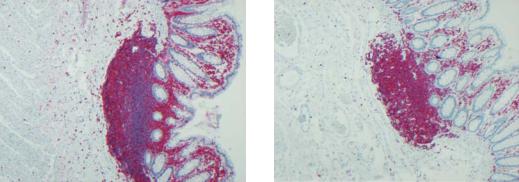
Глава 17 |
Фоновое окрашивание |
|
|
a |
b |
Рис. 17.4. Авидин-биотиновый комплекс, выявляемый в тучных клетках подслизистого слоя до (a) и после (b)
блокирования эндогенной авидин-связывающей активности.
в IHC практически решило эту проблему. Лектиноподобные элементы можно блокировать раствором сахарозы. Во многих коммерческих авидиновых системах детекции содержится модифицированный авидин, что позволяет значительно снизить неспецифическое окрашивание.
Полимерные системы иммунодетекции
Применение полимерных систем детекции позволяет полностью избавиться от авидинбиотинового фонового окрашивания. Однако, при недостаточной отмывке срезов после инкубации с полимером может возникнуть равномерное фоновое окрашивание. Из-за больших размеров конъюгатов полимеров, степень их диффузии ниже, чем низкомолекулярных конъюгатов. Стоит сказать, что конъюгаты полимеров с гидрофобным скелетом плохо отмываются. Чтобы этого избежать, можно увеличить время и количество промывок, добавить к раствору промывочного буфера детергент.
Демаскировка антигенов
Опубликованы данные о возможности контроля цитоплазматического и ядерного «шума» при иммуногистохимических процедурах [6]. Возможным объяснением может быть влияние демаскировки антигенов на связывание антигена с антителом, что влияет на взаимодействие антител с белками ткани. Различные типы растворов для демаскировки антигенов отличаются типом буфера, рН и хелатирующей способностью. Цитратный буфер рН 6.0, TRIS/EDTA рН 9.0 и TRIS рН 6.0 различаются способом влияния на связывание антител с антигеном. Время демаскировки
также влияет на связывание антитела с антигеном, поэтому для новых антител необходимо подбирать оптимальные условия демаскировки (тип раствора и время обработки) для снижения фонового окрашивания.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 169
Фоновое окрашивание |
Глава 17 |
|
|
Общие факторы
Диффузия антигенов
Нежелательное специфическое фоновое окрашивание может быть обусловлено диффузией маркера из места синтеза или накопления в окружающие ткани. Так как многие фиксаторы медленно проникают в ткань, важно фиксировать образцы ткани минимально возможного размера и делать это быстро. В противном случае антигены могут фиксироваться неправильно, при дальнейшей обработке возможна их дислокация. Чаще диффундируют внеклеточные и низкомолекулярные антигены, чем высокомолекулярные.
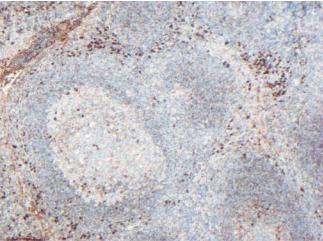
Рис. 17.5. Нежелательное окрашивание белков плазмы антителами к легким κ−цепям. Специфическое окрашивание плазматических клеток.
Типичный пример – диффузия тиреоглобулина из эпителия и просвета фолликулов щитовидной железы в соседние ткани. Схожее фоновое окрашивание наблюдается в случае высокой концентрации выявляемого антигена в плазме при пропитывании тканей перед фиксацией. Это можно наблюдать, например, при окрашивании ткани миндалины антителами к тяжелым и легким цепям иммуноглобулинов (рис. 17.5), особенно при недостаточной отмывке антител и неверном разведении сыворотки.
Причиной специфического фонового окрашивания может быть и фагоцитоз антигенов клетками, в результате чего метки обнаруживается в нехарактерных клетках.
Естественные и контаминированные антитела
Натуральные антитела
В результате антигенной стимуляции окружающей среды, иммунная сыворотка содержит низкий уровень естественных антител, который можно повысить при помощи иммунизации сывороткой, содержащей адъюванты. Вследствие этого, они могут повышать неспецифическое окрашивание. В 1979 году М.Osborn с соавт. [7] сообщил, что сыворотка неиммунизированных кроликов и коз, но не морских свинок, содержит естественные антитела к кератинам, что может быть примером специфического фонового окрашивания эпителия, обусловленного естественными антителами. Тоже было подтверждено и другими исследователями, попытки удаления этих антител из иммунной сыворотки были неудачными [8].
170 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 17 |
Фоновое окрашивание |
|
|
Большинство естественных антител не преципитируют и присутствуют в сыворотке в относительно малой концентрации, потому, при достаточном разведении сыворотки или небольшом времени инкубации с тканью, они обычно не реагируют с антигенами.
Контаминирующие антитела
Выделенные антигены, применяемые для иммунизации, редко бывают абсолютно чистыми. В том случае, если организм хозяина прореагирует с примесями, образуются загрязненные антитела.
Однако, так как титр специфических антител в соответствующем разведении обычно выше титра примесей, последние обычно не влияют на интерпретацию результатов IHC реакции.
Примеси антител могут быть обусловлены инфекционным агентом, смешением антигенов разных животных (через использование грязной посуды) или переносчиком белка, используемом для иммунизации. Эти антитела могут быть результатом взаимодействия сыворотки и с синтетическим белком. Малые белки не проявляют антигенных свойств и для иммунизации организма должны объединяться с белками-переносчиками. Иммунная сыворотка, выделенная после такой иммунизации, будет содержать антитела к комплексу антиген-переносчик.
Однако, если «посторонние» антитела взаимодействуют со специфическими, чувствительность абсорбции иммунной сыворотки обычно достаточна. Иммунная сыворотка «абсорбер периодического действия» почти всегда содержит небольшое количество примесей антител (большинство из них неприципитирующие), которые обусловливают неспецифическое окрашивание ткани, если используются в слишком больших концентрациях [8].
Неспецифические антитела можно выявить только при помощи мониторинга и оценки резуль-
татов абсорбции с применением таких методов, как иммунодиффузия, иммуноэлектрофорез и ракетный иммуноэлектрофорез по Laurel. Эта проверка не может повысить специфичность иммунной сыворотки. Окончательный результат иммуноспецифичности должен демонстрироваться после приме-
нения названных методов и проведения проб с тканями.
Проблема примесей антител неактуальна, например, для сывороток, полученных из культуры ткани, но весьма важна при работе с антителами, полученными из асцитической жидкости.
Перекрестные реакции
Фоновое окрашивание, обусловленное перекрестным реагированием антител, может наблюдаться при взаимодействии таргетных эпитопов ткани с другими белками.
Типичные пример – применение неадсорбированной сыворотки к карциноэмбриональному анти-
гену, (CEA, carcinoembryonic antigen). Неспецифическое фоновое окрашивание может быть вызвано взаимодействием эпитопов CEA с нормальными белками ткани и антигенами крови. Для устранения фонового окрашивания в этом случае стоит тщательно адсорбировать антитела, а при использовании моноклональных антител – отслеживать нежелательные клоны.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 171
Фоновое окрашивание |
Глава 17 |
|
|
Неспецифические перекрестные взаимодействия антител со схожими или разнородными эпитопами одних антигенов также могут быть причиной фонового окрашивания. Это случается не часто и такого окрашивания можно избежать, используя сыворотку гипериммунизированных животных или тщательно выбирая клон.
Перекрестные взаимодействия антигенов в исследуемом образце – распространенная проблема при выполнении множественных окрасок. Часто этого можно избежать, применяя антитела высокой очистки, подтипы специфических антител или антитела к определенным сайтам связывания. Для получения большей информации по перекрестным взаимодействия – (см. главу 1, «Антитела»).
Fc рецепторы
Fc рецепторы (FcR) – семейство мембранных гликопротеинов с молекулярной массой 50-70 kD. Они составляют менее 1% от мембранных белков и чаще всего обнаруживаются на макрофагах и гранулоцитах. Также эти рецепторы присутствуют на В-клетках и некоторых Т-лимфоцитах. Собственное сродство FcR к мономеру IgG составляет около 1х106 – 1х108 М-1, сродство к иммунным комплексам IgG и полимерам выше. FcR присуща видовая и классовая/подклассовая специфичность. Например, FcR некоторых клеток человека связываются с моноклональными мышиными IgG2a и IgG3, но не с другими подклассами IgG [9]. Сыворотка козы не реагирует с FcR лейкоцитов человека [10].
Фоновое окрашивание, обусловленное FcR, чаще выявляется в замороженных срезах, цитоло-
гических мазках и материале, который был «слабо» зафиксирован. Этого можно избежать, используя фрагмент F(ab’)2 вместо молекулы IgG и тщательно проверяя антитела на моноклонольность.
Гидрофобные взаимодействия
В водной среде гидрофобные взаимодействия между макромолекулами возникают в том случае,
если сила поверхностного натяжения молекул ниже таковой для молекул воды (Van-Der-Waals взаимодействие). Эти взаимодействия могут быть межатомными и межмолекулярными и обусловливать нестабильность полярных структур макромолекул.
Гидрофобность, в той или иной степени, присуща всем белкам и обусловливается свойством боковых цепей ароматических аминокислот: фенилаланина, тирозина и триптофана. Из-за их слабого взаимодействия с молекулами воды, молекулы этих аминокислот стремятся выровняться одна к другой, чтобы вытеснить воду с поверхности молекулы. Так как гидрофобность – одно из основных свойств, поддерживающих третичную структуру белка, она обеспечивает стабильность иммунных комплексов и зависит от условий окружающей среды, может также существовать между разными молекулами белка.
Белки ткани
При фиксации тканей альдегид-содержащими составами (например, формалин или глутараль-
дегид), гидрофобность белков повышается. Повышение гидрофобности часто обусловлено взаимо-
172 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 17 |
Фоновое окрашивание |
|
|
действиями ε– и α-аминокислот белков ткани. Факторами, влияющими на такое взаимодействие, в первую очередь являются время фиксации, температура и рН. Изменение этих параметров может
повлечь за собой изменение перекрестных взаимодействий между белками ткани и повлиять на гидрофобность. Поэтому следует строго соблюдать оптимальный протокол фиксации. Элементы тканей, в которых наиболее выражено фоновое окрашивание, обусловленное гидрофобными и ионными взаимодействиями, как правило, относятся к соединительной ткани: ламинин коллагена, эластин, протеогликаны, а также плоские эпителии и жиры адипоцитов, если они не полностью вымыты при
проводке в ксилоле. Чрезмерное фоновое окрашивание, обусловленное слишком длительной фиксацией в формалине, можно снизить, обработав растворами Bouin, Zenker или B5 [11].
Антитела
Большинство белков сыворотки, к сожалению и иммуноглобулины, очень гидрофобны. Мышиные антитела подклассов IgG3 и IgG1 более гидрофобны, чем антитела подклассов IgG2 и IgG4. Более того, в результате некоторых этапов выделения IgG-антител образуются агрегаты, повышающие их гидрофобность. Скопление иммуноглобулинов также может увеличить их гидрофобность и привести к агрегации и полимеризации, что часто приводит к снижению или потере иммунореактивности. Одновременно с этим было показано, что неспецифическое фоновое окрашивание при применении поликлональной фракции IgG усиливается, по сравнению с фоном, характерным для применения неразделенной сыворотки [12].
Состав буфера для дилюэнта также может оказывать влияние на гидрофобные взаимодействия между моноклональными антителами IgG и белками ткани: при приближении рН дилюэнта к изоэлектрической точке антител, увеличивается сила гидрофобных взаимодействий. Чем ниже ионная сила дилюэнта, тем слабее гидрофобные взаимодействия. Приведенные ниже анионы и катионы расположены в порядке снижения их гидрофобного эффекта:
Анионы: PO43-, SO42-, Cl-, NO3-, SCN-
Катионы: NH4+, K+, Na+, Ca2+
Другой возможный метод снижения гидрофобных взаимодействий между тканью и реагирующим белком – добавление детергента, например Tween 20 или этиленгликоля, к раствору дилюэнта или повышение рН дилюэнта, но это применимо только для поликлональных антител.
Чаще всего для снижения фонового окрашивания, обусловленного гидрофобными взаимодействиями, используют растворы, блокирующие активность белков ткани (так называемый протеиновый блок), применяя их отдельным этапом реакции или добавляя в растворитель для антител. Однако, это работает только в том случае, если блокируемые белки могут полностью провзаимодействовать своими гидрофобными участками с IgG, его агрегатами или конъюгатами. Лучше всего производить отдельную инкубацию образца с раствором, содержащим протеиновый блок, непосредственно перед применением первичных антител. Раствор может содержать белки, идентичные тем, что присутствуют в растворе вторичных антител или меченых антител, но не первичных – во избе-
жание неспецифического связывания вторичных антител.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 173
Фоновое окрашивание |
Глава 17 |
|
|
Добавление к растворителю для первичных антител 1% раствора бычьего сывороточного альбумина (bovin serum albumin, BSA), пожалуй, самый распространенный способ снижения неспецифического фонового окрашивания, обусловленного гидрофобными взаимодействиями. Также для уменьшения фонового окрашивания может быть использовано нежирное сухое молоко [13] или казеин [14]. Казеин, добавленный в качестве протеинового блока в растворитель для первичных антител и в промывочный буфер, приводит к гораздо большему снижению неспецифического окрашивания, чем нормальная свиная или овечья сыворотка [14].
Так как сегодня используют различные биотинилированные антитела, стоит заметить, что биотинилизация может влиять на pl антител более, чем вышеозначенные пункты, например, если антитела имеют pl 8, то pl конъюгата составит менее пяти [15]. Это может отразиться на растворимости конъюгатов антител и повысить их гидрофобность.
Ионные и электростатические взаимодействия
Ионные взаимодействия играют важнейшую роль в регуляции иммунохимических взаимодействий между антигенами и соответствующими антителами. Однако, они могут обусловливать и неспецифическое фоновое окрашивание.
Изоэлектрическая точка большинства поликлональных IgG находится в пределах 5.8-8.5. При
физиологическом значении рН и большинства дилюэнтов, антитела могут иметь как отрицательный, так и положительный заряд на поверхности молекул. Можно ожидать ионные взаимодействия некоторых антител и белков ткани, так как во время процедуры иммунохимического окрашивания некоторые молекулы могут приобретать противоположный заряд. Показано, что отрицательно заряженные участки мембран эндотелия и коллагеновых волокон взаимодействуют с конъюгатами катионов кроличьих Fab фрагментов и пероксидазой хрена IV типа (pl 10.0) [16]. Взаимодействия ионного типа можно снизить, используя для разведения антител буферы с большей ионной силой. Добавление NaCl
к раствору буфера может снизить фоновое окрашивание, обусловленное ионным взаимодействием, но постоянное добавление NaCl к раствору дилюэнта для первичных антител не рекомендуется [17].
К сожалению, в большинстве случаев диффузное фоновое окрашивание обусловлено сочетанием ионных и гидрофобных взаимодействий. Компенсирование одного из них может усугубить другое.
Комплемент-обусловленное связывание
Связывание, обусловленное компонентами системы комплемента, может быть причиной фонового окрашивания в замороженных тканях при полном использовании иммунной сыворотки. Однако некоторые компоненты комплемента инактивируются, при увеличении времени между изготовлением сыворотки и ее применением.
Различные причины
Физическое повреждение ткани, высыхание до фиксации или неполная фиксация может стать
причиной диффузного фонового окрашивания всех или большинства элементов поврежденной
174 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 17 |
Фоновое окрашивание |
|
|
зоны. Схожее диффузное фоновое окрашивание, как среза, так и поверхности стекла, обычно ограниченное зоной нанесения первичных антител, может быть обусловлено остатками заливочной среды. В препаратах, смонтированных рутинным способом в водяной бане, содержащей примеси белка, например, желатин Knox или клей Elmer, может также обнаруживаться диффузное фоновое окрашивание, особенно при использовании высокочувствительных систем иммунодетекции. Жидкость в водяной бане не должна содержать бактериальных или иных примесей.
Можно столкнуться с неспецифическим окрашиванием, обусловленным остаточными гранулами хромогена.
Omata с соавт. отмечено неиммуное связывание пероксидазы хрена (как свободной формы, так и конъюгатов) с HbsAg в гепатоцитах [18]. Природа этого феномена не ясна.
Некротизированные участки тканей могут окрашиваться любыми реагентами. М.Nadji и A.R.Morаles [19] собрали великолепную коллекцию цветных иллюстраций фонового окрашивания с пояснениями.
Выраженное неспецифическое окрашивание может значительно затруднить интерпретацию специфического сигнала.
Общие положения
Так как фоновое окрашивание может быть обусловлено множеством вышеперечисленных факторов, важно использовать в работе качественные реагенты и придерживаться протокола, позволяющего избежать фона и неверного окрашивания. Многие поставщики реагентов для IHC предлагают системы растворов, которые представляют собой оптимально подобранные буферы, растворы для демаскировки антигенов, первичные антитела, системы детекции и субстраты, позволяющие автоматизировать процесс окраски и обеспечить оптимальное окрашивание. Несколько стран разрабо-
тали национальные программы качества, например, United Kingdom National External Quality Assesment Service (UK NEQAS) [20] и Nordic Immunohistichemical Quality Control (NordicQC) [21], направленные на привлечение внимания к проблеме качества и улучшения работы IHC лабораторий, в том числе и к снижению фонового окрашивания. Дополнительное обсуждение см. в главе 15, «Множественное иммуногистохимическое окрашивание». Информацию о национальных программах можно найти на соответствующих сайтах.
Литература:
1.Li C-Y et al // J Histochem Cytochem. – 1987. – 35. – p. 1457-60.
2.Sternberg LA and Sternberg NH // J Histochem Cytochem. – 1986. – 34. – p. 599-605.
3.Hsu S-M and Raine L. In DeLellis RA(ad). Advanced in Immunohistochemistry – New York: Masson, 1984.
– p. 31-42.
4.Guesdon J-L et al // J Histochem Cytochem. – 1979. –27. – p. 1131-9.
5.Wood GS and Warnkle R // J Histochem Cytochem. – 1981. –29. – p. 1196-204.
6.Wieczorek R et al // J. Histotech. – 1997. –20. – p. 139-43.
7.Osborn M et al // Proc Natl Acad Sci (USA) . – 1977. –74. – p. 2490-4.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 175
Фоновое окрашивание |
Глава 17 |
|
|
8.Conway de Macario E et al // J Immunol. – 1986. –90.
–p. 137-41.
9.Gadd J and Ashman LK // Clin Exp Immunol. – 1983. –54. – p. 811-8.
10.Alexander EL and Sanders SK // J Immunol. – 1977. –119. – p. 1084-8.
11.Caron BL and Banks PM // Lan Investig. – 1979. –40.
–p. 244-5.
12.Boenisch T. Unpublished observation.
13.Duhamel RC and Johnson DA // J Histochem Cytochem. – 1985. –7. – p. 711-14.
14.Tacha DA, McKinney LA // J Histotech. – 1992. –15.
–p. 127-2.
15.Wadsley JJ, Watt RM // J Immunol Meth. – 1987. –103.
–p. 1-7.
16.Pino RM // J Histochem Cytochem. – 1985. –33. – p. 55-8.
17.Boenisch T // Appl Immunohistichem. – 1999. –7(4).
–p. 300-6.
18.Omata et al // Am J Clin Pathol. – 1980. –5. – p. 626-32.
19.Nadji M, Morales AR. Immunoperoxidase Techniques: A Practical Approach to Tumor Diagnosis.
–Chicago: American Society of Clinical Pathologists. – 1986.
20.United Kingdom National External Quality Assessment Service (UK NEQAS): www.ukneqas.org.uk.
21.Nordic Immunohistochemical Quality Control (NordiQC): www.nordiqc.org.
176 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 18 Пептидные нуклеиновые кислоты: надежные технологии гибридизации зонда
David C. Spaulding PhD
перевод Л.В. Москвиной
Пептидные нуклеиновые кислоты, (Peptide nucleic acid, PNA) – артефакты синтеза полимеров, ответственных за специфическое взаимодействие ДНК и РНК. Как только стало известно об этой уникальной связывающей способности, PNA стали применяться в различных биомедицинских областях, в том числе в генетических исследованиях и экспериментальной терапии [1]. Эта глава посвящена диагностическому применению PNA, которое получило широкое распространение среди методов исследования в патологии, и другим перспективным направлениям применения этого метода.
В отличие от молекул ДНК и РНК, которые имеют жесткий каркас из повторяющихся участков
фосфорилированных сахаров, молекулы PNA построены из псевдопептидных N-фрагментов 2-амино- этилглицина, связанных пептидными мостиками, с которыми взаимодействуют пуриновые и пиримидиновые основания (специфические взаимодействия посредством карбонильных мостиков), связанные метиленовыми мостиками.
Самое частое применение молекул PNA – использование
вкачестве комплементарных последовательностей. Как и
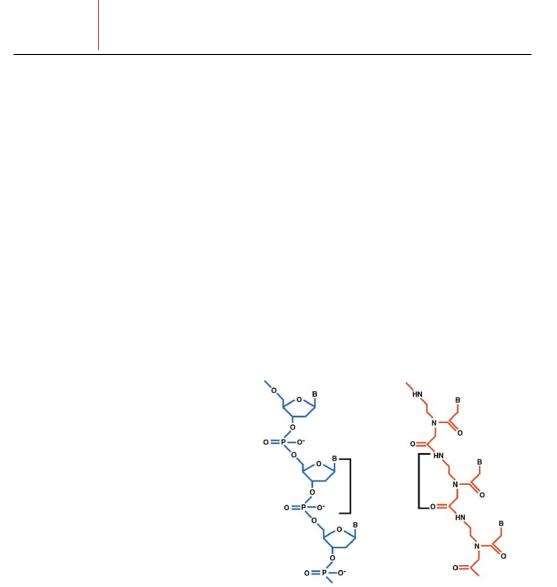
вслучае с другими нуклеиновыми кислотами, специфичность оснований PNA определяет специфичность связывания комплементарной ДНК и РНК последовательностей (рис. 18.1), но отсутствие заряда молекулы PNA – главное ее преимущество. Отсутствие отрицательного заряда, электростатических сил между традиционным праймером и комплементарным образцом, нейтральный скелет
PNA повышает афинность праймера и температурную устойчивость при удвоении таргетного праймера.
Повторяющиеся
фрагменты
Рис. 18.1. Принципиальная схема структуры ДНК и РНК. В отличие от отрицательно заряженного скелета природных нуклеиновых кислот (ДНК и РНК), синтетический псевдобелковый скелет PNA не имеет заряда. Электронейтральность молекул PNA обеспечивает большую энергию связывания (и соответственно, большую температуру плавления) комплементарных комплексов PNA-ДНК и PNA-РНК, чем ДНК-ДНК, ДНКРНК или PNA-PNA. В молекулу PNA можно ввести те же основания, что и в ДНК, обеспечивающие специфическое связывание пар нуклеотидов. B=пиримидиновое (T, C) или пуриновое (A, G) основание; H=водород; N=азот; O=кислород; P=фософор.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 177

Пептидные нуклеиновые кислоты |
Глава 18 |
|
|
Важнейший момент при разработке праймера – его специфичность. Физико-химические свойства PNA позволяют лучше регулировать специфичность. В испытаниях с традиционными ДНК или РНК праймерами селективность, обусловленная водородными связями между комплементарными основаниями праймера и таргетной последовательности, снижалась ионными взаимодействиями между отрицательно заряженными скелетами. Оптимизация параметров требовала тонкого баланса между такими параметрами, как температура гибридизации, концентрация праймера, длина праймера, G-C (гуанин-цитозин) соотношение, концентрация органических раство-
рителей и ионов, что усложняет исследование даже для опытных диагностов. Большая энергия связывания двухцепочечного PNA-зонда дает ему исследовательские преимущества. Высокая температура плавления ДНК-PNA пробы позволяет PNA-праймерам встраиваться, преодолевать многие сложные вторичные структуры в таргетной последовательности и запускать точную гибридизацию. Для снижения неспецифического связывания используются специальные условия
промывки. Большая афинность PNA-зондов позволяет использовать их в меньшей концентрации и меньшей длины, что снижает стоимость зонда и вероятность неспецифического связывания с субстратом исследования и компонентами биологического образца. Несоответствия PNA-ДНК спиралей более дестабилизированы, чем в соответствующих ДНК-ДНК спиралях, характеристика, которая позволяет PNA зондам различать отдельные свойства последовательности оснований, такие как количество мутаций и ядерный полиморфизм с большей селективностью, чем ДНК или РНК зонды (рис. 18.2).
Другое явное преимущество PNA зондов – их стабильность. Молекулы PNA более устойчивы как к нуклеазам, так и к протеазам в большем диапазоне рН, чем молекулы ДНК или РНК. Стабильность праймера особенно важна в диагностических установках с потенциально большой концентрацией ферментов, в таких ситуациях, как анализ недостаточно обработанного образца или исследование новых областей применения. Устойчивость PNA позволяет упростить методику быстрой диагностики, которая объединяет PNA праймеры с другими компонентами иссле-
дования, для уменьшения количества этапов реакции в процедуре анализа.
178 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
