
2 курс / Гистология / РУКОВОДСТВО_ИММУНОГИСТОХИМИЧЕСКИЕ_ММУНОГИСТОХИМИЧЕСКИЕ_МЕТОДЫ
.pdf
Глава 10 |
Иммунофлюоресценция |
|
|
|
|
сдвиг Stokes
Интенсивность свечения
|
Длина волны (нм) |
Пик поглощения = 495 нм |
Пик излучения = 520 нм |
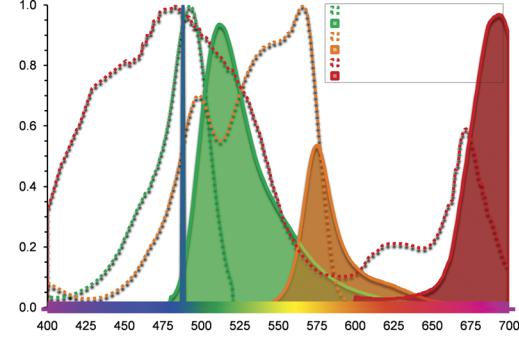
Рис. 10.4. Спектры поглощения и излучения флюоресцина. При возбуждении молекулы флюоресцина светом с длиной волны, отличной от его пика поглощения (470 нм на этом примере), высота кривой излучения (темнозеленая) остается той же, но относительная интенсивность снижается. Эффективность возбуждения при 470 нм составляет 45% от пикового возбуждения.
чество энергии в виде тепла, а оставшуюся экстраэнергию излучает в виде фотона. Излученная при флуоресценции энергия меньше, чем энергия поглощенного света, поэтому длина волны излученного света больше, чем света возбуждающего (кроме случаев мультифотонного возбуждения).
Электроны флюорохрома возбуждаются определенным спектром длин волн падающего света. Например, флюоресцин светится при возбуждении светом любой длины волны от 450 нм до 520 нм. Однако, чем ближе длина волны возбуждающего света к 495 нм, тем сильнее будет флюоресценция.
Эта оптимальная длина волны названа пиком возбуждения. Свет, изучаемый флюорохромом, также имеет определенный спектр длин волн. Световая эмиссия флюоресцина варьирует от 490 нм до 630 нм и эмиссионный пик находится в районе 515 нм. С тех пор, как феномен флюоресценции впервые был объяснен британским ученым G.Stokes в 1852 году, сдвиг длин волн от коротких к длинным во
время флюоресценции называется «сдвигом Stokes» (рис. 10.4).
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 99
Иммунофлюоресценция |
Глава 10 |
|
|
Спектр поглощения FITK
Спектр излучения FITK при 488 нм Спектр поглощения РЕ Спектр излучения РЕ при 488 нм
Спектр поглощения РerCP-Cy5.5
Спектр излучения РerCP-Cy5.5 при 488 нм
Интенсивность свечения
Длина волны (нм)
Рис. 10.5. Возбуждение трех спектрально различных флюорохромов с использованием одной длины волны лазера.
Одни флюорохромы имеют маленькую величину сдвига Stokes, другие значительную. Например, флюорохром флюоресцин может быть возбужден сине-зеленым светом, а его сдвиг Stokes состав-
ляет всего 20 нм, это означает, что излученный свет будет зеленым. Существует другой флюорохром – фикоэритрин, который также может быть возбужден сине-зеленым светом, однако он имеет значительный сдвиг Stokes. Таким образом, излученный им свет будет желто-оранжевым. При иммунофлюоресценции несколько флюорохромов могут быть возбуждены светом одной длины волны, и, если они имеют разную величину сдвига Stokes, получится разноцветная флюоресцентная картина (рис. 10.5).
На рис. 10.5 три различных флюорохрома были возбуждены светом одной длины волны 488 нм (синяя линия). Спектры поглощения данных флюорохромов обозначены пунктиром слева от синей линии. Каждый флюорохром был возбужден с различной эффективностью и, следовательно, излучение будет различной интенсивности при эквивалентных концентрациях флюорохромов. Знание спектров поглощения и излучения флюорохромов дает возможность выбирать комбинации красителей, которые используются совместно. Однако для того, чтобы флюорохром был полезен, для исследования он должен быть соединен в виде метки или содержаться внутри структуры, имеющей биологическую значимость.
100 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 10 |
Иммунофлюоресценция |
|
|
Флюорохромы могут быть конъюгированы с антителами, которые затем свяжут их со специфическими структурами внутри или вне клетки. Ценность флюорохрома для биологических исследований определяется его многими химическими и физическими свойствами. Например, некоторые флюорохромы, связывающиеся с ДНК, например Hoechst 33342, могут проникать в живые клетки, в то время как большинство таких флюорохромов не могут преодолеть клеточную мембрану. Те флуоресцентные красители, которые не могут проникнуть через интактную клеточную мембрану, например пропидиум йодид (PI), часто используются для определения жизнеспособности клеток.
Идеальным флюорохромом будет молекула со следующими характеристиками:
•Пик абсорбции должен быть в пределах возбуждающей длины волны, доступной для детекции лабораторным оборудованием (большой коэффициент угасания = торможения при возбуждающей длине волны).
•Яркая флюоресценция (высокий квантовый выход).
•Узкий эмиссионный спектр, который попадает в спектр, обнаруживаемый оборудованием.
•Хорошая фотостабильность (на свету).
•Флюоресцентные свойства не меняются, в зависимости от конъюгации с антителом или локального окружения образца.
Ограничения при иммунофлюоресценции
Фотообесцвечивание
Как при большин- |
|
|
|
|
стве флуоресцентных |
|
|
|
|
методов, значительной |
|
|
|
|
проблемой иммунофлю- |
|
|
|
|
оресценции является |
|
|
|
|
фотообесцвечивание |
|
(синий) |
|
|
(и фототоксичность). |
|
|
|
|
|
|
|
|
|
Фотообесцвечивание – |
Энергия |
Поглощение |
|
|
это процесс фотохи- |
|
|
||
|
|
|
|
|
мического разрушения |
|
|
Флюоресцентное |
Фосфоресценция |
флюорофора вслед- |
|
|
излучение (зеленый) |
|
|
|
|
||
|
|
|
|
|
ствие синтеза активных |
|
|
Базовое энергетическое состояние |
|
|
|
|
|
|
форм кислорода в |
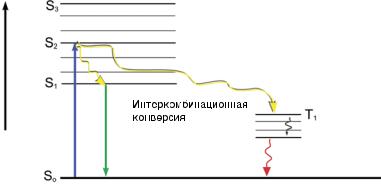
Рис. 10.6. Иллюстрация перехода кислорода из синглетного возбужденного |
|||
|
||||
образце, как побочного |
состояния в триплетное. |
|
|
|
продукта флюоресцент- |
|
|
|
|
ного возбуждения (рис. 10.6). Несмотря на то, что точный механизм фотообесцвечивания неизве-
стен, полагают, что первичной причиной является фотосенсибилизация синглетного кислорода (1О2)
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 101
Иммунофлюоресценция |
|
|
|
|
|
Глава 10 |
||
|
|
|
|
|
|
|
|
|
(см. словарь) и его переход в тройное возбуж- |
|
|
|
|
|
|
|
|
денное состояние [4]. Фотообесцвечивание |
|
|
|
|
|
|
|
|
может быть снижено с помощью: (а) снижения |
|
|
|
|
|
|
|
|
интенсивности и длительности воздействия |
|
|
|
|
|
|
|
|
возбуждающего света, (b) снижение доступ- |
|
|
|
|
|
|
|
|
ности синглетного кислорода (1О ) путем добав- |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
ления акцепторов синглетного кислорода |
|
|
|
|
|
|
|
|
(антиобесцвечивающий реагент) и (с) исполь- |
|
|
|
|
|
|
|
|
зования низкой концентрации флюорохрома с |
|
|
|
|
|
|
|
|
высоким квантовым выходом. |
|
|
|
|
|
|
|
|
Аутофлюоресценция |
|
|
|
|
|
|
|
|
Биологическая аутофлюоресценция в |
|
|
|
|
|
|
|
|
клетках млекопитающих (рис. 10.7) в резуль- |
|
|
|
|
|
|
|
|
тате свечения флавиновых коферментов (FAD |
|
|
|
|
|
|
|
|
и FMN: абсорбция – 450 нм; эмиссия – 515 нм) |
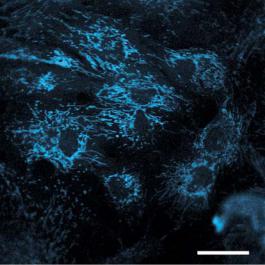
Рис. |
10.7. |
Аутофлюоресценция |
NADH |
в |
клетках |
||
линии |
карциномы кишечника |
человека |
(HCT116). Для |
|||||
или восстановленных пиридиновых нукле- |
||||||||
возбуждения |
использовался |
свет |
УФ части |
спектра |
||||
отидов (NADH: абсорбция – 340 нм; эмиссия |
||||||||
с длиной волны 363 нм, длина волны излученного |
||||||||
|
||||||||
– 460 нм) проблематична в обнаружении при |
флуоресцентного света – более 440 нм. Шкала 10 мкм. |
|||||||
анализе образцов тканей и клеток. Фиксация |
[Giselle M. Knudsen, Department of Medicinal Chemistry and |
|||||||
в альдегидах, особенно в глютаральдегиде, |
Molecular Pharmacology, Purdue University, West Lafayette, |
|||||||
IN, USA].
значительно повышает уровень аутофлюоресценции. С другой стороны, он может быть снижен на зафиксированном образце путем
промывки 0,1% раствором борогидрида натрия в фосфатно-соляном буфере [5] перед инкубацией
с антителом. Проблемы, связанные с аутофлюоресценцией, можно упростить путем отбора проб и оптических фильтров, которые увеличивают соотношение между флюоресценцентным сигналом и аутофлюоресценцией. К другим факторам, ограничивающим использование IF, относятся характеристики детектирующего прибора (насколько хорошо микроскоп откалиброван и настроен), специфичность антител и подготовка препаратов.
Перекрытие флюоресценции
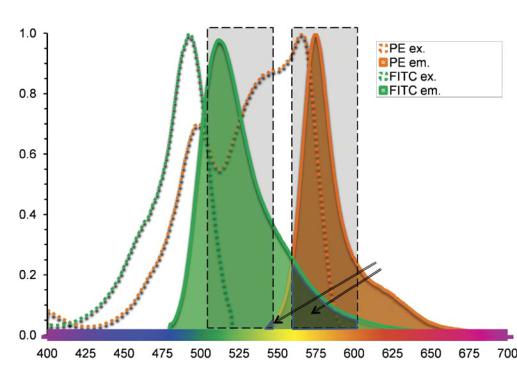
Одной из проблем, с которой сталкиваются при измерении флюоресценции при использовании более, чем одного цвета, является возможность перекрытия излучаемых сигналов. Необходимо убрать перекрывающийся сигнал, в противном случае он даст ложный уровень одного или более цветов. Например, как показано на рис. 10.8., существует значительное перекрытие сигнала при совместном использовании флюорохромов FITC и РЕ. В каждый канал детекции собирается определенный диапазон длин волн (обозначен пунктиром), они обозначаются как диапазон детекции флюо-
ресцина (FITC) и диапазон детекции РЕ. В приборе используются полосно-пропускающие (полосовые)
102 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 10 |
Иммунофлюоресценция |
|
|
Диапазон |
|
детекции |
Диапазон |
FITС |
детекции PE |
Интенсивность свечения
Длина волны (нм)
Рис. 10.8. Флюоресцентное перекрытие флюорохромов FITC и РЕ.
Область перекрытия
фильтры, которые позволят фотонам внутри диапазона длин волн попадать в детектор. Однако, существует небольшое количество флюоресценции РЕ внутри FITC полосы, а также небольшое количество FITC флюоресценции внутри полосы РЕ. Это должно быть устранено электронным путем или же измерения каждого из флюорохромов будут выше настоящего сигнала. Этот процесс называется компенсацией флюоресценции и может быть автоматически выполнен во многих системах детекции, использующих изолированные положительные контроли.
Применение иммунофлюоресценции в патологии
Существуют следующие способы практического применения IF в патологии:
•Анализ антигенов в свежих, свежезамороженных и фиксированных образцах ткани; субклеточная локализация антигенов в монослое культуры клеток; изучение бактериальных или паразитарных образцов.
•Обнаружение и локализация присутствия или отсутствия специфических последователь-
ностей ДНК в хромосомах.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 103
Иммунофлюоресценция |
Глава 10 |
|
|
•Определение пространственно-временных характеристик экспрессии генов в клетках или тканях.
Наиболее частым методом IF, используемым в патологии, является непрямая IF. Однако в специальных случаях используется прямая IF, например для локализации IgG в иммунных комплексах вдоль границы эпидермис-дерма на материале биопсий кожи от пациентов, страдающих системной красной волчанкой [6].
Таким образом, иммунофлюоресценция – это визуализация антигенов внутри клеток с использованием антител, как флюоресцентных проб. Эта техника имеет множество преимуществ и доказала свою эффективность в определении расположения известных антигенов в клетках или лока-
лизации специфических последовательностей ДНК на хромосомах. Эта техника совмещает в себе высокую чувствительность с высоким разрешением при визуализации антигенов и будет одним из главных способов исследования на многие годы вперед, так что ни один патолог, изучающий клетки или молекулы, не сможет ее игнорировать.
Описание подробной методики иммунофлюоресценции на фиксированных формалином и залитых в парафин образцах см. D.Robertson et al [7].
Литература:
1.Coons AH, et al. Immunological properties of an antibody containing a fl uorescent group // Proc Soc Exp Biol Med. – 1941. – 47. – p. 200-202.
2.Coons AH and Kaplan MH. Localization of antigen in tissue cells. II. Improvements in a method for the detection of antigen by means of fl uorescent antibody // Journal of Exp Med. – 1950. – 91. – p. 1.
3.Weber K, et al. Specifi c visualization of tubulin-con- taining structures in tissue culture cells by immunofl uorescence. Cytoplasmic microtubules, vinblastineinduced paracrystals and mitotic fi gures // Exp Cell Res. – 1975. – 95. – p. 111-120.
4.Johnson ID. Practical considerations in the selection and application of fl uorescent probes // In: Handbook of biological confocal microscopy, 3rd ed. (J.B. Pawley. Ed). – New York: Plenum Press, 2006. – p. 362363.
5.Bacallao R, et al. Guiding principles of specimen preservation for confocal f l uorescence microscopy // In: Handbook of biological confocal microscopy, 3rd ed. (J.B. Pawley. Ed). – New York: Plenum Press, 2006.
– p. 368-80.
6.Jennette JC and Wick MR. Immunohistochemical techniques // In “Immunohistology in diagnostic pathology”, (Jennette JC. Ed) . – Boca Raton, FL, USA: CRC Press, 1988. – p. 1-29.
7.Robertson D, et al. Multiple immunofl uorescence labeling of formalin-fi xed paraffin-embedded (FFPE) tissue // BMC Cell Biology. – 2008. – 9. – p. 13.
104 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Глава 11 FISH-анализ на материале, фиксированном формалином и залитом в парафин
Sven Muller PhD, Steen H. Matthiesen PhD, Kirsten V. Nielsen MS
перевод Н.В. Даниловой
Анализ опухолевых тканей с помощью флюоресцентной in situ гибридизации (FISH) – прочно уста-
новившийся метод для идентификации генетических аббераций, таких как изменение количества копий гена или транслокация. Метод использовался как исследовательский инструмент в течение более 20 лет и, благодаря прогностической и предсказательной ценности некоторых FISH-маркеров, таких как ТОР2А и HER2, был внедрен в клиническую практику.
В клинической патологии возможность количественного анализа результатов FISH сделала этот метод ценным дополнением или альтернативой IHC-анализу. Несмотря на то, что были изобретены многообещающие замены [1,2], в практике сохранения тканей до сих пор преобладает метод фиксации в нейтральном забуференном формалине и последующей заливки тканей в парафин (FFPE). Метод сохранения тканей FFPE полностью совместим с FISH, однако для получения качественных результатов FISH требуется учитывать процесс фиксации индивидуального образца ткани. В данной статье сосредоточимся на изготовлении стекол с FFPE образцов для FISH-анализа и идентификации суб-оптимальных окрасок.
Конструирование смешанного зонда для FISH-анализа
Оптимальное построение смешанного зонда FISH для обнаружения количества копий гена в солидных опухолях включает в себя два меченных зонда (рис. 11.1). Один зонд направлен непосредственно против интересующего гена, а другой против референсной последовательности хромосомы, на которой расположен интересующий ген. Традиционно, референсный зонд направлен против некодирующих центромерных последовательностей хромосомы.
Зонд против интересующего гена обычно основан на геномных клонах – чаще COS или BAC клонах – и покрывает геномную область, в которой расположена кодирующая последовательность интересующего гена. Мечение геномных клонов, например с помощью ник-трансляции (синтез ДНК
ДНК-полимеразой I, иниции-
Рис. 11.1. Пример смешанного зонда для FISH. Зонд длиной 291 kb, против MYC меченный техасским красным и зонд против CEN-8 референсной последовательности той же хромосомы, меченный флюоресцином.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 105
Изготовление срезов |
Глава 11 |
|
|
рованны в месте точечного разрыва одной цепи ДНК-матрицы с вытеснением её части в направлении 5’) включает в себя маркирование интронов и фланкирующих последовательностей генов. Таким образом, повторяющиеся последовательности, рассеянные по геному человека, также помечаются. Результирующее неспецифическое окрашивание блокируется добавлением немеченых конкурирующих последовательностей. Первым эффективным блокирующим агентом была Cot-1 ДНК фракция [3]. Впоследствии было продемонстрировано, что смесь немеченых олигонуклеотидов пептидных нуклеиновых кислот (PNA), направленная против доминирующей повторяющейся последовательности Alu, сравнима или превосходит по эффективности Cot-1 ДНК фракцию для блокирования [4].
Интенсивность флюоресцентного сигнала зависит от многих факторов: эффективности мечения зондом, типа зонда и типа флюоресцентного красителя. Эксперименты по FISH могут выявить или локализовать экспрессию генов в клетках и тканях при помощи репортерных генов, например, экспрессирующих зеленый флюоресцентный белок.
Подготовка образца ткани
Материал биопсий, эксцизий и резекций должен обрабатываться так быстро, как это возможно, чтобы сохранить ткань для FISH. Образцы ткани размером 3-4 мм необходимо фиксировать в 10% нейтральном забуференном парафине, предпочтительно в течение 18-24 часов с последующей дегидратацией и заливкой в парафин. Необходимо изготавливать срезы толщиной 4-6 мкм и монтировать их на положительно заряженные стекла (например, SuperFrost Plus, Mentel-Glaser, Termo Scientifi c) и сушить при температуре 60°С в течение 1 часа.
Формалиновая фиксация достаточна, поскольку формирующиеся связи между белками и нуклеиновыми кислотами эффективно фиксируют ткань, сохраняя относительно интактной ее структуру. Однако, макромолекулярная сеть, создаваемая формалином, значительно затрудняет доступ зондов FISH к ДНК. Следовательно, первые шаги FISH окрашивания должны быть направлены на
разрушение этой сети.
Изготовление стекол FFPE
Депарафинирование
Потребность в депарафинировании стекол для FISH анализа не отличается от стандартной процедуры обработки стекол для рутинной гистологической окраски гематоксилином-эозином, специальных окрасок или IHC. После монтажа срезов на стекла и сушки они депарафинизуются в ксилоле (или его заменителях) и регидратируются в серии спиртов.
Предварительная обработка
Цель предварительной обработки – облегчение последующей протеазной обработки путем разрушения индуцированных формалином дисульфидных связей [6]. Правильная предварительная
обработка значительно влияет на качество окраски FISH. Неадекватная предварительная обработка
106 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 11 |
Изготовление срезов |
|
|
может привести к усиленной аутофлюоресценции из-за сохранения интактных белков и значительному ослаблению интенсивности сигнала от FISH зонда, в то время как избыточная предварительная
обработка может исказить структуру ткани. Важно адаптировать методы предварительной обработки при использовании тканей, зафиксированных в более слабых фиксирующих растворах, чем 10% нейтральный забуференный формалин, в противном случае она может нанести значительные повреждения ядерной мембране. Разрушенная ядерная мембрана будет иметь размытый контур (рис. 11.2.D). Деградация ядерной мембраны и областей, расположенных близко к ней, может снизить коли-
чество некодирующих (центромерных) референсных последовательностей, поскольку данные участки ДНК имеют тенденцию к локализации под ядерной оболочкой [7]. Некоторые из более интенсивных методов предварительной обработки совмещают в себе инкубацию в кислом растворе (например, соляной кислоты) с дальнейшим воздействием хаотропных агентов (например, тиоционат натрия). Этот способ обработки может негативно повлиять как на структуру ткани, так и на адгезию среза к стеклу. Однако, очень эффективные результаты могут быть получены при изолированной инкубации в 2-(N-морфолино)этансульфоновой кислоте (MES) при 95-99°С в течение 10 минут. Предварительная обработка с использованием MES относительно толерантна к вариациям во времени фиксации, но, для того чтобы этот простой метод принес хорошие результаты, необходимо обрабатывать материал при температуре не ниже 95°С.
Обработка ферментом
Правильная протеазная обработка является несомненно решающим шагом на пути к достижению хороших результатов FISH. Разрушение пептидных мостиков с помощью протеазной обработки напрямую влияет на качество сигнала, так как облегчает доступ FISH-зондов к ДНК и снижает аутофлюоресценцию, генерируемую интактными белками. Некоторые протоколы основаны на использовании очень активных сериновых протеаз, протеиназы К, но более деликатный и все еще актуальный способ – использование карбоксильной протеазы – пепсина.
Время ферментативной обработки зависит от времени, в течение которого проводилась фиксация образца ткани. Для тканей, которые фиксировали в 10% нейтральном забуференном формалине в течение 6-72 часов, время ферментативной обработки составляет от 30 секунд до 12 минут при температуре 37°С с использованием пепсина Dako Ready-to-Use. Обработка может также проводиться и при комнатной температуре (20-25°С), однако потребует увеличения времени инкубации в 3-4 раза.
Более длительное время фиксации потребует более длительной ферментативной обработки. Для большинства обычных FFPE образцов, фиксированных в 10% нейтральном забуференном формалине
в течение 12-24 часов, оптимальным будет время ферментативной обработки 2-3 минуты при 37°С. Однако, сегодняшняя больничная рутина, при которой время фиксации может значительно варьировать или же вообще неизвестно в лаборатории, в которой проводится FISH, что осложняет ферментативную обработку. Очень важно, чтобы персонал в FISH лаборатории мог распознать образцы, непригодные для анализа, и, соответственно, подвергнуть их вторичной обработке.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 107
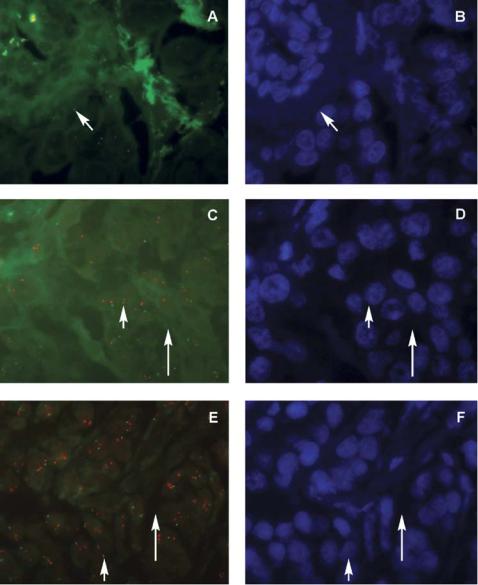
Изготовление срезов |
Глава 11 |
|
|
Рис. 11.2. Образец ткани молочной железы, зафиксированный формалином и залитый в парафин, окрашенный на MYC/CEN-8 (Y5504, Dako). (a) Препарат с выраженной недостаточной ферментативной обработкой – значительное зеленое цитоплазматическое и внеклеточное аутофлюоресцентное фоновое окрашивание. Нет красного сигнала (MYC), выявляются отдельные зеленые референсные сигналы (CEN-8) (стрелка). (b) Окраска того же образца А с помощью DAPI. (c) Препарат со слабой ферментативной обработкой – слабое зеленое цитоплазматическое и внеклеточное аутофлюоресцентное фоновое окрашивание (длинная стрелка). Видны некоторые красные и референсные зеленые сигналы (короткая стрелка). (d) Окраска того же образца С с помощью DAPI. (е) Приемлимое время ферментативной обработки. Короткая стрелка: красные и зеленые сигналы; длинная стрелка: слабая цитоплазматическая и экстраклеточная аутофлюоресценция. (f) Окраска того же образца Е с помощью DAPI.
108 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
