
2 курс / Гистология / РУКОВОДСТВО_ИММУНОГИСТОХИМИЧЕСКИЕ_ММУНОГИСТОХИМИЧЕСКИЕ_МЕТОДЫ
.pdf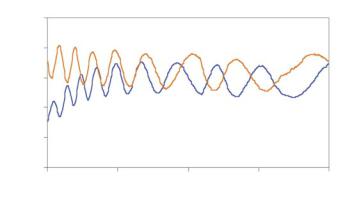
Глава 13 |
FISH визуализация |
|
|
Дуговые ртутные источники света имеют срок службы 200-300 часов, в то время как патентованные предварительно центрированные высокоэффективные источники света, такие как EXFO – 2000 часов. Для FISH рекомендуется использовать источники света, в начале или середине их срока службы, когда они имеют меньше колебаний интенсивности, более стабильны и дают большую силу свечения.
Лазерный источник света: аргоновые, гелевые и диодные лазеры обычно очень стабильны и
имеют менее 1% флюктуаций интенсивности. Однако, если они неэффективно охлаждаются, это может привести к более значительным колебаниям интенсивности свечения (рис. 13.5).
Интенсивность
250
200
150
100
50
0
0 |
100 |
200 |
300 |
400 |
3,33 часа с 30-секундными интервалами
Рис. 13.5. Видимая стабильность лазерного источника света. На графике показаны вариации в интенсивности голубого (488 нм) и красного (568 нм) лазеров, измеренные с помощью объектива х10 и Chroma red slide. Уровень флюоресценции последовательно измерялся через каждые 30 секунд (400 раз) на протяжении 3,33 часов. Пики интенсивности излучения обоих лазеров различались не более, чем на 25%. Кривая изменений интенсивности демонстрирует, что сканирующие и детекционные элементы микроскопа вызывают появление большого количества флюктуаций, отражающихся на освещенности образца. Возможно, акустооптический пропускающий фильтр (AOTF) также способствует формированию флюктуаций.
Проблемы с колебанием интенсивности источника света возникают также при перегреве или нестабильности акустооптического пропускающего фильтра (AOTF) в лазерном сканирующем конфокальном микроскопе или если нарушена центровка оптоволокна [8-11]. При подобных колебаниях слабо флюоресцирующие структуры, такие как FISH-сигналы, невозможно будет правильно идентифицировать и посчитать [13].
Использование лазерного сканирующего конфокального микроскопа для визуализации FISH
Лазерные сканирующие конфокальные микроскопы (LSCM), оборудованные РМТ, становятся все более распространенными для визуализации FISH [14]. Качественные FISH изображения полу-
чаются в результате использования LSCM, который правильно настроен и калиброван. Более того,
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 129
FISH визуализация |
Глава 13 |
|
|
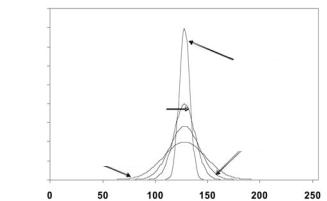
FISH изображения можно улучшить с помощью: (а) настройки апертуры диафрагмы для усиления улавливания потока фотонов; (b) снижения мощности лазера и, соответственно, уменьшения фотообесцвечивания; (с) выбора оптимальных фильтров и дихроичных зеркал для получения максимальной длины волны возбуждения и излучения; (d) снижения сканирующей скорости для попадания большего количества фотонов на детектор и (e) выравнивания рамки (рис. 13.6). Последнее сокращает не только фотообесцвечивание FISH точек, но и шум в системе.
Пиксели интенсивности
9000
8000
7000
6000
16 фреймов CV=3.9%
5000
4000
|
4 фрейма CV=7.8% |
3000 |
|
2000 |
2 фрейма CV=11% |
|
|
1000 |
1 фрейм CV=15.6% |
0
0 |
50 |
100 |
150 |
200 |
250 |
|
|
|
|
|
|
Рис. 13.6. Конфокальное изображение было получено с и без выравнивания интенсивности в канале 135. Коэффициент вариации, CV (CV – среднее/стандартное отклонение) был рассчитан для изображений с выравниванием по 2, 4 и 16 фреймам соответственно. На рисунке представлено распределение пикселей интенсивности изображения. Разброс пикселей интенсивности снижается при усилении выравнивания. Узкое распределение от более выравненных интенсивностей дает изображение лучшего качества. Другими словами, рисунок демонстрирует, что для получения идеального качества изображения необходимо использовать многократное выравнивание для увеличения соотношения сигнал/шум.
Спектральное совмещение
Способность излучения от различных лазеров и разных флюорохромов колокализоваться в заданных точках осей X, Y и Z определяется как спектральное совмещение. Для FISH-анализа чрезвычайно важно определить колокализованы ли сигналы от зондов или разделены. Конфокальные системы, в которых не совмещаются голубой свет с другими цветами видимой части спектра могут давать неточные результаты (рис. 13.7). Поэтому для FISH визуализации важно, проверять систему лазеров и линз с помощью FocalCheckтм микросфер (Invitrogen, Carlsbad, California), чтобы убедиться, что система правильно совмещает спектры на всех длинах волн (рис. 13.8).
FISH колокализация
Колокализация может быть достигнута только при отсутствии перекрытия между спектрами выбранных флюорохромов. Она будет точной только в том случае, если спектры излучения флюорох-
ромов четко разделены между собой, используются корректные настройки фильтров. Выбор флюо-
130 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Глава 13 |
FISH визуализация |
|
|
Интенсивность
250
200
150
100
50
0
0 |
0.5 |
1 |
1.5 |
2 |
2.5 |
3 |
3.5 |
Аксиальное разрешение (μм)
Рис. 13.7. Спектральное и аксиальное разрешение сигналов размером 1 мкм, полученное при трех длинах волн. На рисунке изображен сигнал, полученный с использованием света трех длин волн – 488 нм (FITC), 568 нм (TRITC), и 647 нм (Су5). XZ изображение было конвертировано в диаграмму с использованием программы Image Pro Plus (Media Cybernetics, Inc., Bethesda, MD, USA). Распределение интенсивности по оси XZ необходимо сравнить со значениями по оси XY, чтобы определить регистрируются ли все три цвета корректно и наблюдается ли качественное аксиальное разрешение. Чем более округлым является сигнал, тем лучше спектральное совмещение и аксиальное разрешение.
Рис. 13.8. |
FocalCheckTM |
микросферы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Rhodamine |
|
FITC |
|
|
CY5 |
|
|
FITC |
||||||||||
(Invitrogen, Carlsbad, CA, USA) использовались |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
для мониторинга |
выравнивания |
лазера |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
в лазерном сканирующем конфокальном |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
микроскопе |
Zeiss 510. |
FocalCheckTM |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
микросферы имеют кольца трех разных |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
флюоресцентных |
цветов, |
|
которые |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
возбуждаются при длинах волн 488 нм, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
543 нм и 633 нм, лазерами конфокальной |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
системы. Если лазеры отцентрированы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
правильно, излученный флюоресцентный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
Наложение |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
сигнал будет |
смешиваться |
и для |
|
Rhodamine-FITC |
|
|
|
|
|
|
CY5-FITC |
|
||||||
|
|
|
|
|
|
|
|
|||||||||||
Rhodamine |
и FITC (543 нм и 488 нм) мы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
будем наблюдать только один смешанный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
цвет – желтый (левый рисунок). Однако, если лазеры и оптическая система в целом не центрированы (правый рисунок), то мы будем одновременно наблюдать истинные флюоресцентные цвета (розовый и зеленый), а также белый зоне их перекрытия.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 131
FISH визуализация |
Глава 13 |
|
|
рохромов с четко разделенными спектрами излучения и поглощения чрезвычайно важен для многоцветной окраски и колокализации [15,16]. Кроме того, важно правильно центрировать микроскоп, так как при неправильной центрировки возникают латеральные и фокусные сдвиги, что вызывает нечеткость регистрации картинки. При колокализации никогда не видно, что две флюоресцентные пробы взаимодействуют между собой. Колокализация показывает только, что они расположены на очень близком расстоянии друг от друга, для изучения их взаимодействия следует использовать технологию FRET (Forster Resonance Energy Transfer).
При этом также важно и разрешение, так, если расстояние между двумя точками менее разрешающей способности оптической системы (при использовании объективов с низким значением NA, например объектив х10, 0.25 NA) может создаваться ощущение, что они колокализованы. С другой стороны, если использовать оптическую систему высокого разрешения (объектив х100/1.45 NA), то сигналы, казавшиеся колокализованными, будут регистрироваться как отдельные точки. Таким образом, числовая апертура объектива, совпадение коэффициентов преломления, размер пикселя камеры (должен соответствовать увеличению и светосиле объектива), разрешающая способность объектива – все это будет повышать разрешение и улучшать колокализационный анализ.
Стандарты
Эпифлюоресцентные и конфокальные лазерные сканирующие микроскопы имеют неограниченный потенциал во многих областях биологии за исключением FISH. Для демонстрации всех возможностей этих микроскопов в дополнение к субъективной оценке рекомендуется использование тестовых препаратов для получения идеальных изображений. Без использования функциональных тестов и стандартов невозможно добиться оптимальных настроек и обеспечить корректность FISH-анализа. Основными параметрами, характеризующими работу микроскопа, являются: спектральное совмещение, аксиальное разрешение и полевое освещение (рис. 13.7, 13.8). В качестве одного из стандартных тест-объектов используется бокс со стеклами. Для настройки полевого освещения необходимо использовать набор
из четырех флюоресцентных стекол, поставляемых компанией производителем фильтров (http://www. omegafilters.com/index.php?page=omega/Prod/prod_rslides_chart или http://www.chroma.com) [8-11]. Красное стекло (chroma red slide) из этого набора может возбуждаться всеми длинами волн и используется для измерения полевого освещения (рис. 13.2). Для генерации PSF (см. приложение) и облегчения калибровки эпифлюоресцентных и конфокальных микроскопов при мультицветном анализе используются наборы фирмы Invitrogen (http://probes.invitrogen.com/media/pis/mp07279.pdf) или PolyScience (Warrington, PA, USA): http://www.poysciences.com/Catalog/40/categoryid__4/ [5-11].
XY и Z сдвиги
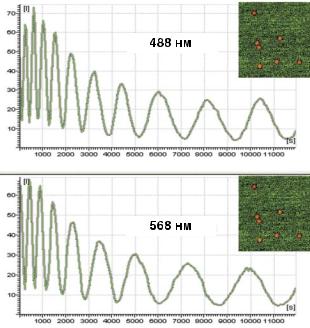
Механические вибрации микроскопа могут приводить к артефактам при колокализации и/или FISH (рис. 13.9). Для предотвращения вибрационных сдвигов следует использовать высокоскоростной сервоприводный или пьезоэлектрический объектив, или встроенный моторизованный контроллер Z-оси. Сдвиги изображений можно предотвратить и с помощью вибрационной изоляции высокого
качества и температурной регуляции.
132 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 13 |
FISH визуализация |
|
|
Другие факторы
Среди других факторов, влияющих на качество FISH изображений и количество фотографий, записываемых детекторами следует назвать:
•совместимость элементов опти-
ческой системы;
•центрирование и показатели преломления лазерных зеркал;
•температуру детектора (охлаждаемые камеры).
Большое количество фотографий способствовует пере - греву детектора и снижению качества FISH-изображений даже в хорошо центрированных системах, где правильно подобраны фильтры. Если FISH-сигнал неяркий, то необходимо увеличить время экспозиции и выравнивание. При этом важно, не засветить образец избыточным количеством света. Использование специальных реагентов (таких как
Prolong Vectoshield) на фиксированных образцах позволит снизить фотообесцвечивание и сберечь пробу [8-11].
Рис 13.9. FISH-зонды возбуждались ежеминутно лазерами 488 нм и 568 нм. Средняя интенсивность сигнала измерялась каждую минуту на протяжении 3,33 часа (200 раз). Синусоиды демонстрируют периодические колебания интенсивности, как результат нестабильности системы [6,11]. Средняя интенсивность также варьировала во времени из-за того, что образец выходил из фокуса или обесцвечивался и потому давал меньшую интенсивность излучения. В современных микроскопах предусмотрены автоматический контроль и коррекция этих сдвигов.
CCD камера – детектор для FISH визуализации
Многие исследователи используют CCD камеры для визуализации FISH [17-19]. Они широко применяются для широкопольных и лазерных сканирующих конфокальных микроскопов и иногда могут быть использованы отдельно от микроскопа. Имеется большое количество моделей разных производителей. Мы не ставим задачи описать детали работы CCD-камеры, такие как шум, коэффициент усиления,
линейность, гамма-коррекция, емкость матрицы, для подробной информации на эту тему смотрите http://www.microscopuy.com/tutorials/java/digitalimaging/signaltonoise/index.html. Этот же раздел посвящен выбору подходящей камеры и особенностям ее использования при визуализации FISH.
Квантовая эффективность (QE). FISH сигналы разбросаны по разным длинам волн, поэтому
необходимо выбирать камеру с высокой квантовой эффективностью, чтобы захватить все интере-
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 133
FISH визуализация |
Глава 13 |
|
|
сующие длины волн. QE определяется как обратная пропорция количества фотонов улавливаемых детектором к выходящему сигналу и линейная пропорция к фотонному выходу. QE – это функция длины волны детектируемых фотонов [25]. Идеальная ситуация: 100% QE означает, что 100 фотонов определенной длины волны генерируют 100 электронов, а 100 электронов обнаруживаются камерой. Новейшие камеры имеют QE равный 80-90%, 100% QE технически невозможна. Рекомендуется использовать высокочувствительные электронно-умножительные CCD камеры (EMCCD), которые могут усиливать сигнал. Преимущество EMCCD камер состоит в том, что они удобны в работе и предохраняют образцы от фотообесцвечивания с помощью контроля интенсивности освещения и электронного умножителя (http://www.andor.com/learn/application/?docid=95 и http://www.emccd.com/ what_is_emccd/emccd_tutorial/Q3_In%20Practice_How_Is_EM_Gain_Applied_to_Multiply_The_Signal).
Размер пикселя. Если необходимо точно локализовать гены, то необходимо использовать светосильный объектив (х60 или х100, 1.4NA), совмещаемый с камерой, имеющей минимально возможный размер пикселя (не более 6-10 мкм). Это не только улучшает пространственное разрешение, но и увеличивает частоту квантования, динамический диапазон, соотношение сигнал/шум. Однако если FISH сигналы разнородны, рекомендуется использование EMCCD камер [17, 25].
Динамический диапазон. Способность CCD камеры обнаруживать различия в интенсивности сигналов определяется как динамический диапазон. Динамический диапазон полезен для опреде-
ления требований к оцифровке для заданного сигнала. Важно знать, что для оптимальной репрезентативности, динамический диапазон не должен быть больше, чем общее количество градаций серого. Для FISH-визуализации достаточна 12-битная (или 212=4,096 градаций серого) камера. Камеры с более низкими значениями 8-бит или 10-бит будет не достаточно. Динамический диапазон с большим количеством градаций серого улучшит качество изображения из-за малой интенсивности свечения образца. В изображениях камер с большим динамическим диапазоном (более 12-бит) при низкой интенсивности флюоресценции шум преобладает над сигналом.
Скорость считывания. Этот параметр отражает, как быстро аккумулируемые в каждом пикселе электроны передаются и трансформируются в цифровой сигнал. Увеличение скорости считывания увеличивает уровень шума. Поскольку все FISH изображения статичны, необходимо использовать небольшую скорость считывания. Например, если у камеры предусмотрены две скорости считывания, 10 МГц и 20 МГц, лучше использовать меньшую.
Биннинг. Используемые для FISH-визуализации CCD камеры являются многоцелевыми устройствами и должны обладать технической возможностью настройки под разные задачи. Суть такого рода настроек заключается в совмещении сигнала от соседних пикселей, для увеличения скорости считывания, соотношения сигнал/шум, чувствительности для визуализации и подсчета сигналов при низком уровне освещенности, однако при этом снижается пространственное разрешение. В зависимости от интенсивности и требуемого разрешения FISH-сигнала, биннинг может использоваться дважды. Для получения более подробных сведений см. http://olympusmicro.com/primer/digitalimaging/ digitalimagingdetectors.html или http://www.microscopyu.com/tutorials/java/digitalimaging/pixelcalculator/ index.html.
134 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 13 |
FISH визуализация |
|
|
Проблема сферических аббе-
раций. Излучения разных длин
волн имеют разный цвет и фокусируются на линзе в разных местах. Высококачественные линзы обеспечивают фокусировку синего, зеленого и красного цветов в одной точке. При использовании низкокачественных или поврежденных линз возникают сферические аберрации – это означает, что не все цвета фокусируются в одной
точке. Наличие сферических абер-
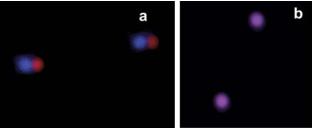
раций мешает интерпретации истинных FISH-сигналов (рис 13.7, 13.8, 13.10).
Рис. 13.10. На рисунке показан сигнал от возбуждения объекта ультрафиолетовым (365 нм) и видимым светом (568 нм). а – в не центрированной системе из-за возникающих сферических аберраций наблюдается два сигнала от объекта (синий и красный); b – в хорошо центрированной системе сигнал колокализуется в одной точке.
Возбуждающие и эмиссионные фильтры. Одним из способов усиления интенсивности флюоресценции является использование широкополосных фильтров. Таким образом, большее количество фотонов попадает на образец и улавливается флюофором. Однако недостатком такого метода является усиление шума или перекрытие свечения другого флюофора. В подобных ситуациях полезны узкокополосные фильтры. Недостаток такого подхода – малое количество фотонов, попадающих на детектор и усиление шума в системе. Единственный способ найти компромисс между использованием широкополосного и узкополосного возбуждающих фильтров – метод проб и ошибок, то есть подбор удовлетворительного качества изображения под конкретные характеристики детектора, разрешение объектива и др.
Эмиссионные фильтры. Широкополосный эмиссионный фильтр пропускает больше сигнала
от образца и должен использоваться только в случае перекрытия спектров разных флюофоров на одном образце. Для более подробной информации см. http://www.omegafi lters.com/ или http://www. semrock.com/Catalog/BrightlineCatalog.htm.
Практический совет. Излучение короткой длины волны имеет большую энергию, чем длинноволновое излучение. Поэтому просмотр FISH препаратов стоит производить в определенной последовательности: начинать с длинных волн возбуждения, а заканчивать короткими (то есть: Rhodamine → FITC → DAPI). Такой метод снижает вероятность фотообесцвечивания последних красных образцов.
Улучшение FISH-изображений с помощью 3D деконволюционной микроскопии
Дли визуализации FISH требуется использование эпифлюоресцентной или конфокальной микроскопии с Z-шкалой для комбинирования серии 2D-снимков или пространственных 3D-изображений. Для более подробной информации см. http://www.olympusfl ouwiev.com/theory/index.html и http://www. olympusconfocal.com/java/confocalvswidefi eld/index.html.
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 135
FISH визуализация |
Глава 13 |
|
|
Поскольку интерпретация данных только двухмерного изображения может быть затруднительна, для качественного анализа необходимо конструировать объемные 3D изображения. Такие объемные изображения помогают исследователям лучше интерпретировать потенциальные проблемы FISH изображений, например, артефакты локализации проб (рис. 13.10). Для получения более подробной информации см.http://www.olympusmicro.com/primer/digitalimaging/deconvolution/deconintro.html.
Опытный исследователь с помощью трехмерной картинки может оценить такие важные параметры, как расстояние между зондами и их колокализацию. Более того, трехмерная картина имеет
большую точность и четкость.
Деконволюция |
|
|
|
|
|
|
|
Дифракция |
|
|
|
Множество трехмерных FISH |
|
|
и фотонный шум |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изображений, получаемых методом |
|
|
|
|
|
|
|
|
|
|
|
оптических срезов, можно улуч- |
|
|
Конволюция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
шить (увеличить контраст и снизить |
|
|
|
|
100 nm метка |
100 nm метка |
|
|
|||
|
|
|
Как видно |
||
|
Идеальное |
|
|
|
|
размытие) с помощью метода декон- |
|
|
|
в микроскопе |
|
изображение |
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
волюции (рис. 13.11, 13.12, 13.13). |
|
Деконволюция |
||
|
|
|
||
Деконволюция – процесс, призванный |
|
|
|
|
|
Применение алгоритма |
|
||
|
|
|
||
обратить эффекты конволюции, |
|
деконволюции |
|
|
|
|
|
||
|
|
|
||
возникающие при записи данных. В |
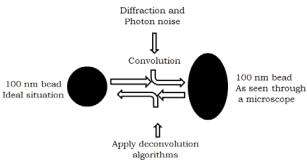
Рис. 13.11. Схематическая концепция конволюции/деконволюции. |
|||
нематематических терминах декон- |
||||
|
|
|
||
волюция – это обратная конволюция. |
|
|
|
|
Например, если в микроскопе анализируется идеальная субдифракционная (100 нм) флюоресцентная метка, она не будет иметь круглую форму, а будет удлиненной. Круглая структура оказывается вытянутой (convoluted) из-за дифракции света в микроскопе и фотонного шума. Процесс деконволюции подразумевает преобразование вытянутых (convoluted) структур в сферические, с помощью численных
алгоритмов (для получения более подробной информации см. http://www.olympusmicro.com/primer/ digitalimaging/deconvolution/deconvolutionhome.html).
В последние несколько лет вычислительные механизмы деконволюции разрабатываются и продвигаются различными производителями (http://www.olympusmicro.com/primer/digitalimaging/ deconvolution/deconvolutionweb.html и http://www.olympusmicro.com/primer/digitalimaging/deconvolution/ deconvolutionalgorithms.html), все они направлены на улучшение контрастности картинки (рис. 13.13 а, b).
Заключение
Флюоресцентный и конфокальный микроскопы являются сложными инструментами с огромным потенциалом для решения различных биологических задач и широко используются в современных исследованиях. Для успешной реализации потенциала этих приборов, требуется специальная подготовка пользователей в области физики изучаемых процессов, устройства микроскопа и принципов его работы. Для получения качественных FISH изображений очень важно квалифициро-
ванно разбираться в характеристиках объективов, детекторов, источников света, XYZ шкалах и их
136 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Глава 13 |
FISH визуализация |
|
|
значении в формировании конечных изображений. Следует понимать также, что изменения любых параметров системы будут отражаться на качестве изображения. Правильное использование оборудования является одним из главных условий получения наилучшего результата.
Трудно переоценить также значимость стандартов для оценки качества работы прибора. Мы рекомендуем проверять равномерность освещения, PSF, стабильность источника света и, при необходимости, использовать калиброванные флюоресцентные стекла для настройки прибора.
Существует множество информационных ресурсов о микроскопах, в том числе и о конфокальных. Данные материалы доступны на веб-сайтах компаний Olympus и Nikon (http://www. olympusmicro.com/primer/techniques/ fluorescence/fluorhome.html и http:// www.olympusfl uoview.com/resources/ courses.html).
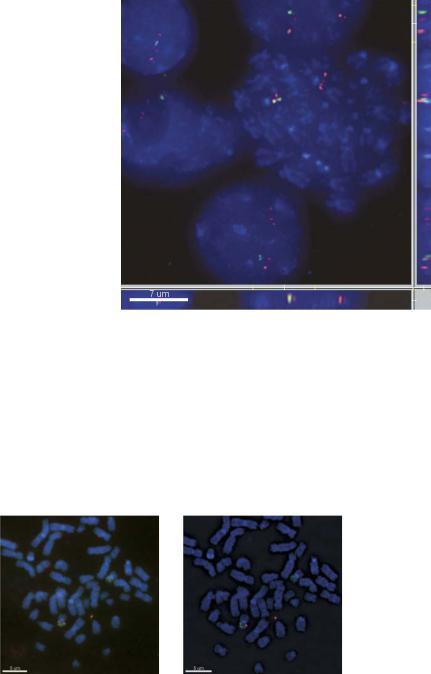
Рис. 13.12. Анализ FISH-изображений с использованием деконволюционного широкопольного микроскопа. Справа и снизу
– проекции данных в результате деконволюции. Колокализованные FISH-сигналы (желтые) хорошо различимы после деконволюции. Изображение любезно предоставлено Peter Franklin (Applied Precision Inc, Issaquah, WA, USA).
a |
b |
Рис. 13.13. Красная и зеленые FISH-сигналы выглядят более резкими после деконволюции (справа), чем без деконволюции (слева): a – широкопольная микроскопия без деконволюции; b – широкопольная микроскопия с деконволюцией. Изображение любезно предоставлено Peter Franklin (Applied Precision Inc, Issaquah, WA, USA).
ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ | 137
FISH визуализация |
Глава 13 |
|
|
Словарь
Лазерный сканирующий конфокальный
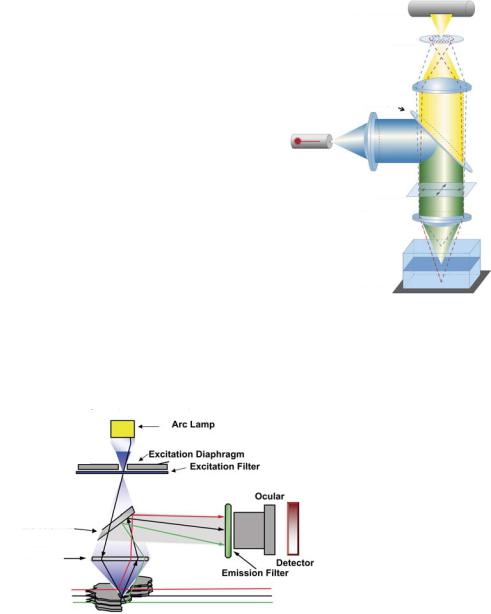
микроскоп. Флюоресцентный микроскоп обеспечивает высокую глубину разрешения и контраст, блокируя флюоресценцию, исходящую извне основного поля зрения, с помощью «конфокальной» диафрагмы малого сечения (рис. 13.14).
Фотоумножитель
Диафрагма малого сечения
Светоделитель
Лазер
Сканер
Линза объектива
Z-Контрольl
Эпифлюорисцентное
освещение
Дихроичный фильтр
Объектив
Рис. 13.14. Схема работы лазерного сканирующего
конфокального микроскопа. Изображение любезно
предоставлено Dr. Jochen Tham. Carl Zeiss MicroImaging, Inc.
|
Дуговая лампа |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
Возбуждающая диафрагма |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||
|
|
Возбуждающий фильтр |
|
Эпифлюоресцентный микроскоп. |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эпифлюоресцентный микроскоп |
|
|
|
|
|
Окуляр |
|
|
|
||
|
|
|
|
|
|
используется для фокусировки света |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
на образце и для детекции излучения |
|
|
|
|
|
|
|
|
|
|
образца, полученного в результате |
|
|
|
|
|
|
|
флюоресценции (рис. 13.15). |
|||
|
|
|
|
|
|
Детектор |
||||
|
|
|
Эмиссионный фильтр |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Рис. 13.15. Работа эпифлюоресцентного микроскопа. Возбуждающее излучение от дуговой лампы (черный луч) проходит через возбуждающий фильтр и дихроичное зеркало и фокусируется непосредственно на образце. Флюоресцентное излучение разных длин волн (красное, зеленое, черное) отражается дихроичным фильтром, проходит через эмиссионный фильтр, окуляр и попадает на детектор (глаз или камеру). Изображение любезно предоставлено Prof. J. Pual Robinson, Ph.D., Director of Purdue University Cytometry Laboratory (Purdue University, West Lafayette, IN, USA).
138 | ИММУНОГИСТОХИМИЧЕСКИЕ МЕТОДЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
