
- •Раздел 1. Техническая термодинамика
- •Изучение конструкций приборов для измерения параметров состояния рабочих тел
- •Краткие теоретические сведения
- •Типы измерительных приборов
- •Манометрические термометры.
- •Сильфоны.
- •Термоэлектрические термометры – термопары.
- •Жидкостные манометры.
- •Деформационные манометры.
- •Максиметры.
- •Грузопоршневые манометры.
- •Мерные устройства (штихпроберы).
- •Счетчики с крыльчатыми вертушками (радиальные).
- •Счетчики с винтовыми вертушками (осевые).
- •Дросселирование газа диафрагмой (дроссельной шайбой) .
- •Контрольные вопросы
- •Определение газовой постоянной
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов опыта
- •Контрольные вопросы
- •Определение удельной объемной изобарной теплоемкости воздуха
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок проведения опыта
- •Обработка результатов опыта
- •Контрольные вопросы
- •Определение показателя адиабаты для воздуха
- •Краткие теоретические сведения
- •Методика проведения работы
- •Описание установки
- •Порядок проведения опыта
- •Обработка результатов опыта
- •Контрольные вопросы
- •Исследование изохорного процесса
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения опыта
- •Обработка результатов опыта
- •Оценка погрешности
- •Контрольные вопросы
- •Исследование политропного процеса при истечении газа
- •Краткие теоретические сведения
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов исследования
- •Оценка погрешности
- •Контрольные вопросы
- •Определение термодинамических свойств воды и водяного пара
- •Краткие теоретические сведения
- •Описание экспериментальной установки
- •Порядок проведения эксперимента
- •Раздел 2. Теория теплообмена
- •Исследование теплообмена при кипении
- •Краткие теоретические сведения.
- •Теплоотдача при пузырьковом кипении жидкости в условиях свободного движения
- •Эмпирические формулы.
- •Описание установки
- •Формулы используемые при выполнении л.Р.
- •Контрольные вопросы
- •Дополнительные вопросы.
- •Примеры выполнения лабораторной работы.
- •Опеределение коэффициента теплопроводности теплоизоляционного материала методом трубы
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов опыта
- •Оценка погрешности
- •Контрольные вопросы
- •Исследование теплоотдачи от металлического стержня
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов
- •Контрольные вопросы
- •Определение коэффициента теплоотдачи от вертикального цилиндра при свободной конвекции
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов
- •Оценка погрешности
- •Контрольные вопросы
- •Исследование теплопередачи в водяном теплообменнике
- •Краткие теоретические сведения
- •Описание экспериментальной установки
- •Порядок выполнения работы
- •Обработка результатов опыта
- •Оценка погрешности
- •Контрольные вопросы
Определение удельной объемной изобарной теплоемкости воздуха
Цель работы – экспериментальное определение удельной объемной изобарной теплоемкости воздуха ср' кДж/м3 К и сравнение полученного результата с табличным значением.
Краткие теоретические сведения
Удельная теплоемкость является характеристикой тепловых свойств вещества и соответствует количеству теплоты, которое необходимо сообщить единице количества вещества для повышения его температуры на 1 град.
![]() (6)
(6)
В зависимости от количественной меры вещества различают теплоемкости:
массовую с, кДж/кг град.;
объемную c′, кДж/м3 град.;
мольную cμ, кДж/моль град.
Связь между названными теплоемкостями устанавливается следующими зависимостями:
![]()
![]()
![]()
![]() ,
,
где: 22,4 – молярный объем υμ при нормальных условиях, м3/кмоль.
Теплоемкость может быть истинной c, то есть соответствующей определенному значению температуры, и средней cm, определяемой в интервале температур от t1 до t2.
Истинной теплоемкостью с называется отношение элементарного количества теплоты, сообщаемой термодинамической системе в каком-либо процессе, к бесконечно малой разности температур или истинная теплоемкость есть предел, к которому стремится средняя теплоемкость при приближении t2-t1 к нулю.
![]() ,
тогда
,
тогда
![]() откуда
откуда
![]() и
и

Средней теплоемкостью cm данного процесса в интервале температур от t1 до t2 называют отношение количества теплоты к конечной разности температур (6).
Истинные и средние теплоемкости можно найти графическим способом. Если площадь четырехугольника 1342 заменить площадью равновеликого прямоугольника 1562, то ордината 1-5 будет в масштабе определять среднюю теплоемкость процесса cm в интервале температур t2-t1, а ординаты 1-3 и 2-4 в масштабе будут определять истинные теплоемкости с1 и с2, соответствующие значениям температур t1 и t2.
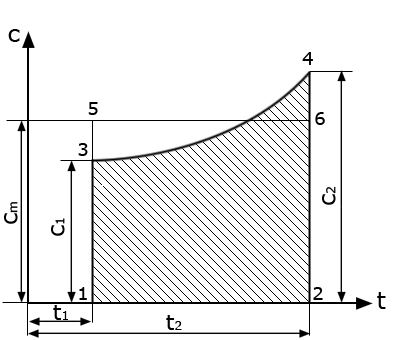 Площадь
прямоугольника определяет количество
теплоты, подведенной или отведенной в
этом процессе на единицу количества
вещества
Площадь
прямоугольника определяет количество
теплоты, подведенной или отведенной в
этом процессе на единицу количества
вещества
![]()
откуда
![]() .
.
Количество удельной и полной теплоты при p=const и υ=const имеют вид:
![]() ;
;
![]()
![]()
![]()
Теплоемкость идеальных газов зависит от их природы, чем выше атомность газов, тем выше теплоемкость.
Теплоемкость
также зависит от характера протекания
процесса, в связи с чем различают
теплоемкости при постоянном объеме
(cv,
cv',
cμv)
и
постоянном
давлении (ср,,
ср',
c![]() р..).
Если в обоих случаях нагреть одно и то
же количество газа на одно и то же число
градусов, то во втором случае тепла
будет затрачено больше, чем в первом,
так как во втором случае газ не только
нагревается, но и совершает работу, что
и требует большей затраты тепла. Поэтому
теплоемкость при постоянном давлении
всегда больше теплоемкости при постоянном
объеме.
р..).
Если в обоих случаях нагреть одно и то
же количество газа на одно и то же число
градусов, то во втором случае тепла
будет затрачено больше, чем в первом,
так как во втором случае газ не только
нагревается, но и совершает работу, что
и требует большей затраты тепла. Поэтому
теплоемкость при постоянном давлении
всегда больше теплоемкости при постоянном
объеме.
Количественное
соотношение между
![]() и
и
![]() можно выразить с помощью уравнения
Майера:
можно выразить с помощью уравнения
Майера:
ср – сv = R,
тогда зависимость между мольными теплоемкостями выразится
![]()
где: R – удельная газовая постоянная, Дж/кг К;
Rμ – универсальная газовая постоянная, Дж/моль К.
 Теплоемкость
идеальных газов зависит и от температуры.
В общем случае эта зависимость графически
представляется в виде кривой, то есть
имеет нелинейный
характер (линия I).
Очевидно, что каждому значению температуры
будет соответствовать свое значение
истинной теплоемкости. Эту зависимость
можно представить в виде полинома
третьей степени:
c=a+bt+dt2+et3,
Теплоемкость
идеальных газов зависит и от температуры.
В общем случае эта зависимость графически
представляется в виде кривой, то есть
имеет нелинейный
характер (линия I).
Очевидно, что каждому значению температуры
будет соответствовать свое значение
истинной теплоемкости. Эту зависимость
можно представить в виде полинома
третьей степени:
c=a+bt+dt2+et3,
где: a, b, d, e – постоянные для каждого газа величины, определяемые на основании экспериментальных или теоретических данных.
Средние теплоемкости для интервала температур от 0 до tоС даны в таблицах, а средняя теплоемкость для интервала температур от t`1оС до t2оС вычисляется по формуле:
![]()
В теплотехнических расчетах нелинейную зависимость теплоемкости от температуры часто заменяют близкой к ней линейной зависимостью (линия II). В этом случае истинная теплоемкость
c=a+bt,
а
средняя теплоемкость в интервале
температур от t`1оС
до
t2оС
![]()
Данные теплоемкости определяют по интерполяционным формулам.
Иногда в теплотехнических расчетах, не требующих большой точности, допускается не учитывать зависимость теплоемкости от температуры, а предлагается считать ее величиной постоянной, то есть c=f(t)=const (линия III). Для ее определения можно пользоваться значениями киломольных теплоемкостей:
-
Газы
Киломольная теплоемкость, кДж/кмоль∙град
сμυ
сμр
Одноатомные
12,56
20,93
Двухатомные
20,93
29,31
Трех- и многоатомные
29,31
37,68
В термодинамике большое значение имеет отношение теплоемкостей
![]()
где: k – показатель адиабаты.
Из уравнения Майера и отношения теплоемкостей получим:
![]()
![]()
![]()
![]() но так как ср=kcv,
то
но так как ср=kcv,
то ![]()
Значения
теплоемкостей могут находиться в
интервале от
![]() до
до
![]() .
.
Конкретное значение теплоемкости зависит от условий протекания процесса.
В
адиабатном процессе, где отсутствует
теплообмен с окружающей средой (δq=0),
с=0.
В изотермическом процессе при dТ=0
с=![]() .
.
Знак теплоемкости определяется по формуле (6), полагая, что подведенная к рабочему телу теплота является положительной, а отведенная от него – отрицательной, а также по знаку изменения температуры.
Удельная объемная изобарная теплоемкость характеризует количество теплоты, необходимое для нагревания 1 м3 газа на 1 град в процессе при постоянном давлении. В 1 м3 в зависимости от температуры и давления может содержаться различное по массе количество газа. Поэтому объемную теплоемкость принято относить к 1 м3 газа при нормальных условиях, т.е. при рн = 101325 Па и Тн = 273 К.
