
- •Раздел 1. Техническая термодинамика
- •Изучение конструкций приборов для измерения параметров состояния рабочих тел
- •Краткие теоретические сведения
- •Типы измерительных приборов
- •Манометрические термометры.
- •Сильфоны.
- •Термоэлектрические термометры – термопары.
- •Жидкостные манометры.
- •Деформационные манометры.
- •Максиметры.
- •Грузопоршневые манометры.
- •Мерные устройства (штихпроберы).
- •Счетчики с крыльчатыми вертушками (радиальные).
- •Счетчики с винтовыми вертушками (осевые).
- •Дросселирование газа диафрагмой (дроссельной шайбой) .
- •Контрольные вопросы
- •Определение газовой постоянной
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов опыта
- •Контрольные вопросы
- •Определение удельной объемной изобарной теплоемкости воздуха
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок проведения опыта
- •Обработка результатов опыта
- •Контрольные вопросы
- •Определение показателя адиабаты для воздуха
- •Краткие теоретические сведения
- •Методика проведения работы
- •Описание установки
- •Порядок проведения опыта
- •Обработка результатов опыта
- •Контрольные вопросы
- •Исследование изохорного процесса
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения опыта
- •Обработка результатов опыта
- •Оценка погрешности
- •Контрольные вопросы
- •Исследование политропного процеса при истечении газа
- •Краткие теоретические сведения
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов исследования
- •Оценка погрешности
- •Контрольные вопросы
- •Определение термодинамических свойств воды и водяного пара
- •Краткие теоретические сведения
- •Описание экспериментальной установки
- •Порядок проведения эксперимента
- •Раздел 2. Теория теплообмена
- •Исследование теплообмена при кипении
- •Краткие теоретические сведения.
- •Теплоотдача при пузырьковом кипении жидкости в условиях свободного движения
- •Эмпирические формулы.
- •Описание установки
- •Формулы используемые при выполнении л.Р.
- •Контрольные вопросы
- •Дополнительные вопросы.
- •Примеры выполнения лабораторной работы.
- •Опеределение коэффициента теплопроводности теплоизоляционного материала методом трубы
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов опыта
- •Оценка погрешности
- •Контрольные вопросы
- •Исследование теплоотдачи от металлического стержня
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов
- •Контрольные вопросы
- •Определение коэффициента теплоотдачи от вертикального цилиндра при свободной конвекции
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов
- •Оценка погрешности
- •Контрольные вопросы
- •Исследование теплопередачи в водяном теплообменнике
- •Краткие теоретические сведения
- •Описание экспериментальной установки
- •Порядок выполнения работы
- •Обработка результатов опыта
- •Оценка погрешности
- •Контрольные вопросы
Исследование политропного процеса при истечении газа
Цель работы – исследование сущности политропных процессов при истечении газа, экспериментальное определение показателя политропы и изучение процесса истечения из резервуара неограниченной емкости.
Краткие теоретические сведения
Политропным называется процесс изменения состояния идеального газа, в котором удельная теплоемкость, называемая политропной cn, является постоянной величиной, а линия процесса называется политропой.
В соответствии с первым началом термодинамики в произвольном термодинамическом процессе удельная теплота, подведенная извне к рабочему телу, расходуется на изменение внутренней энергии тела и на совершение удельной работы
δq = du + δ1
Если величины, содержащиеся в уравнении первого начала термодинамики, выразить через параметры состояния, их приращения и удельные теплоемкости:
cndT = cvdT + pdυ,
где: cn – политропная теплоемкость
и если считать, что удельные теплоемкости cn и cv - величины постоянные, то и размер величины pdυ останется в процессе неизменным. Таким образом, условие постоянства удельной теплоемкости означает, что количественное распределение теплоты между внутренней энергией и работой изменения объема в политропном процессе остается неизменным. В этом состоит главная особенность политропного процесса.
Пусть в данном политропном процессе на изменение внутренней энергии газа идет некоторая доля х внешнего тепла
△u = х∙q,
а оставшаяся часть тепла идет на совершение механической работы расширения
l = (1-x)∙q
Величина x называется коэффициентом распределения теплоты в политропном процессе и остается неизменной в течение данного политропного процесса
Уравнение политропного процесса имеет вид:
![]() , (20)
, (20)
где: n - показатель политропы, определяемый по формуле
![]() (21)
(21)
где: cn - удельная политропная теплоемкость;
cp - удельная изобарная теплоемкость;
cv - удельная изохорная теплоемкость.
Показатель политропы n принимает для каждого конкретного процесса определенное числовое значение. Для основных процессов: изохорных n = , изобарных n = 0, изотермических n = 1 и адиабатных n = k.
Значение n в любом политропном процессе может быть определено по координатам двух любых точек процесса.

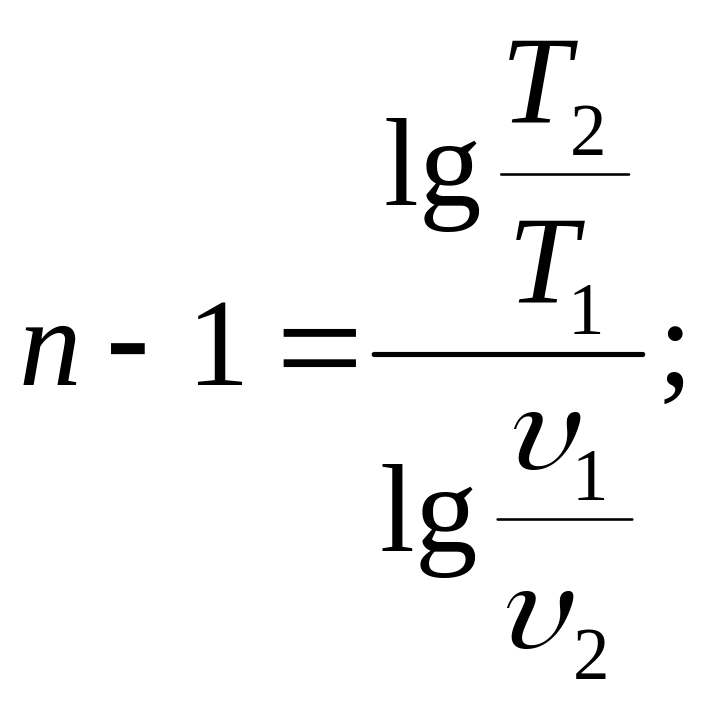
 (22)
(22)
 Изображая
политропный процесс в логарифмических
координатах, можно предложить простой
способ определения показателя n.
Логарифмируя уравнение политропы (20),
получаем
Изображая
политропный процесс в логарифмических
координатах, можно предложить простой
способ определения показателя n.
Логарифмируя уравнение политропы (20),
получаем
lg p + n lgυ = const.
Это уравнение представляет собой уравнение прямой линии в координатах lgp и lgυ, а показатель политропы n – тангенс угла наклона прямой к оси абсцисс.
Удельную теплоемкость политропного процесса для каждого значения n определяют из формулы (21):
![]() (23)
(23)
где : k – показатель адиабаты, зависящий от атомности газа.
Если в уравнение (23) подставить значения n для частных случаев, то получаем удельные теплоемкости ранее рассмотренных процессов:
-
изохорного процесса n=![]() cn=cv;
cn=cv;
- изобарного процесса n=0, cn=cp;
-
изотермического процесса n=1,
cn=![]()
- адиабатного процесса n=k, cn=0.
На рисунке в координатах p-υ и T-s показано взаимное расположение политроп с различными значениями n, определенных выше, но с одним и тем же начальным состоянием газа (точка А с координатами р1, υ1 на одной диаграмме и s1, T1 – на другой).

Кривые процессов в координатах р-υ, совершаемых с увеличением удельного объема, располагаются справа от изохоры, они являются процессами расширения и характеризуются положительным знаком работы (δl>0) .Процессы, располагающиеся слева от изохоры, являются процессами сжатия, и, следовательно, работа в этих процессах отрицательна (δl<0).
Процессы, в которых удельный объем и давление одновременно возрастают или уменьшаются, характеризуются отрицательным показателем политропы (n<0).
Процессы, совершаемые с подводом теплоты, легко исследовать с помощью диаграммы T-s. Процессы, располагающиеся справа от адиабаты, совершаются с подводом теплоты (δq>0), слева от адиабаты – с отводом теплоты (δq<0).
Знак изменения внутренней энергии совпадает со знаком изменения температуры. Процессы, располагающиеся выше изотермы, совершаются, как это видно из T-s диаграммы, с повышением температуры и сопровождаются ростом удельной внутренней энергии (du>0). В процессах, располагающихся ниже изотермы, внутренняя энергия уменьшается (du<0).
В процессах, лежащих между изотермой и адиабатой (1<n<k), знаки элементарного количества теплоты δq и приращения температуры dT противоположны, поэтому удельная теплоемкость в этих процессах принимает отрицательный знак (с<0).
Поскольку уравнение политропы отличается от уравнения адиабаты только значением показателя n, то, очевидно, все соотношения между основными параметрами могут быть представлены формулами:
 ;
;
 ;
;
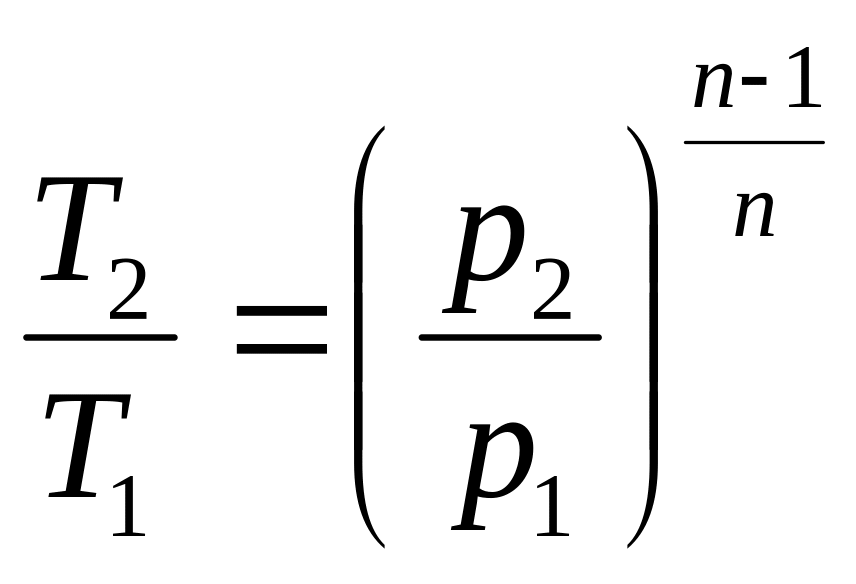 .
.
Уравнение удельной работы изменения объема, совершаемой телом при политропном процессе, имеет аналогичный вид с уравнением удельной работы в адиабатном процессе, то есть
![]()
![]()


Удельное
количество теплоты в политропном
процессе определяется по формулам: ![]()
![]()
Изменение удельных внутренней энергии, энтальпии и энтропии в политропном процессе определяется, соответственно, по формулам;
![]()
![]()
![]()
В процессе истечения воздуха через сужающееся сопло будем полагать, что истечение воздуха происходит из резервуара неограниченной емкости, поскольку имеет место непрерывная подача воздуха от вентилятора.
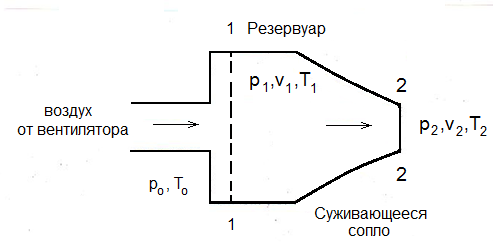
Примем параметры газа в резервуаре p1, υ1, T1; параметры газа в выходном сечении p2, υ2, T2; параметры окружающей среды, куда вытекает воздух через суживающееся сопло, p0 и T0. Тогда перепад давления, под которым происходит процесс истечения:
![]() (24)
(24)
По известному перепаду давлений и определенному по формуле (22) значению показателя политропы определяется скорость истечения
 ,
(25)
,
(25)
где R = 287 Дж/(кг град) – удельная газовая постоянная для воздуха и двухатомных газов.
Расход рабочего тела (воздуха) при истечении определяется по уравнению
 ,
м3//с,
(26)
,
м3//с,
(26)
где: F – площадь выходного сечения, м2.
