
- •Раздел 1. Техническая термодинамика
- •Изучение конструкций приборов для измерения параметров состояния рабочих тел
- •Краткие теоретические сведения
- •Типы измерительных приборов
- •Манометрические термометры.
- •Сильфоны.
- •Термоэлектрические термометры – термопары.
- •Жидкостные манометры.
- •Деформационные манометры.
- •Максиметры.
- •Грузопоршневые манометры.
- •Мерные устройства (штихпроберы).
- •Счетчики с крыльчатыми вертушками (радиальные).
- •Счетчики с винтовыми вертушками (осевые).
- •Дросселирование газа диафрагмой (дроссельной шайбой) .
- •Контрольные вопросы
- •Определение газовой постоянной
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов опыта
- •Контрольные вопросы
- •Определение удельной объемной изобарной теплоемкости воздуха
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок проведения опыта
- •Обработка результатов опыта
- •Контрольные вопросы
- •Определение показателя адиабаты для воздуха
- •Краткие теоретические сведения
- •Методика проведения работы
- •Описание установки
- •Порядок проведения опыта
- •Обработка результатов опыта
- •Контрольные вопросы
- •Исследование изохорного процесса
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения опыта
- •Обработка результатов опыта
- •Оценка погрешности
- •Контрольные вопросы
- •Исследование политропного процеса при истечении газа
- •Краткие теоретические сведения
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов исследования
- •Оценка погрешности
- •Контрольные вопросы
- •Определение термодинамических свойств воды и водяного пара
- •Краткие теоретические сведения
- •Описание экспериментальной установки
- •Порядок проведения эксперимента
- •Раздел 2. Теория теплообмена
- •Исследование теплообмена при кипении
- •Краткие теоретические сведения.
- •Теплоотдача при пузырьковом кипении жидкости в условиях свободного движения
- •Эмпирические формулы.
- •Описание установки
- •Формулы используемые при выполнении л.Р.
- •Контрольные вопросы
- •Дополнительные вопросы.
- •Примеры выполнения лабораторной работы.
- •Опеределение коэффициента теплопроводности теплоизоляционного материала методом трубы
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов опыта
- •Оценка погрешности
- •Контрольные вопросы
- •Исследование теплоотдачи от металлического стержня
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов
- •Контрольные вопросы
- •Определение коэффициента теплоотдачи от вертикального цилиндра при свободной конвекции
- •Краткие теоретические сведения
- •Методика выполнения работы
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов
- •Оценка погрешности
- •Контрольные вопросы
- •Исследование теплопередачи в водяном теплообменнике
- •Краткие теоретические сведения
- •Описание экспериментальной установки
- •Порядок выполнения работы
- •Обработка результатов опыта
- •Оценка погрешности
- •Контрольные вопросы
Обработка результатов опыта
Подсчитывают средние значения измеренных величин. По формуле (7) определяют количество теплоты, подведенной к воздуху. Скорость воздуха находят из выражения (10) с использованием уравнений (11), (12). Секундный расход воздуха определяют по формуле (9), объемную изобарную теплоемкость находят из выражения (8). Полученную величину cp’ сравнивают с табличным значением.
Контрольные вопросы
Что называется теплотой? Дайте определение теплоемкости. Что характеризует теплоемкость?
Дайте определение массовой, объемной и мольной теплоемкостей и укажите связь между ними. Каковы размерности теплоемкостей?
От чего зависит теплоемкость идеальных газов?
Как определить теплоемкость при постоянном давлении ср и постоянном объеме сv?
Какова зависимость теплоемкости газов от температуры? Изобразите графически данную зависимость, напишите формулы для определения истинных и средних теплоемкостей и покажите как их найти.
Дайте определение истинной и средней теплоемкостей. Как найти их графическим способом? Как определить среднюю теплоемкость в интервале температур от t1 до t2?
Каковы пределы изменения теплоемкости? Как определяется знак теплоемкости?
Напишите уравнения Майера для массовых и мольных теплоемкостей.
Как определить сv и ср из уравнения Майера и отношения теплоемкостей?
Каковы значения теплоемкостей в изотермическом и адиабатном процессах?
Напишите формулы для определения qp и qv , Qp и Qv.
ЛАБОРАТОРНАЯ РАБОТА 4
Определение показателя адиабаты для воздуха
Цель работы – экспериментальное определение показателя адиабаты k для воздуха и исследование процессов изменения состояния газа.
Краткие теоретические сведения
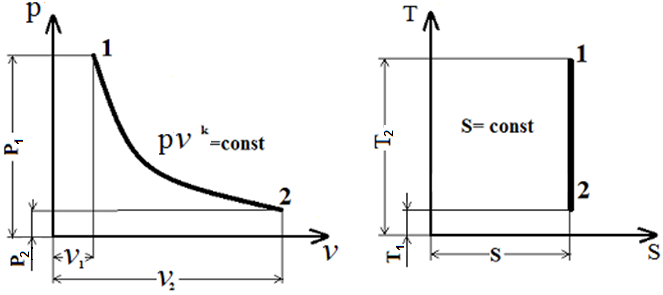
Процесс, протекающий без подвода и отвода теплоты, то есть при отсутствии теплообмена рабочего тела с окружающей средой, называется адиабатным, а график процесса называется адиабатой. Для получения адиабатного процесса необходимым и обязательным условием является q=0.
В реальных условиях адиабатный процесс может быть осуществлен при наличии тепловой изоляции системы от окружающей среды, а также при большой скорости протекания процесса, когда теплообмен с окружающей средой практически отсутствует. Уравнение адиабаты для идеального газа имеет вид:
![]() (13)
(13)
где : p – давление газа, Па;
– удельный объем газа, м3/кг;
k – показатель адиабаты.
Адиабата
в координатах![]() принадлежит
к семейству неравнобоких гиперболических
кривых. На
принадлежит
к семейству неравнобоких гиперболических
кривых. На
![]() диаграмме адиабата изображается прямой,
перпендикулярной оси энтропий. Поскольку
единственным признаком подвода или
отвода теплоты в процессе является
изменение энтропии ∆s,
то адиабатный процесс является
одновременно изоэнтропийным
процессом
s
=
const,
а ∆s=0.
диаграмме адиабата изображается прямой,
перпендикулярной оси энтропий. Поскольку
единственным признаком подвода или
отвода теплоты в процессе является
изменение энтропии ∆s,
то адиабатный процесс является
одновременно изоэнтропийным
процессом
s
=
const,
а ∆s=0.
Величина показателя адиабаты k зависит от атомности газа и равна отношению теплоемкостей при постоянном давлении и постоянном объеме:

Показатели адиабаты идеальных газов определяются на основе молекулярно-кинетической теории газов и они равны:
- для одноатомных газов k=1,67
- для двухатомных газов k=1,4
 -
для многоатомных газов k=1,33
-
для многоатомных газов k=1,33
Так
как k>1,
то адиабата, представленная уравнением
![]() в
p-υ
координатах пойдет круче, чем изотерма
в
p-υ
координатах пойдет круче, чем изотерма
![]() в связи с увеличением удельного объма.
в связи с увеличением удельного объма.
Показатель
адиабаты может быть определен из
уравнения (13), если для адиабатного
процесса известны параметры
![]() ,
,![]() в
начальном и
в
начальном и
![]() в
конечном состоянии. После подстановки
значений этих параметров в уравнение
(13) и его логарифмирования расчетная
формула имеет вид:
в
конечном состоянии. После подстановки
значений этих параметров в уравнение
(13) и его логарифмирования расчетная
формула имеет вид:
![]() или
или
 ,
,
откуда
![]() или
или
 .
(14)
.
(14)
Соотношения между основными параметрами в адиабатном процессе могут быть представлены формулами:
 ;
;
 ;
;
 .
.
Уравнения удельной работы изменения объема, совершаемой телом при адиабатном процессе, имеют вид:
![]()
![]()


Уравнение первого закона термодинамики для адиабатного процесса при q=0 примет вид:
![]()
Изменение внутренней энергии и энтальпии, соответственно, определяются по формулам:
∆u=u2-u1=cv(T2-T1),
∆i=i2-i1=cp(T2-T1)
