
- •Міністерство культури україни київський національний університет культури і мистецтв
- •Система оцінювання знань студентів
- •Підсумкова оцінка
- •Бальна система оцінювання різних форм навчання студента
- •Бальна система оцінювання різних форм навчання студента
- •Бальна система оцінювання різних форм навчання студента
- •Трансформація рейтингової оцінки
- •Тематичний план для студентів денної форми навчання
- •Зміст дисципліни за модулями модуль 1. Механіка
- •Тема 1.1. Вступ. Задачі та структура курсу. Кінематика матеріальної точки
- •Завдання для самостійної роботи
- •Запитання для самоперевірки
- •Тема 1.2. Динаміка матеріальної точки. Робота та енергія Лекція
- •Тема 1.3. Динаміка твердого тіла. Механіка рідин та газів Лекція
- •Практичне заняття
- •Тема 1.4. Спеціальна теорія відносності ейнштейна
- •Питання до іспиту модуль 2. Молекулярна фізика і термодинаміка
- •Тема 2.1. Основи молекулярної фізики. Закони максвелла та больцмана
- •Практичне заняття Завдання для самостійної роботи
- •Запитання для самоперевірки
- •Тема 2.2. Явища переносу. Основи термодинаміки Лекція
- •Практичне заняття Розв’язування задач, використовуючи знання з тем 2.1., 2.2. № 5.2; 5.3; 5.6; 5.10; 5.38; 5.40, 5.78; 5.80; 5.81; 5.85 [15].
- •Можливо ці питання для Завдання? Завдання для самостійної роботи Запитання для самоперевірки
- •Тема 2.3. Неідеальний газ. Рівняння ван-дер-ваальса. Фазові переходи
- •Тема 3.1. Електростатичне поле у вакуумі, в діелектриках
- •Тема 3.2. Провідники в електростатичному полі
- •Тема 3.3. Постійний електричний струм, умови протікання, характеристики
- •Тема 3.4. Магнітне поле в вакуумі
- •Тема 3.5. Магнітне поле в речовині
- •Тема 4.1. Електромагнітні явища
- •Завдання для самостійної роботи Запитання для самоперевірки
- •Тема 4.2. Коливання та хвилі Лекція
- •Практичне заняття
- •Питання до іспиту
- •Тема 5.1. Геометрична оптика
- •Тема 5.2. Хвильова оптика. Явища інтерференції, дифракції, поляризації
- •Тема 5.3. Теплове випромінювання. Квантова природа світла
- •Завдання для самостійної роботи Запитання для самоперевірки
- •Модульна контрольна робота № 5
- •Модуль 6. Елементи атомної фізики та квантової механіки
- •Тема 6.1. Хвильові властивості речовини Лекція
- •Практичне заняття
- •Тема 6.2. Квантова теорія атомів і молекул
- •Тема 6.3. Зонна теорія твердих тіл
- •Тема 6.4. Властивості атомного ядра. Ядерна енергетика
- •Модульна контрольна робота № 6
- •Тематика рефератів
- •Питання до іспиту
- •Методичні рекомендації до підготовки практичих занять
- •Методичні рекомендації до виконання самостійної роботи
- •Методичні рекомендації до виконання модульної контрольної роботи Організація проміжного контролю знань
- •Література Основна
- •Додаткова
Можливо ці питання для Завдання? Завдання для самостійної роботи Запитання для самоперевірки
Який газ є ідеальним?
Визначення теплоємності ідеального газу.
Як розрахувати середню кінетичну енергію молекул?
Що називається явищами переносу?
Від чого залежить середня довжина вільного пробігу молекул? Середня кількість співударів між молекулами?
Що називається теплопровідністю газу?
Як формулюється другий закон термодинаміки?
Література: 1, 8, 13, 14.
Тема 2.3. Неідеальний газ. Рівняння ван-дер-ваальса. Фазові переходи
Лекція
Ізотерми реального газу. Врахування взаємодії між молекулами. Рівняння Ван-дер-Ваальса. Ізотерми Ван-дер-Ваальса. Фазові переходи першого та другого роду. Критичний стан. Внутрішня енергія. Особливості рідкого та твердого стану речовини.
Практичне заняття
Завдання для самостійної роботи
Розглянути і ознайомитися з порівнянням ізотерм Ван-дер-Ваальса з експериментальними ізотермами реального газу.
Знати формулу Клайперона-Клаузіса.
Запитання для самоперевірки
В чому відмінність реальних газів від ідеальних?
Співставити рівняння Ван-дер-Ваальса та рівняння Мендєлєєва-Клапейрона.
Дати визначення фази фазових переходів, умови фазової рівноваги, плавлення і кристалізація, випаровування і конденсації, сублімації, потрійної точки, фазові переходи другого роду.
Література: 1, 8, 13, 14.
МОДУЛЬНА КОНТРОЛЬНА РОБОТА № 2
Дати письмові відповіді на питання
Основні уявлення молекулярно–кінетичної теорії.
Статистичний метод дослідження в фізиці.
Термодинамічні параметри. Рівняння Клайперона – Менделєєва.
Основне рівняння кінетичної теорії газів.
Швидкість та енергія газових молекул. Розподіл Максвела.
Газ у полі тяжіння. Барометрична формула.
Розподіл частинок у зовнішньому потенціальному полі ( розподіл Больцмана).
Явища переносу в газах. Поняття про дифузію, внутрішнє тертя та теплопровідність газів.
Число стикань та довжина вільного пробігу молекул.
Закони дифузії, теплопровідності та внутрішнього тертя газів.
Перший закон термодинаміки.
Теплоємність газів.
Внутрішня енергія різних газів ( енергія поступального, обертального та коливального руху молекул ).
Зворотній та незворотній процеси з газами. Коловий процес.
Цикл Карно та його ККД для ідеального газу.
Другий закон термодинаміки.
Направленість необоротних теплових процесів. Поняття ентропії.
Реальні гази. Рівняння стану реального газу (рівняння Ван–дер–Ваальса).
Фазові переходи. Критичний стан речовини.
Особливості твердого та рідкого стану речовини.
Розв’язати задачі
Деяку кількість одноатомного ідеального газу стискають адіабатично до тих пір, поки тиск не перевищить початковий в 10 разів. Потім газ розширюється ізотермічно до початкового об’єму. В скільки разів кінцевий тиск газу перевищує початковий тиск ?
Ідеальний газ з
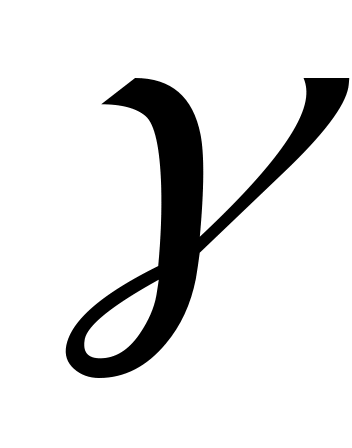 = 1,4, що знаходився при температурі
= 1,4, що знаходився при температурі
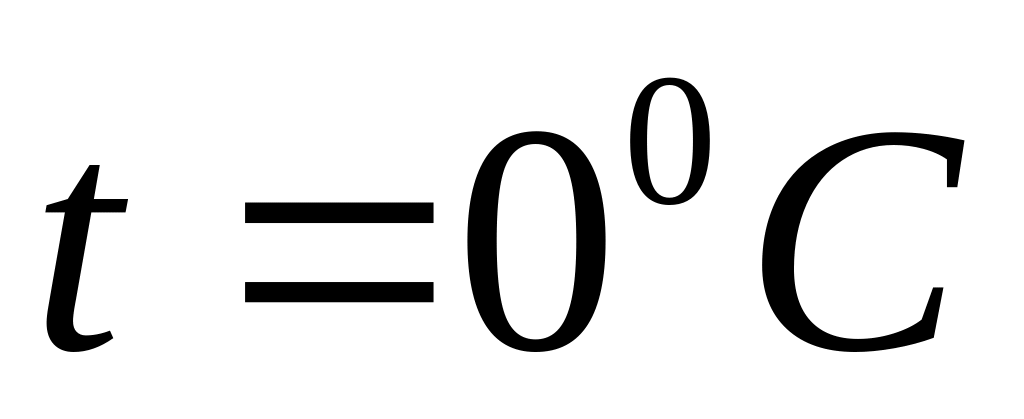 ,
стискають адіабатично , в результаті
чого : а) об’єм газу зменшується в 10
разів; б) тиск газу збільшується в 10
разів. Визначити, до якої температури
нагрівається газ в результаті стискання.
,
стискають адіабатично , в результаті
чого : а) об’єм газу зменшується в 10
разів; б) тиск газу збільшується в 10
разів. Визначити, до якої температури
нагрівається газ в результаті стискання.Температура в кімнаті об’єму піднялась від значення
 до значення
до значення
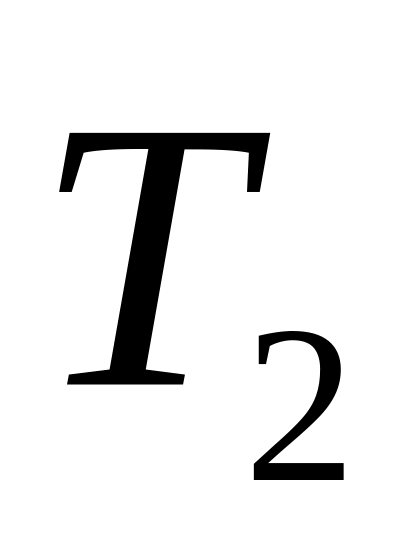 .
Як змінилася при цьому внутрішня енергія
повітря в кімнаті? Атмосферний тиск не
змінюється.
.
Як змінилася при цьому внутрішня енергія
повітря в кімнаті? Атмосферний тиск не
змінюється.Атмосферний тиск змінився від
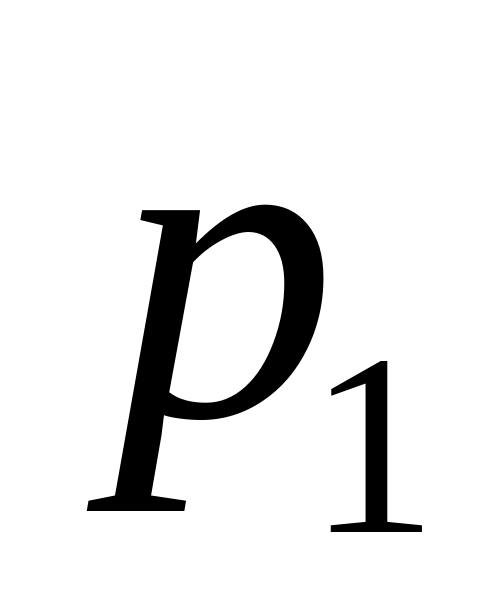 = 983 гПа до
= 983 гПа до
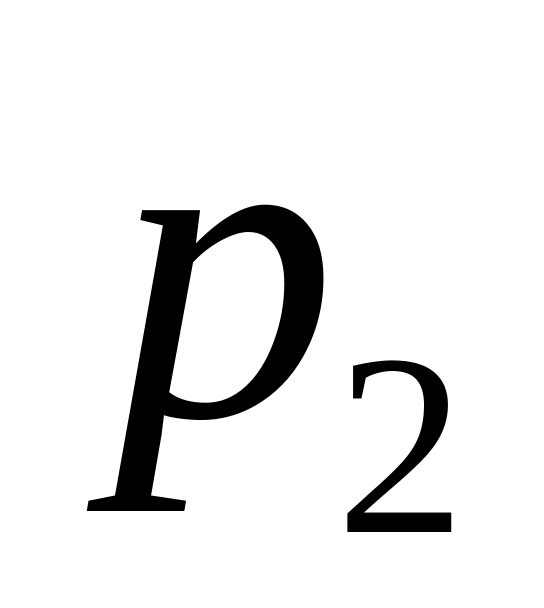 = 1003 гПа. Який приріст одержує при цьому
внутрішня енергія повітря, що міститься
в кімнаті об’єму V=50
= 1003 гПа. Який приріст одержує при цьому
внутрішня енергія повітря, що міститься
в кімнаті об’єму V=50
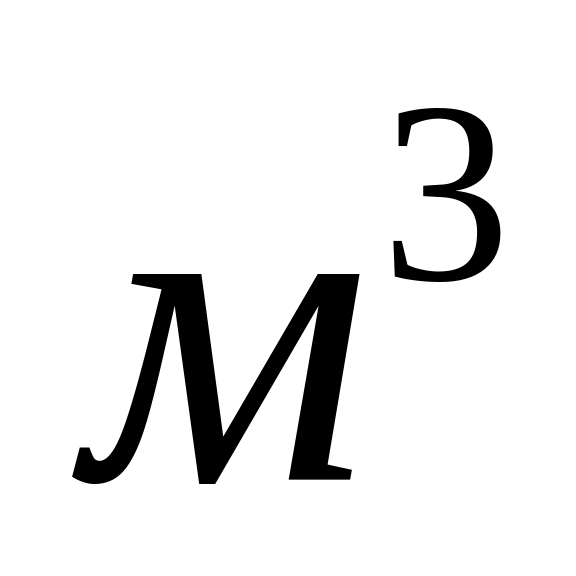 ?
Температура в кімнаті не змінилася.
?
Температура в кімнаті не змінилася.Деяка кількість ідеального газу з одноатомними молекулами здійснила при
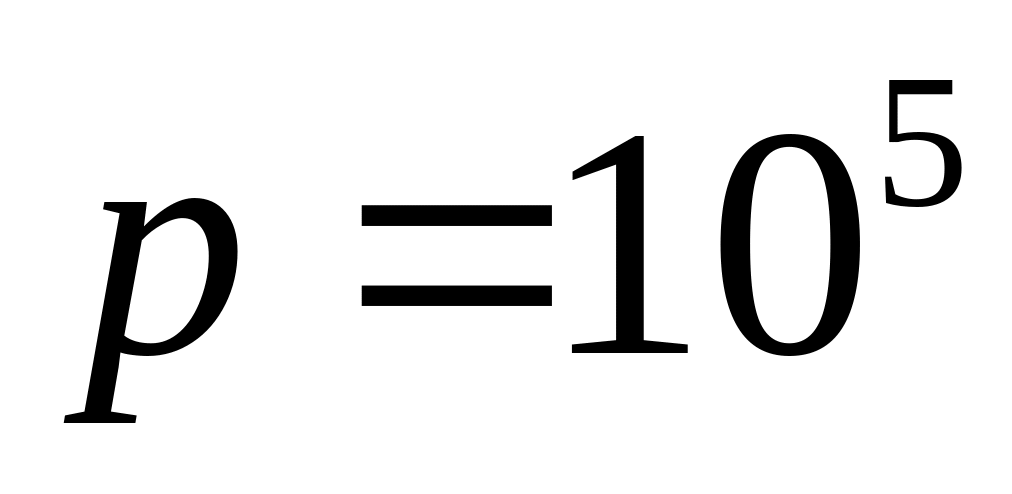 Па оборотний ізобаричний процес, в ході
якого об’єм газу змінився від значення
Па оборотний ізобаричний процес, в ході
якого об’єм газу змінився від значення
 = 10 л до значення
= 10 л до значення
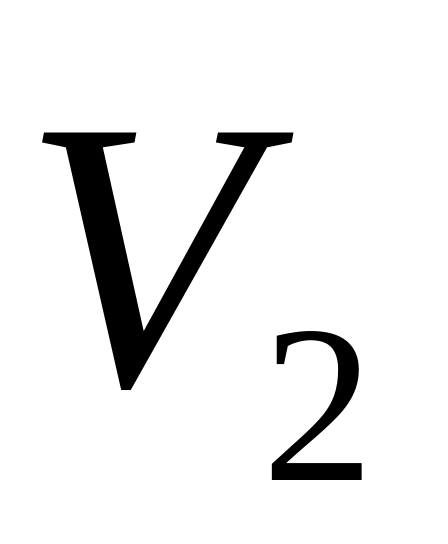 = 20 л. Визначити: а) приріст внутрішньої
енергії; б) здійснену газом роботу; в)
кількість одержаного газом тепла.
= 20 л. Визначити: а) приріст внутрішньої
енергії; б) здійснену газом роботу; в)
кількість одержаного газом тепла.Ідеальний газ з
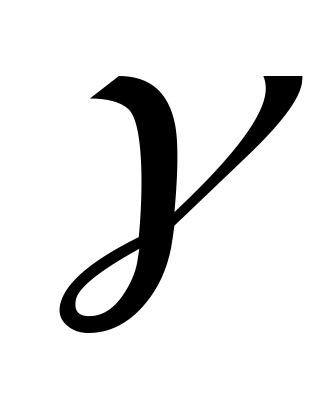 = 1,4 розширюється ізотермічно від об’єму
= 0,1
до об’єму
= 1,4 розширюється ізотермічно від об’єму
= 0,1
до об’єму
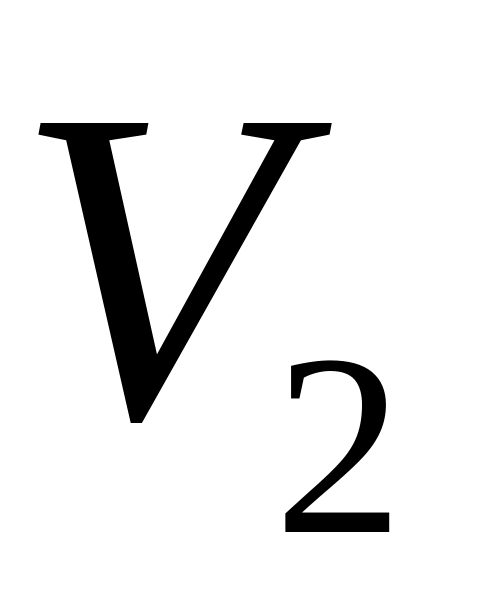 = 0,3
= 0,3
 .
Кінцевий тиск газу
.
Кінцевий тиск газу
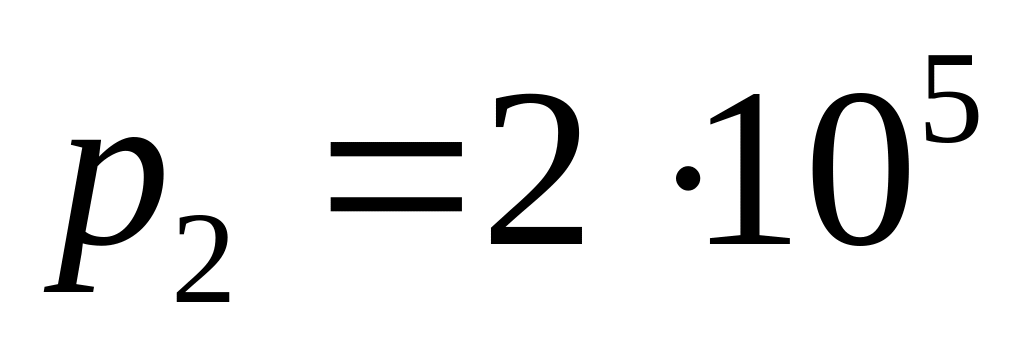 Па. Визначити: а) приріст внутрішньої
енергії; б) здійсненну газом роботу; в)
кількість одержаного газом тепла.
Па. Визначити: а) приріст внутрішньої
енергії; б) здійсненну газом роботу; в)
кількість одержаного газом тепла.
При ізобаричному нагріванні від 0 до
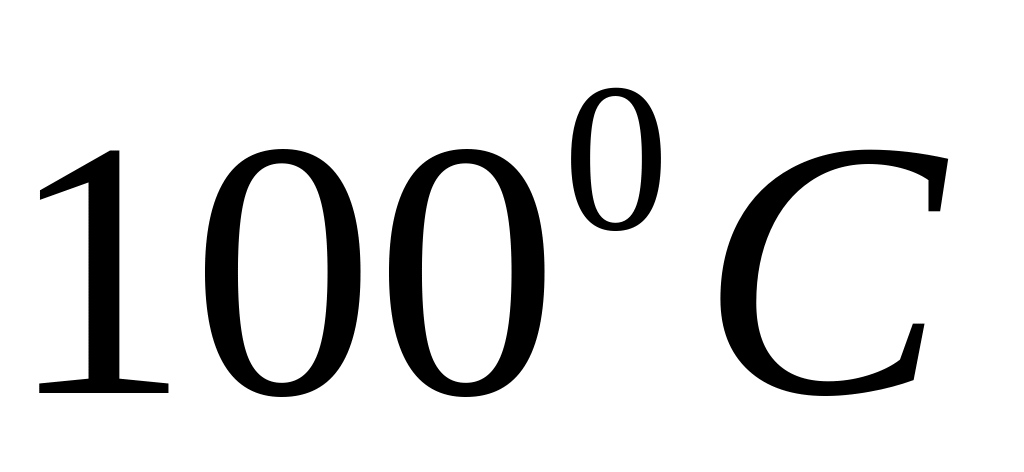 моль ідеального газу одержує Q=3,35 кДж
тепла. Визначити : а) значення
,
б) приріст внутрішньої енергії газу,
в) здійснену газом роботу.
моль ідеального газу одержує Q=3,35 кДж
тепла. Визначити : а) значення
,
б) приріст внутрішньої енергії газу,
в) здійснену газом роботу.Моль ідеального газу, що мав температуру
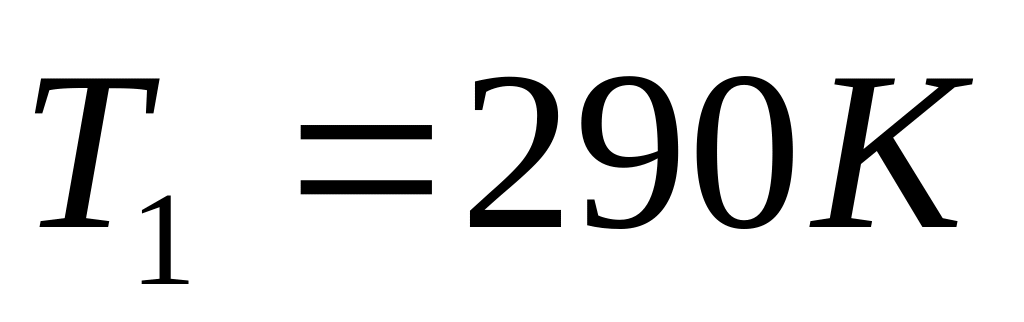 , розширюється ізобарично доки його
об’єм не збільшиться вдвічі. Потім газ
охолоджується ізохорично до початкової
температури. Визначити: а) приріст
внутрішньої енергії газу, б) роботу,
здійснювану газом, в) кількість отриманого
газом тепла.
, розширюється ізобарично доки його
об’єм не збільшиться вдвічі. Потім газ
охолоджується ізохорично до початкової
температури. Визначити: а) приріст
внутрішньої енергії газу, б) роботу,
здійснювану газом, в) кількість отриманого
газом тепла.Деяка кількість ідеального газу з трьохатомними жорсткими молекулами перейшла адіабатично із стану з температурою
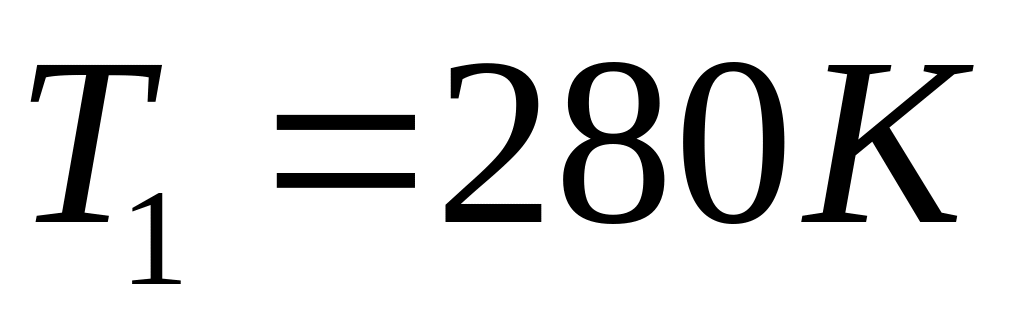 до стану, що характеризується значеннями
параметрів:
до стану, що характеризується значеннями
параметрів:
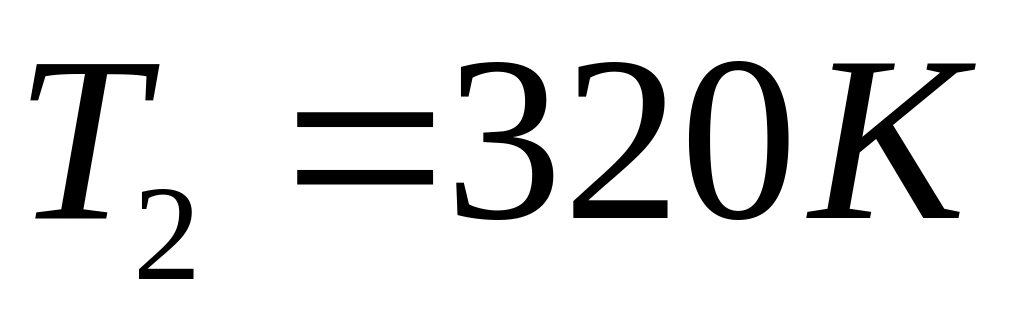 ,
Па,
,
Па,
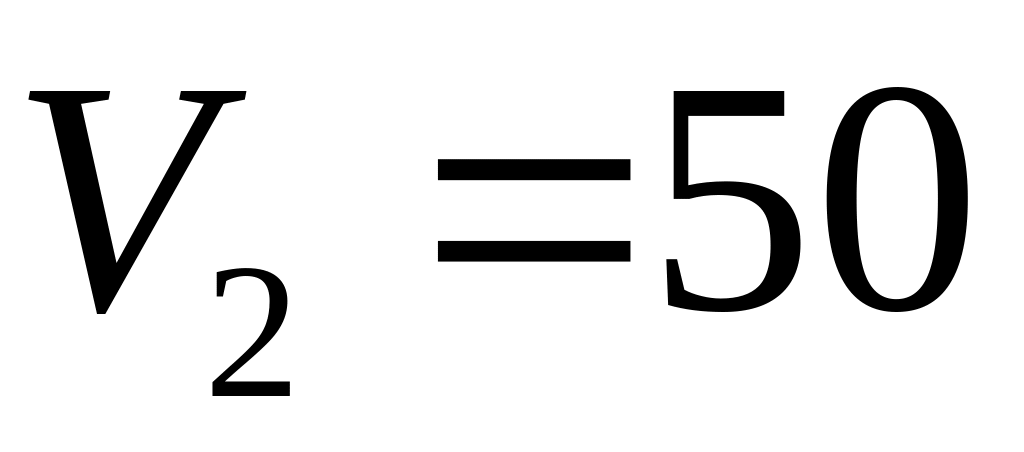 л. Яку роботу здійснює при цьому газ?
л. Яку роботу здійснює при цьому газ?Деяку кількість одноатомного ідеального газу стискають адіабатично доки його тиск не перевищить початковий в 10 разів. Потім газ розширюють ізотермічно до початкового об’єму. В скільки разів кінцевий тиск перевищить початковий?
Скільки молекул водню знаходиться в об’ємі 1,55 л при температурі
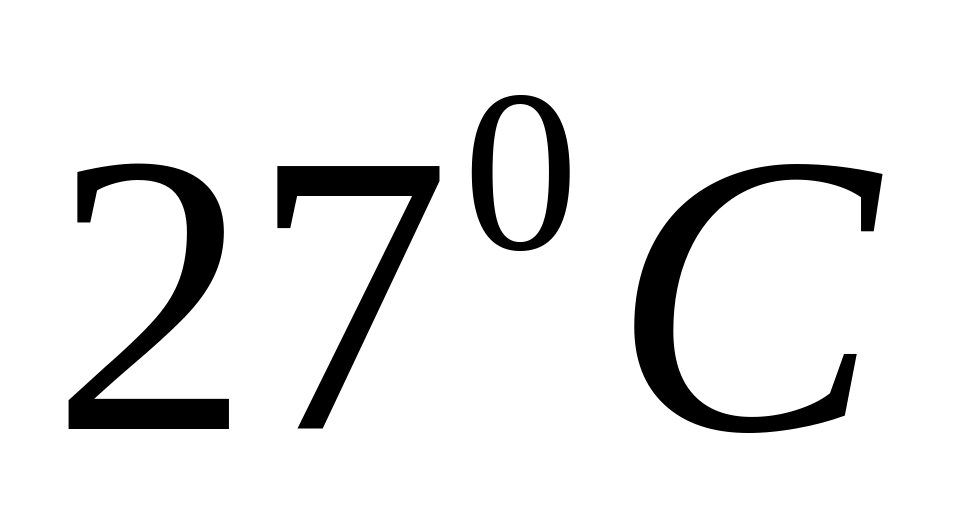 та тиску 750 мм рт.ст.?
та тиску 750 мм рт.ст.?Знайти число молекул в
 1
1
 та густину азоту при тиску
та густину азоту при тиску
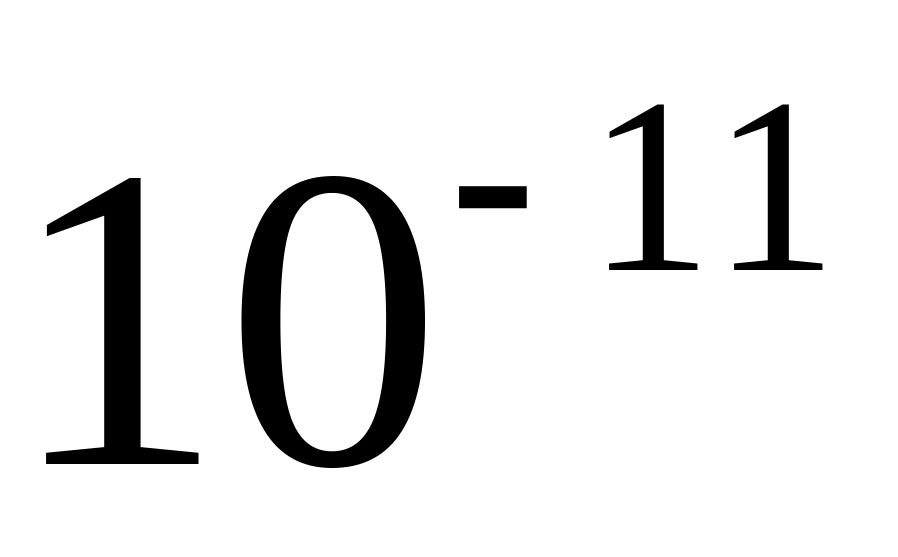 мм рт. ст. та температурі
мм рт. ст. та температурі
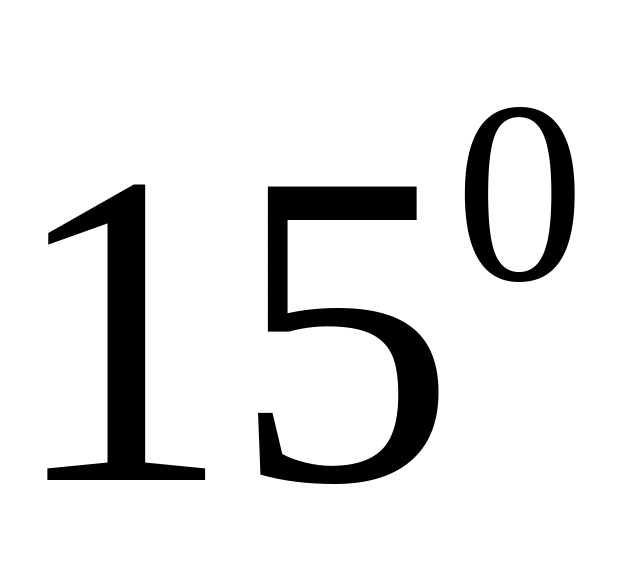 .
.В балоні, об’єм якого
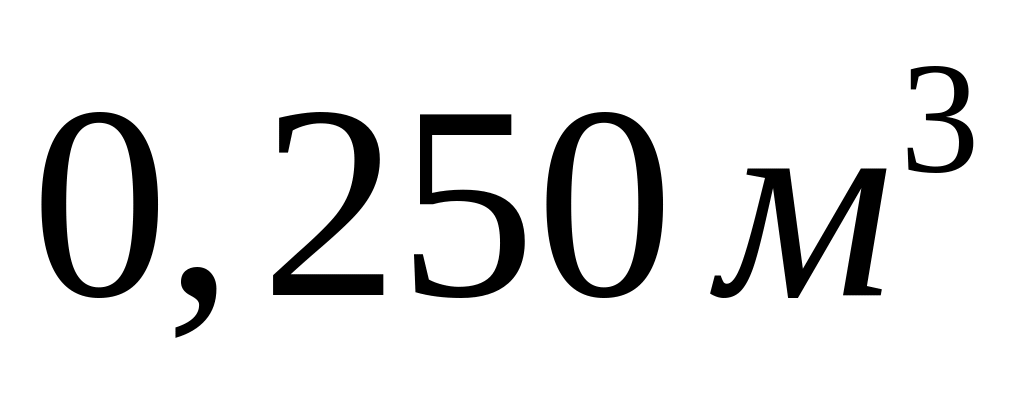 ,
знаходиться суміш вуглекислого газу
та водяної пари при температурі
,
знаходиться суміш вуглекислого газу
та водяної пари при температурі
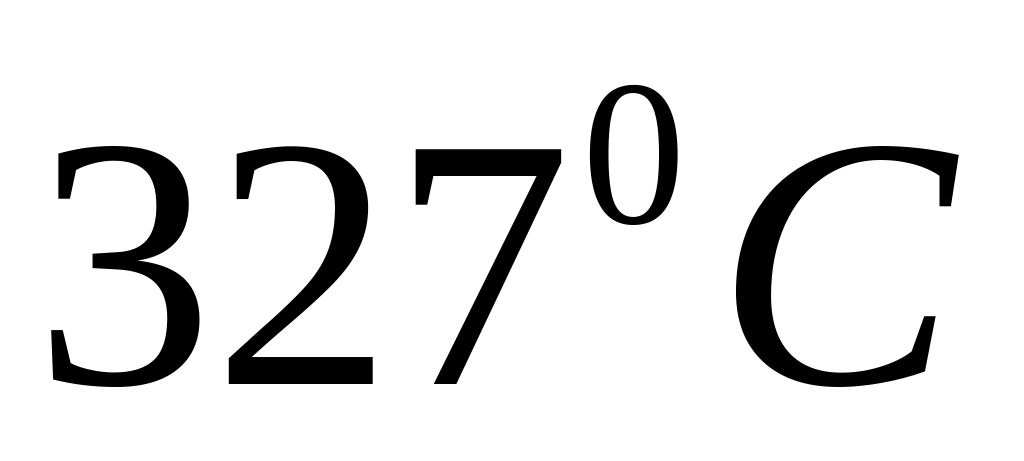 .
Число молекул вуглекислого газу
.
Число молекул вуглекислого газу
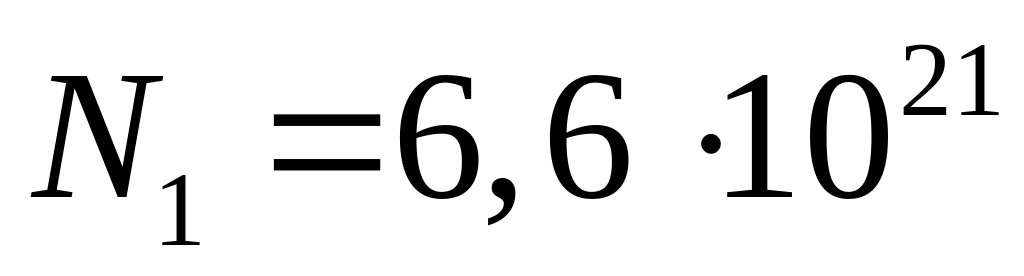 ,
число молекул водяної пари
,
число молекул водяної пари
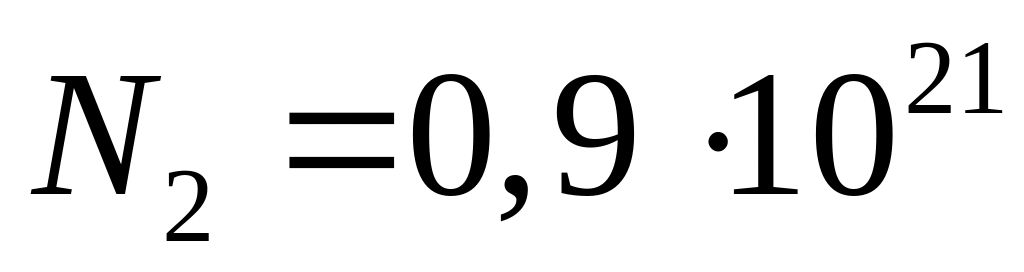 .
Визначити тиск та молекулярну масу
газової суміші.
.
Визначити тиск та молекулярну масу
газової суміші.Густина газу, що складається з суміші гелію та аргону при тиску 15 атм та температурі
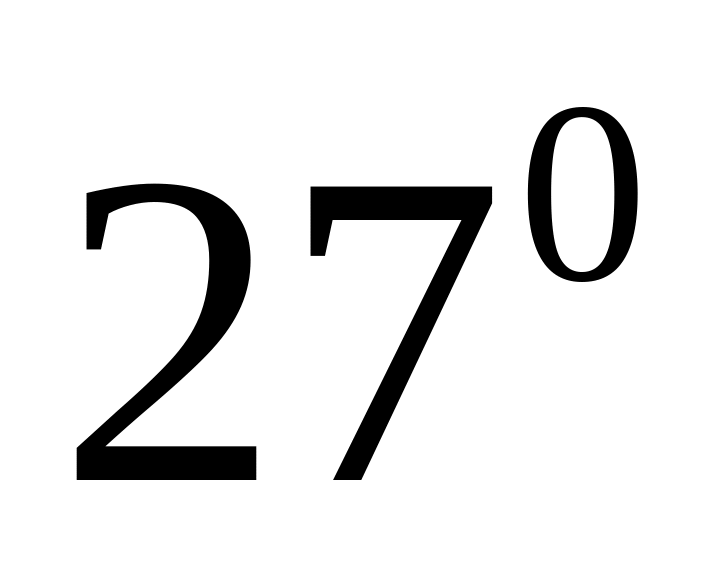 ,
дорівнює 2 г/л. Скільки атомів гелію
міститься в 1
,
дорівнює 2 г/л. Скільки атомів гелію
міститься в 1
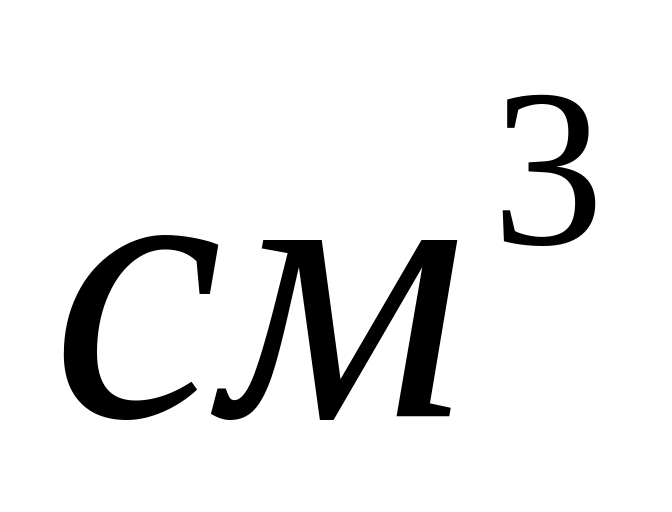 газової суміші ?
газової суміші ?Теплоізольований сосуд з азотом рухається зі швидкістю v=86 м/с. Температура газу
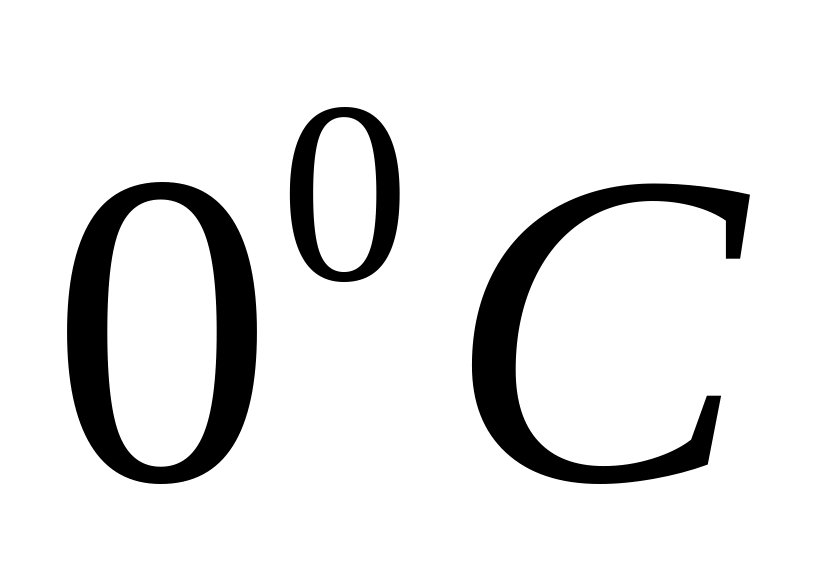 .
Якою буде середня енергія поступального
руху молекул, якщо сосуд зупинити ?
.
Якою буде середня енергія поступального
руху молекул, якщо сосуд зупинити ?
Знайти середню довжину вільного пробігу молекули водню при температурі
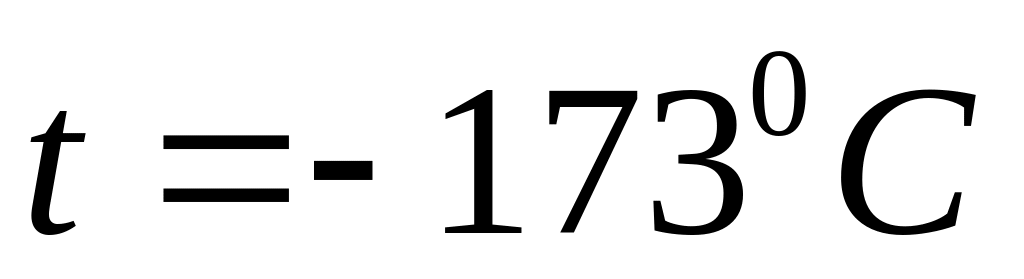 та тиску
та тиску
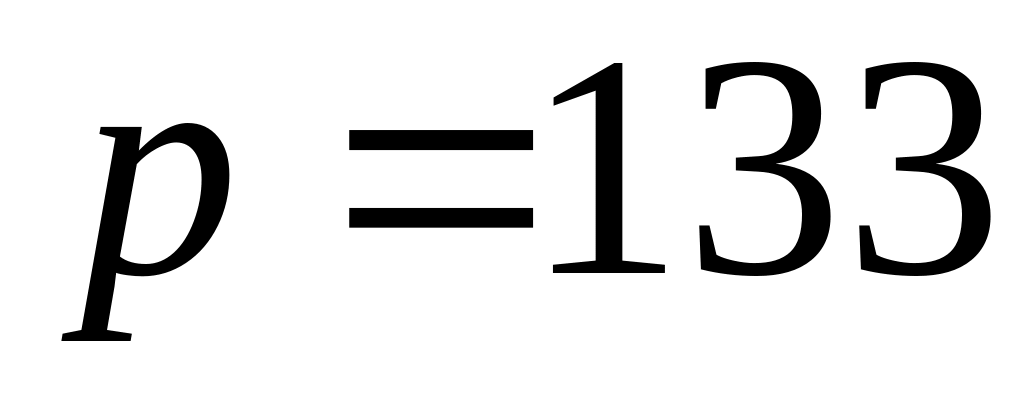 мПа.
мПа.Оцінити середню довжину вільного пробігу та коефіцієнт дифузії іонів в водневій плазмі. Температура плазми
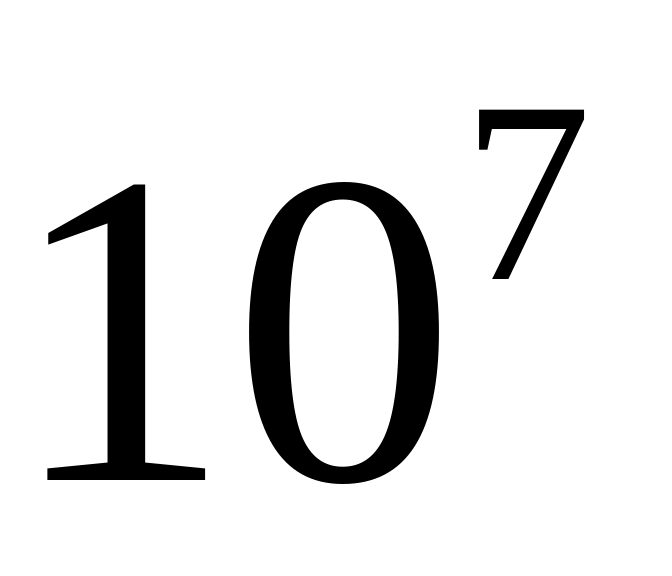 К, число іонів в 1
плазми дорівнює
К, число іонів в 1
плазми дорівнює
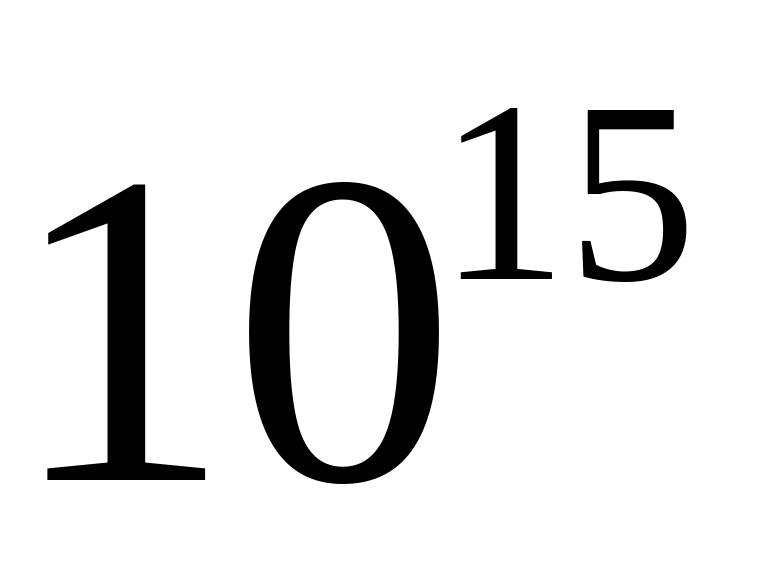 .
При даній температурі ефективний
переріз іона водню вважати рівним
.
При даній температурі ефективний
переріз іона водню вважати рівним
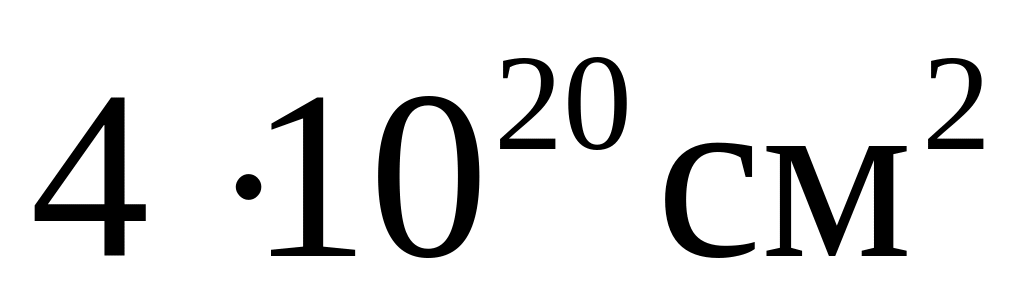 .
.При якому тиску середня довжина вільного пробігу молекул кисню дорівнює 1,25 м, якщо температура газу
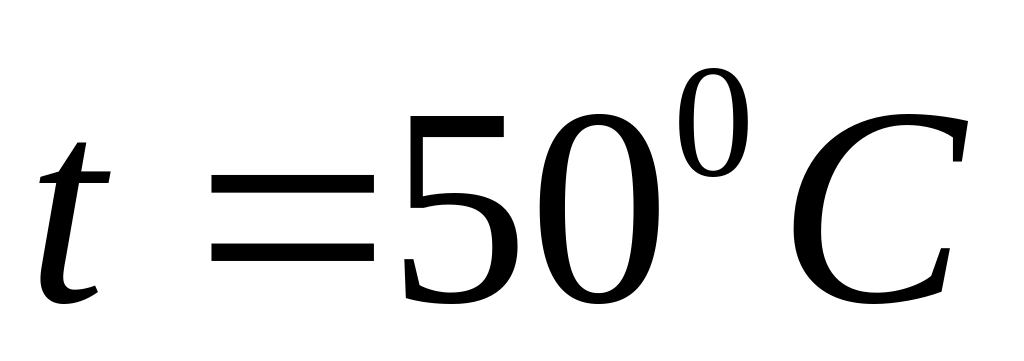 .
.В сосуді ємністю 200 см
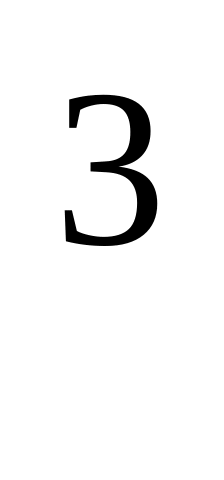 міститься газ при температурі
міститься газ при температурі
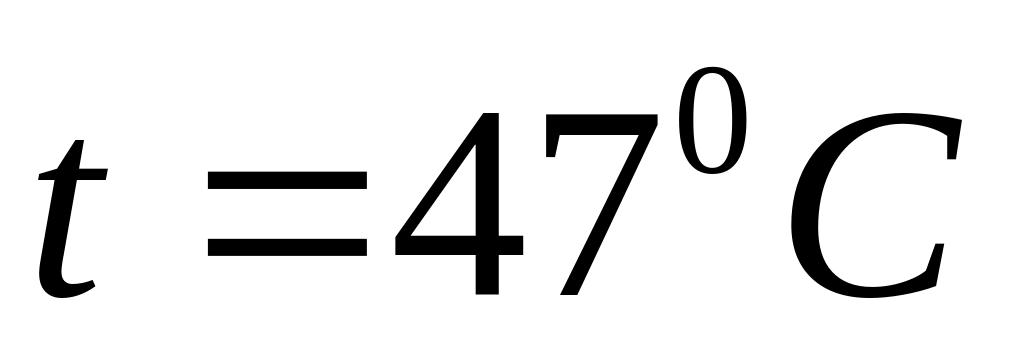 .
На скільки зменшиться тиск в сосуді,
якщо з нього видалити
.
На скільки зменшиться тиск в сосуді,
якщо з нього видалити
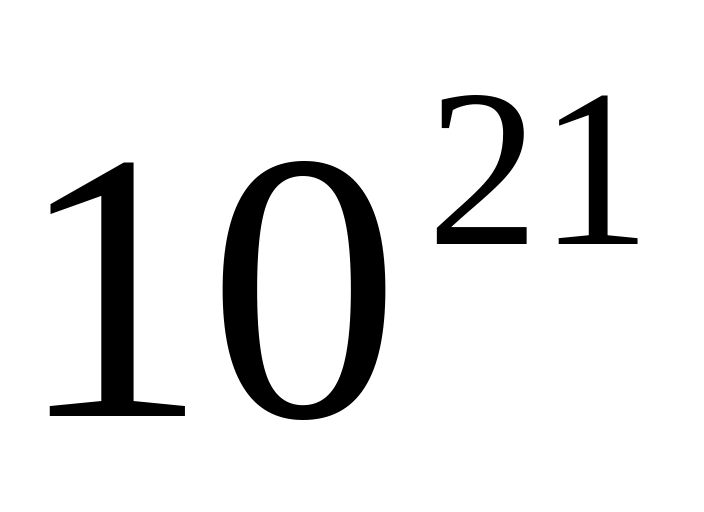 молекул ?
молекул ?Скільки молекул водню міститься в посудині ємністю 2л, якщо середньоквадратична швидкість руху молекул 500 м/с, а тиск на стінки посудини
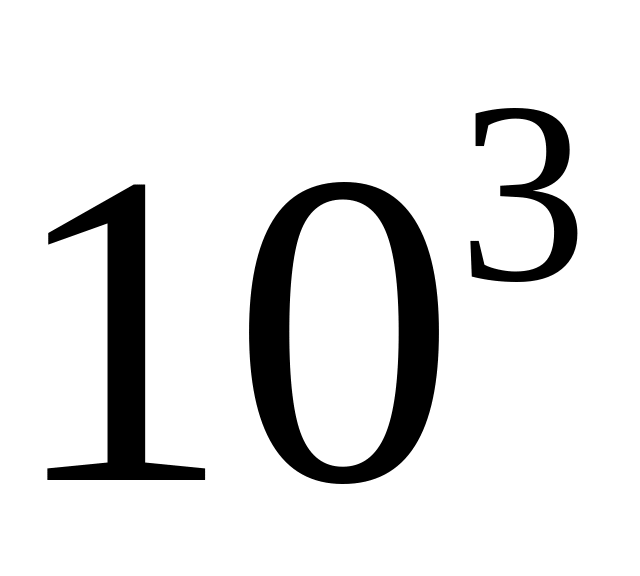 Па ?
Па ?Двохатомний газ адіабатично розширюється до об’єму, вдвічі більшого від початкового. Визначити, як зміниться коефіцієнт теплопровідності
 та коефіцієнт дифузії
та коефіцієнт дифузії
 газу. Вважати молекули жорсткими, а
ефективний діаметр молекул незмінним.
газу. Вважати молекули жорсткими, а
ефективний діаметр молекул незмінним.Тиск двохатомного газу після стискання збільшується в 10 разів. Визначити, як зміниться довжина вільного пробігу в газі
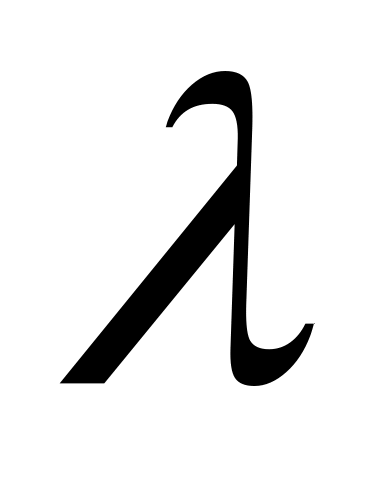 та коефіцієнт в’язкості
та коефіцієнт в’язкості
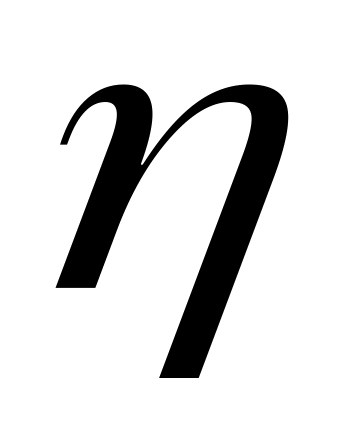 .
Розглянути випадки, коли стискання
відбувається а) ізотермічно; б)
адіабатично. Вважати молекули жорсткими,
а ефективний диаметр молекул незмінним.
.
Розглянути випадки, коли стискання
відбувається а) ізотермічно; б)
адіабатично. Вважати молекули жорсткими,
а ефективний диаметр молекул незмінним.Ідеальний газ, що знаходився в деякому початковому стані з об’ємом , розширюється до об’єму . Процес проходить: а) ізобарично; б) ізотермічно; в) адіабатично. Намалювати графіки цих процесів на діаграмах
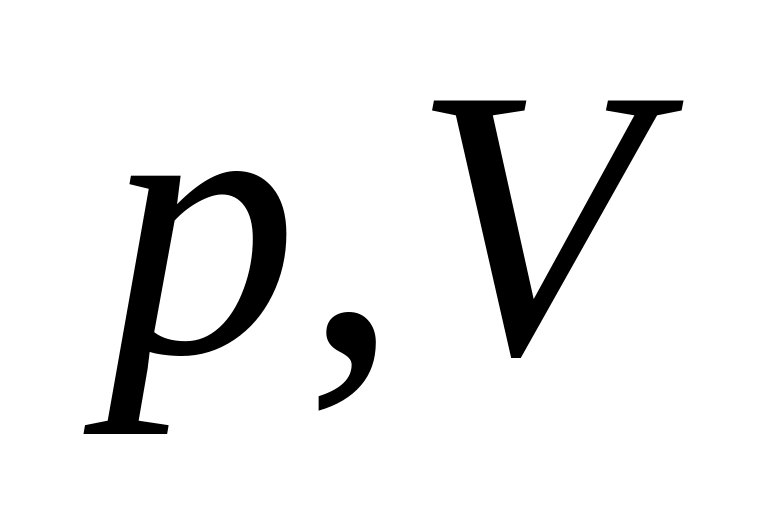 та
та
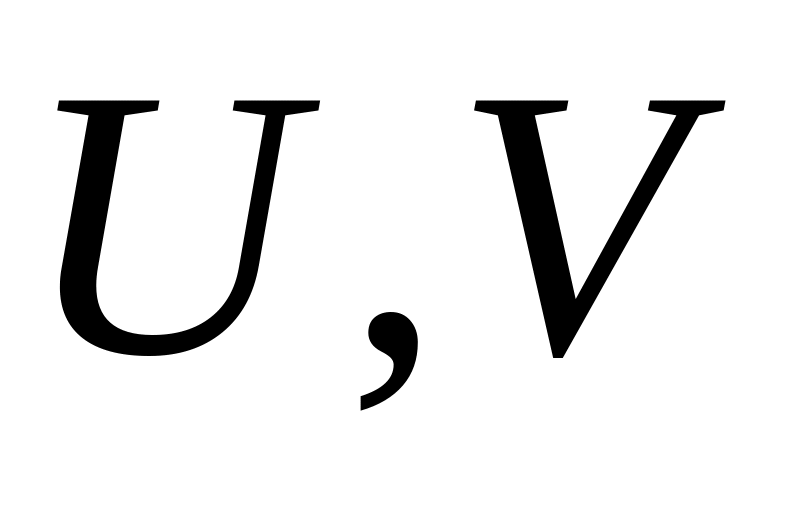 .
На основі аналізу графіків визначити:
а) при якому процесі виконана газом
робота найменша; б) знак приросту
внутрішньої енергії газу при кожному
процесі.
.
На основі аналізу графіків визначити:
а) при якому процесі виконана газом
робота найменша; б) знак приросту
внутрішньої енергії газу при кожному
процесі.В закритому сосуді об’ємом 2,5 л знаходиться водень при температурі
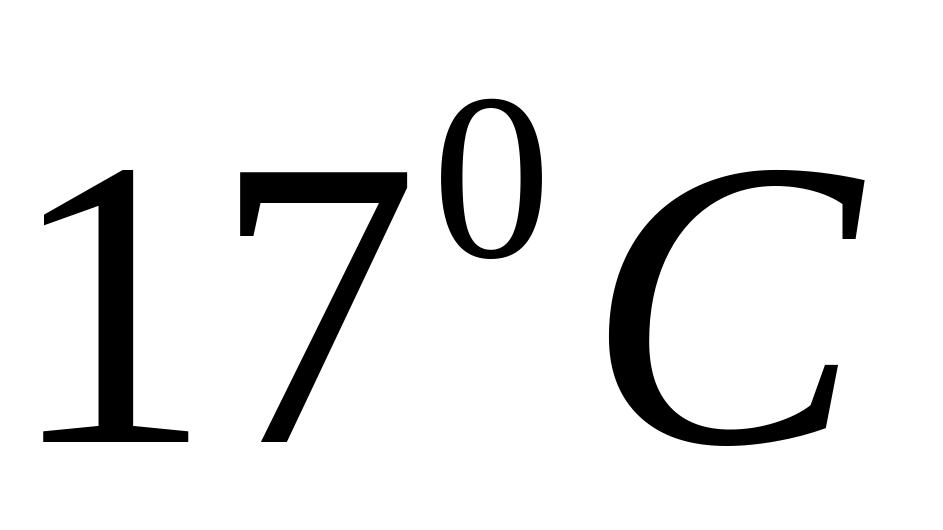 та тиску 100 мм рт. ст. Водень охолоджують
до температури
.
Знайти кількість відданого газом тепла
та приріст внутрішньої енергії водню.
та тиску 100 мм рт. ст. Водень охолоджують
до температури
.
Знайти кількість відданого газом тепла
та приріст внутрішньої енергії водню.Один кіломоль газу ізобарично нагрівається від
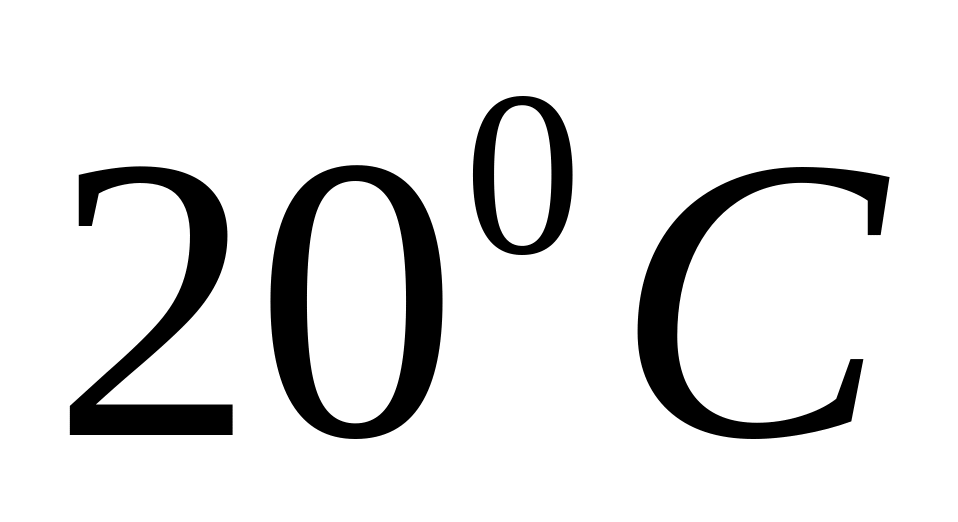 до
до
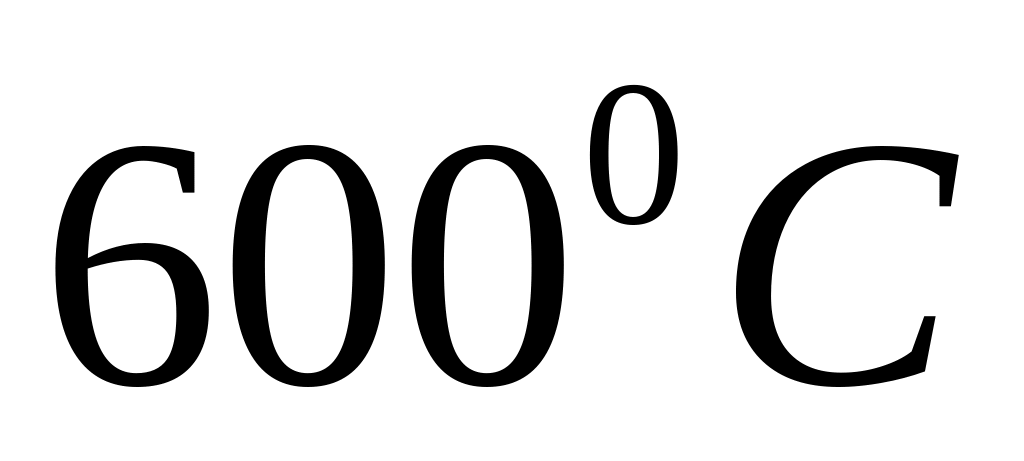 ,
при цьому газ поглинає
,
при цьому газ поглинає
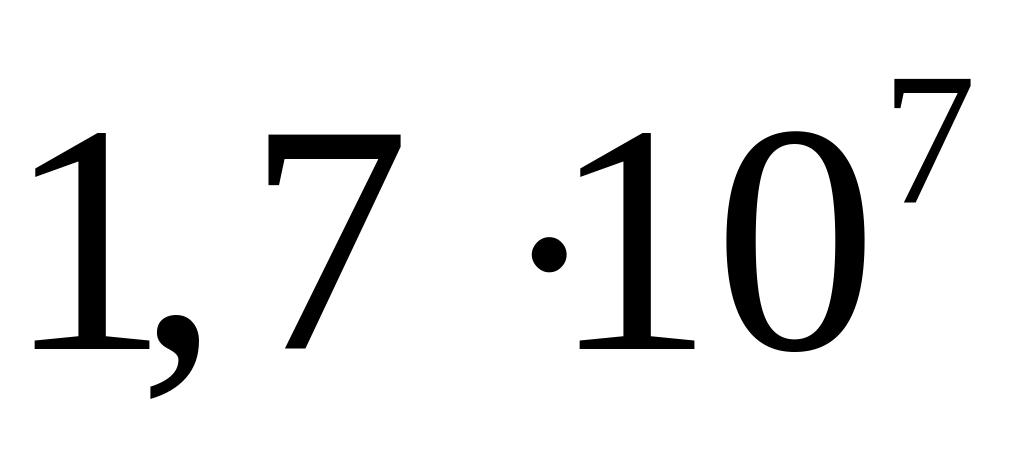 Дж тепла. Знайти число ступенів вільності
молекули газу, приріст внутрішньої
енергії та роботу газу.
Дж тепла. Знайти число ступенів вільності
молекули газу, приріст внутрішньої
енергії та роботу газу.Густина газу при тиску
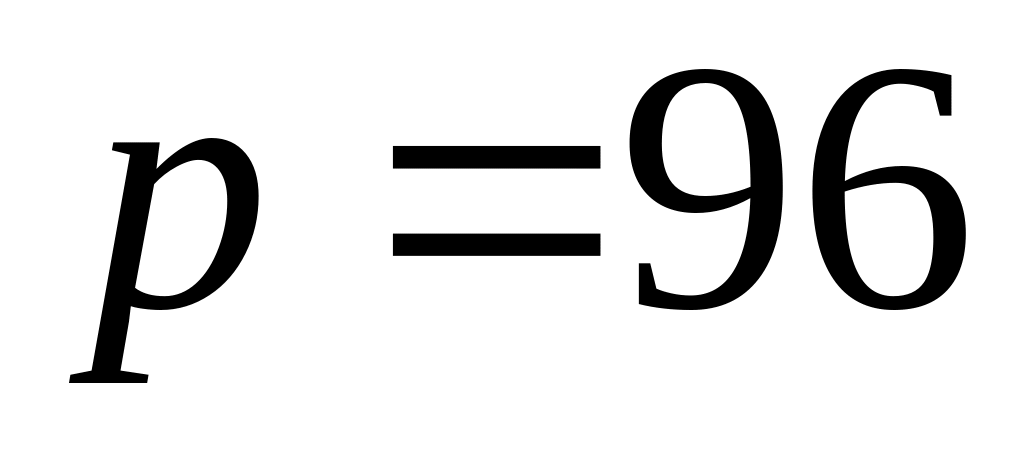 кПа та температурі
дорівнює
кПа та температурі
дорівнює
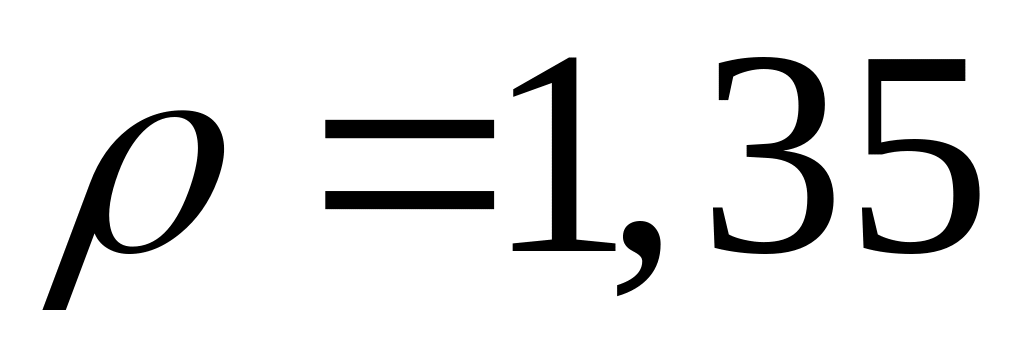 г/л. Знайти молярну масу газу.
г/л. Знайти молярну масу газу.Визначити тиск газу, що містить
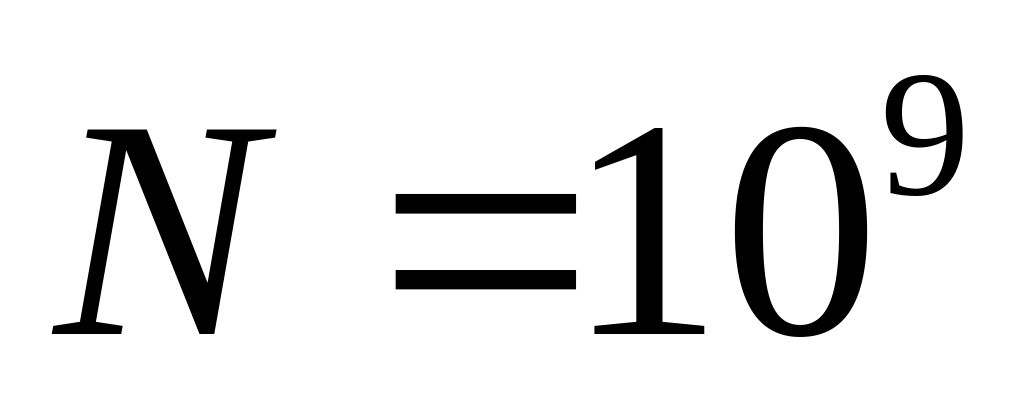 молекул в об’ємі
молекул в об’ємі
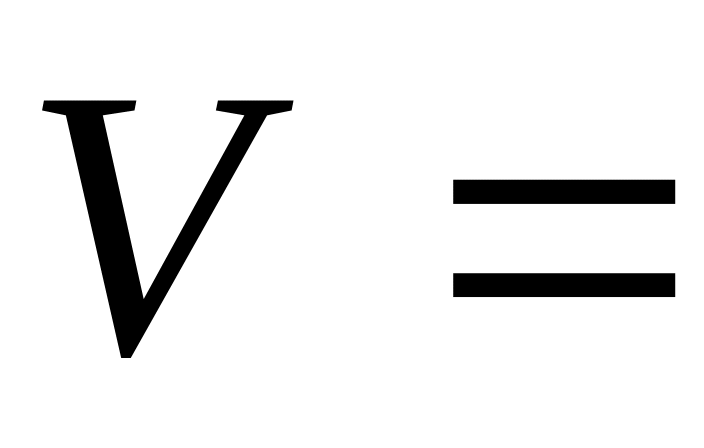 1
см
при температурі 1000 К.
1
см
при температурі 1000 К.Який об’єм займає суміш азоту масою
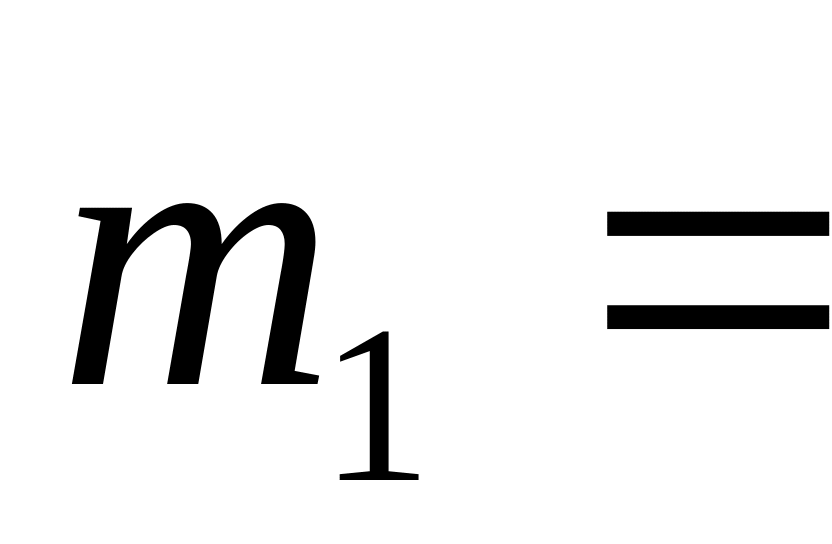 1
кг та гелію масою
1
кг та гелію масою
 1
кг при нормальних умовах?
1
кг при нормальних умовах?В об’ємі 15 л знаходиться суміш, що містить 10 г водню, =54 г водяної пари та
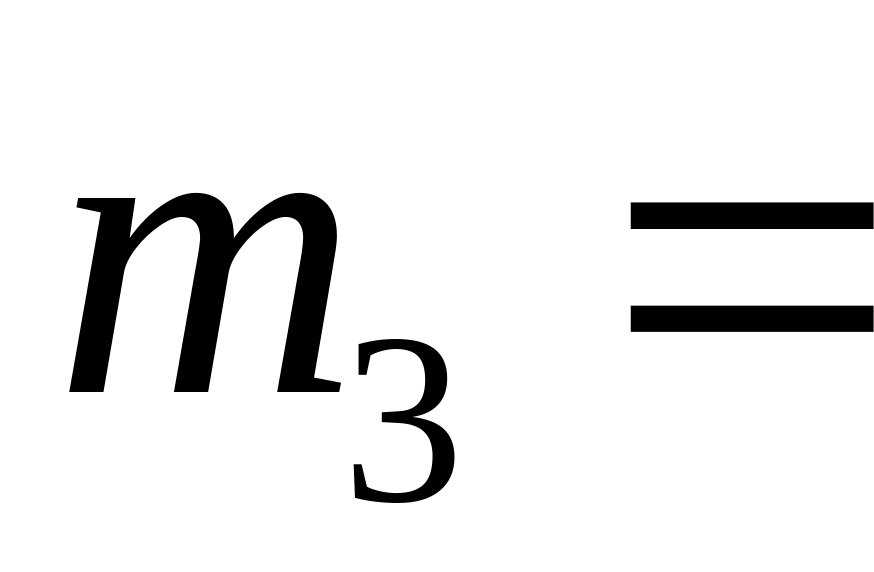 60
г оксиду вуглецю. Температура суміші
60
г оксиду вуглецю. Температура суміші
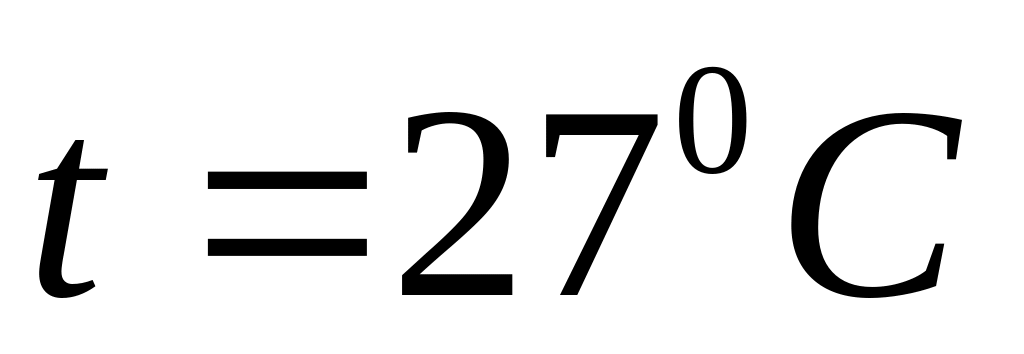 .
Визначити тиск.
.
Визначити тиск.Визначити питомі теплоємності
 і
і
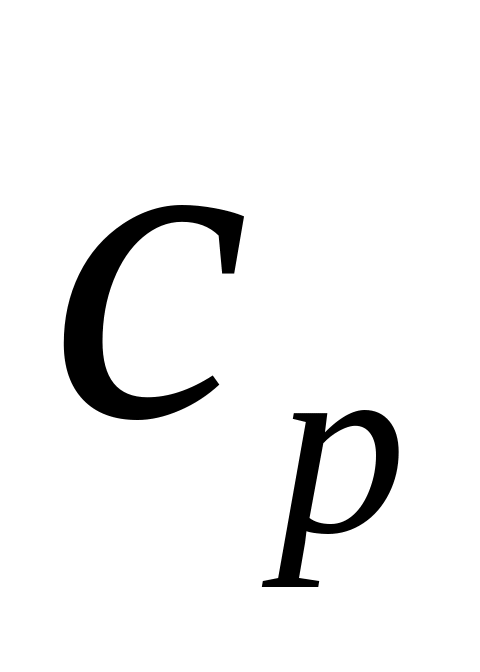 для газоподібного оксиду вуглецю
для газоподібного оксиду вуглецю
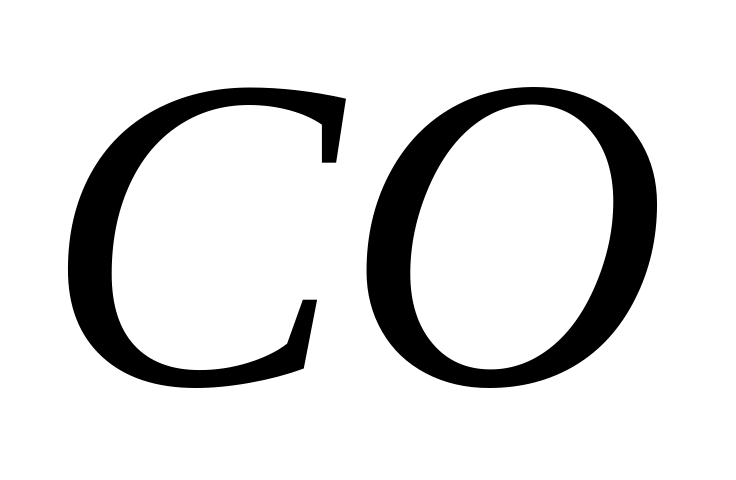 .
.
Молекула газу складається з двох атомів. Різниця питомих теплоємкостей газу при сталих тиску та об’єму дорівнює 260 Дж/(кг К). Знайти молярну масу газу та його питомі теплоємності і .
Ідеальний газ здійснює цикл, що складається з двох ізотерм та двох ізохор. Як поводить себе внутрішня енергія та ентропія на різних ділянках циклу ? На яких ділянках циклу здійснена газом робота та отримана ним кількість тепла більше нуля ?
Ідеальний газ здійснює цикл, що складається з двох адіабат та двох ізобар. Як поводить себе внутрішня енергія та ентропія на різних ділянках циклу ? На яких ділянках циклу здійснена газом робота та отримана ним кількість тепла більше нуля ?
Нагрівається чи охолоджується ідеальний газ, якщо він розширюється за законом
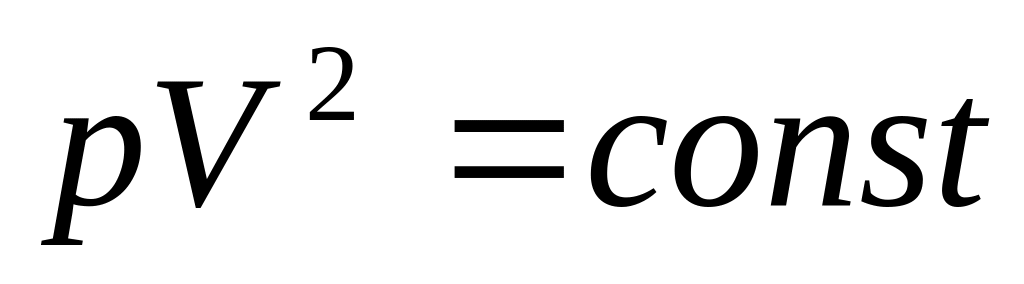 ?
?Нагрівається чи охолоджується ідеальний газ, якщо його стискають за законом ?
Нагрівається чи охолоджується ідеальний газ, якщо він розширюється за законом
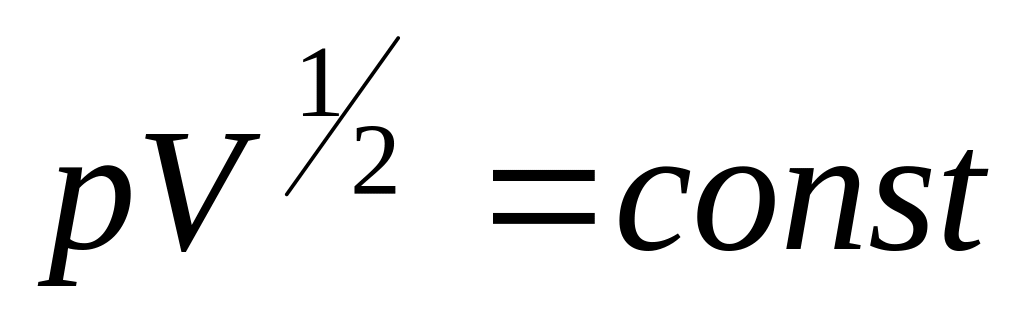 ?
?Нагрівається чи охолоджується ідеальний газ, якщо його стискають за законом
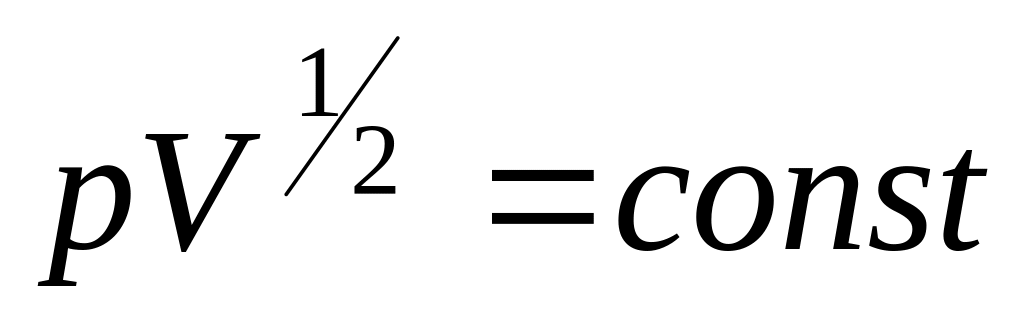 ?
?Водень займає об’єм 10 м при тиску
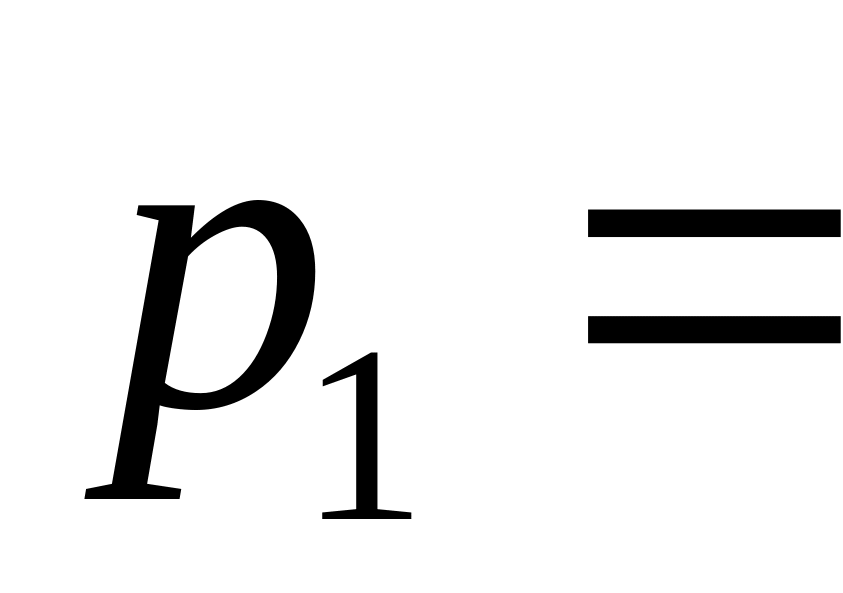 0,1
МПа. Його нагріли при сталому об’ємі
до тиску
0,1
МПа. Його нагріли при сталому об’ємі
до тиску
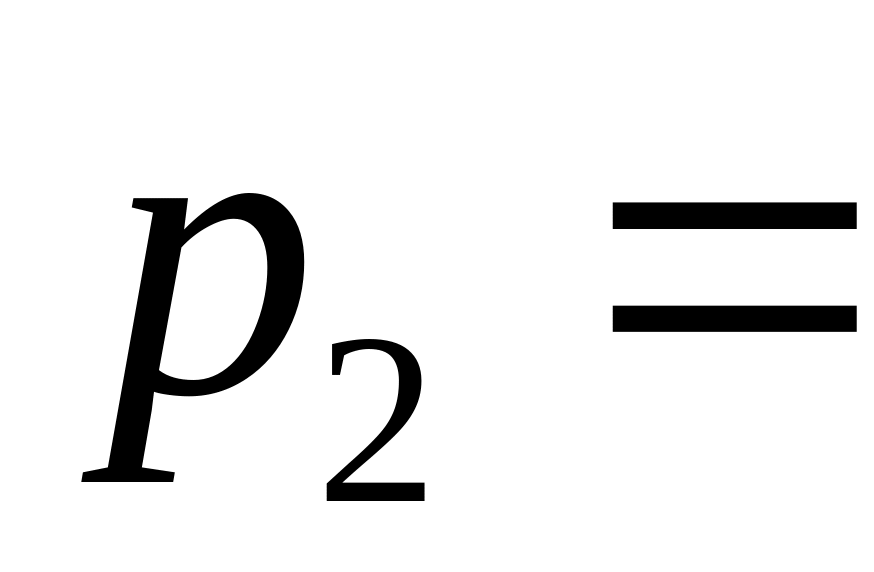 0,3
МПа. Визначити зміну внутрішньої
енергії, виконану газом роботу та
кількість одержаного газом тепла.
0,3
МПа. Визначити зміну внутрішньої
енергії, виконану газом роботу та
кількість одержаного газом тепла.Кисень при незмінному тиску
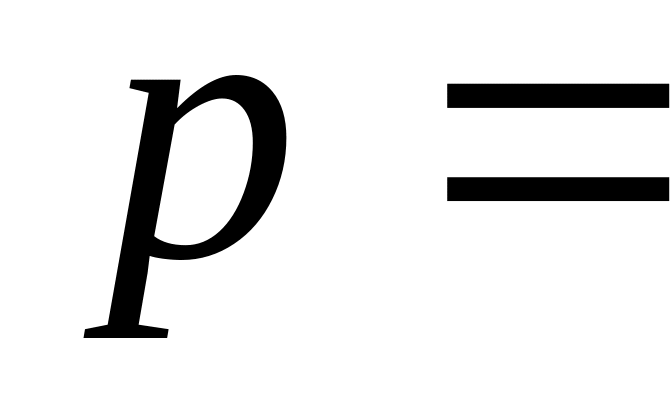 80
кПа нагрівають. При цьому його об’єм
збільшується від
80
кПа нагрівають. При цьому його об’єм
збільшується від
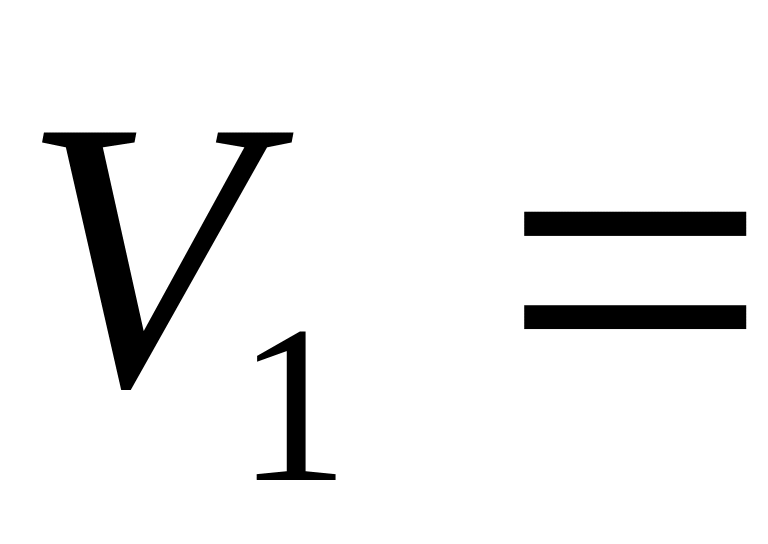 1м
до
1м
до
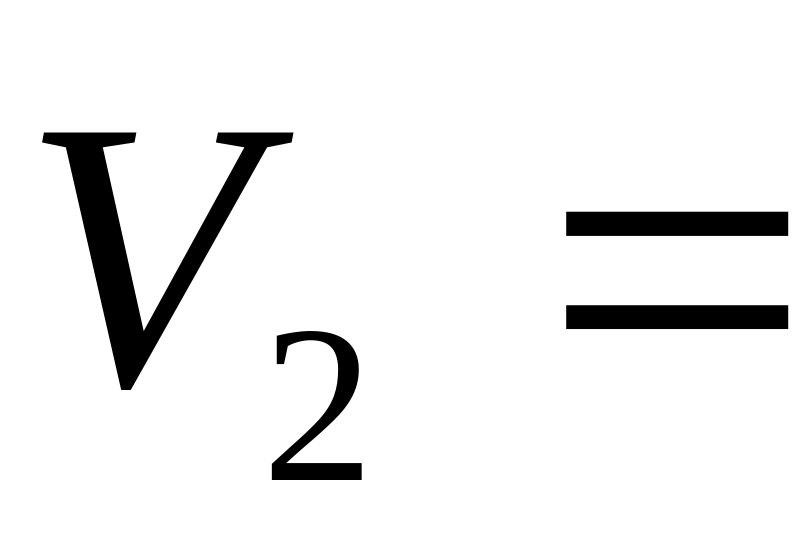 3м
.
Визначити зміну внутрішньої енергії,
виконану газом роботу та кількість
одержаного газом тепла.
3м
.
Визначити зміну внутрішньої енергії,
виконану газом роботу та кількість
одержаного газом тепла.В циліндрі під поршнем знаходиться азот, що має масу
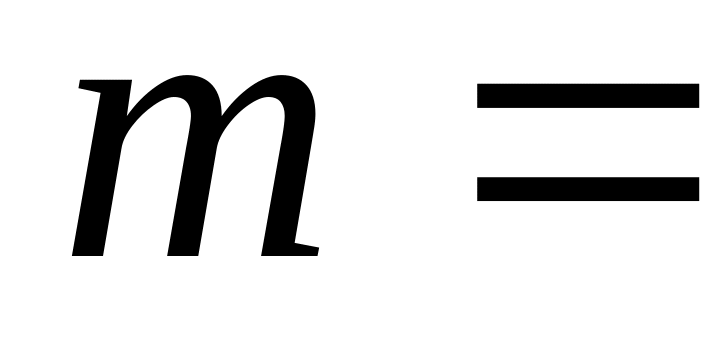 0,6
кг та займає об’єм
1,2
м
,
при температурі
0,6
кг та займає об’єм
1,2
м
,
при температурі
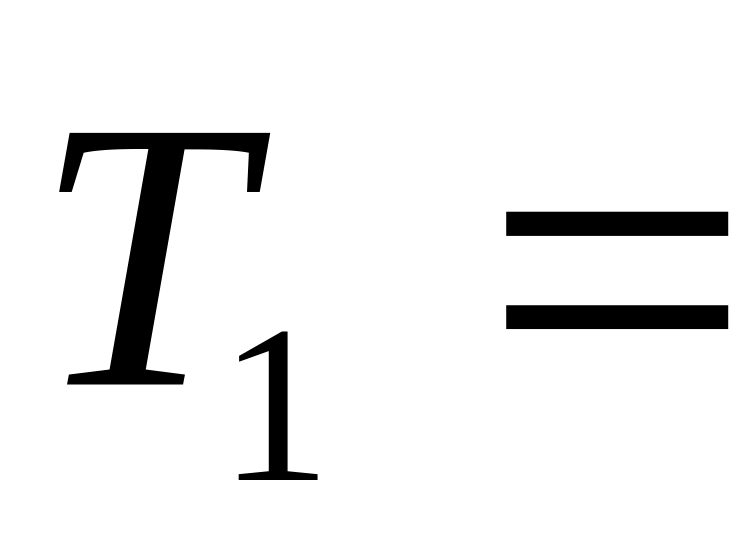 560
К. В результаті нагрівання газ розширився
та зайняв об’єм
4,2
м
,
причому температура не змінилася.
Визначити зміну внутрішньої енергії,
виконану газом роботу та кількість
одержаного газом тепла.
560
К. В результаті нагрівання газ розширився
та зайняв об’єм
4,2
м
,
причому температура не змінилася.
Визначити зміну внутрішньої енергії,
виконану газом роботу та кількість
одержаного газом тепла.
МОДУЛЬ 3. ЕЛЕКТРОМАГНЕТИЗМ
