
- •Міністерсво освіти і науки україни
- •Конспект лекцій
- •Білки та амінокислоти Загальна характеристика білків.
- •Амінокислоти.
- •Нуклеїнові кислоти
- •Властивості і будова днк
- •Структури днк.
- •Будова і функції рнк
- •Структура рнк.
- •Типи рнк.
- •Нуклеозиди і нуклеотиди
- •Назви нуклеозидів та нуклеотидів
- •Вуглеводи
- •Біологічна роль вуглеводів:
- •Моносахариди.
- •Метилглікозид
- •Окремі представники моносахаридів:
- •Олігосахариди
- •Полісахариди.
- •Амілоза
- •Амілопектин
- •Вторинні речовини рослинного походження
- •Органічні кислоти
- •Дубильні речовини
- •Ефірні масла та смоли.
- •Терпени.
- •Циклічні ефірні масла.
- •Каучук і гумма – політерпени.
- •Ростові речовини та антибіотики.
- •Нейтральні жири
- •Стериди
- •Фосфоліпіди
- •Запитання і вправи для самоконтролю:
- •Класифікація і номенклатура вітамінів
- •Жиророзчинні вітаміни
- •Водорозчинні вітаміни
- •Ферменти
- •Прості ферменти
- •Складні ферменти
- •Активний центр ферментів
- •Механізм дії ферментів
- •Властивості ферментів
- •Кінетика ферментативних реакцій
- •Номенклатура і класифікація ферментів
- •Характеристика окремих класів ферментів
- •1. Окисдоредуктази
- •2. Трансферази
- •3. Гідролази
- •Піровиноградна кислота Оцтовий альдегід
- •Аспарагінова кислота Фумарова кислота
- •5. Ізомерази
- •6. Лігази (синтетази)
- •Локалізація ферментів у клітині
- •Використання ферментів
- •Запитання і вправи для самоконтролю:
- •Обмін речовин Анаеробний розклад вуглеводів.
- •Г o ch2oh oh oh ho oh o ho oh глюкоза глюкозо-6-фосфат адф I II ліколіз
- •Бродіння
- •Спиртове бродіння
- •Аеробне окислення вуглеводів.
- •Ацетил - КоА
- •Щавелево-оцтова кислота
- •Теорія біологічного окислювання
- •Розпад ліпідів
- •Окиснення гліцерину
- •Окиснення насичених жирних кислот
- •Енергетика -окиснення жирних кислот
- •Біосинтез ліпідів Біосинтез гліцерину
- •Біосинтез жирних кислот
- •Біосинтез тригліцеридів
- •Основні перетворення ліпідів у харчовій промисловості
- •Запитання і вправи для самоконтролю:
- •Катаболізм амінокислот.
- •Орнітиновий цикл синтезу сечовини:
- •Біосинтез білку.
Кінетика ферментативних реакцій
Вивчаючи кінетику ферментативних реакцій, дослідники відзначили їх відмінність від звичайних хімічних реакцій. За малих концентрацій речовин, що вступають в реакцію, тобто субстрату, спостерігається закономірність, яка є характерною для звичайних хімічних реакцій: швидкість реакції пропорційна концентрації субстрату. При збільшенні концентрації субстрату швидкість реакції, як і в хімічних процесах, знаходиться в складній залежності від ряду причин. Однак при подальшому збільшенні концентрації субстрату швидкість ферментативної реакції стабілізується та припиняє залежати від концентрації субстрату. Це значить, що в процесі ферментативної реакції відбувається насичення ферменту субстратом.
Ферментативну реакцію можна зобразити в вигляді рівняння:
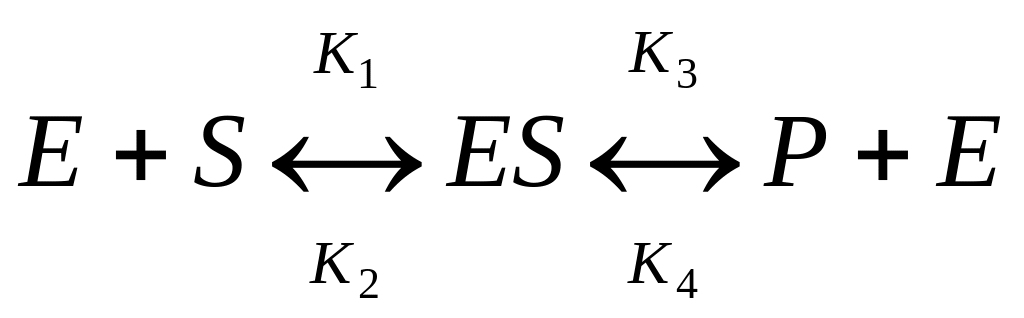 ,
,
де Е – фермент; S – субстрат; ES – фермент-субстратний комплекс; Р – продукт реакції.
Співвідношення К2/К1=КS має назву константи дисоціації.
Рівняння Міхаеліса-Ментена для визначення швидкості ферментативної реакції має вигляд:
![]() .
.
В подальшому Дж. Б. Холдейн та Д. Бріггс удосконалили залежність Міхаеліса-Ментена:
![]() .
.
Це рівняння відрізняється від попереднього тільки константою Km, яка має більше значення, ніж константа KS, оскільки вона дозволяє певною мірою враховувати вплив кінцевого продукту реакції.
Співвідношення
![]() називається константою Міхаеліса.
називається константою Міхаеліса.
Константа Міхаеліса відповідає концентрації субстрату, при якій швидкість ферментативної реакції дорівнює половині її максимальної швидкості.
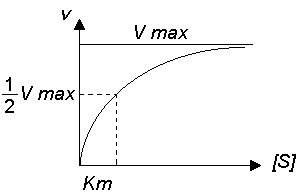
Рис.1. Залежність швидкості реакції від концентрації субстрату
Оброблюючи рівняння Міхаеліса-Ментена методом подвійних зворотних величин можна отримати рівняння прямої лінії типу у=ах+b, а саме:
![]() .
.
Це рівняння є лінеаризацією залежності Міхаеліса-Ментена та називається рівнянням Лайнуівера-Берка.
Номенклатура і класифікація ферментів
За новою систематичною номенклатурою назви ферментів складаються з двох частин. Перша частина вказує на назву субстрату, на який діє фермент, а друга – на природу хімічної реакції, яку він каталізує, з додаванням суфікса -аза.
В основу класифікації ферментів покладено принцип розподілу їх за типами хімічних реакцій, які вони каталізують. На цій основі усі ферменти поділяють на шість класів.
Оксидоредуктази – каталізують окислювально-відновні процеси.
Трансферази – прискорюють реакції перенесення окремих атомів і груп атомів від одних субстратів до інших.
Гідролази – каталізують гідролітичні реакції.
Ліази – каталізують процеси відщеплення яких-небудь груп не гідролітичним шляхом з утворенням подвійного зв’язку або, навпаки, приєднання відповідних груп атомів по місцю подвійного зв’язку.
Ізомерази – прискорюють процеси ізомеризації органічних сполук.
Лігази (синтетази) – каталізують реакції синтезу, які пов’язані з використанням енергії АТФ та деяких інших трифосфатів.
Класи ферментів поділено на підкласи, а останні – на підпідкласи. До підпідкласу входять уже окремі представники ферментів.
Характеристика окремих класів ферментів
