
- •Міністерсво освіти і науки україни
- •Конспект лекцій
- •Білки та амінокислоти Загальна характеристика білків.
- •Амінокислоти.
- •Нуклеїнові кислоти
- •Властивості і будова днк
- •Структури днк.
- •Будова і функції рнк
- •Структура рнк.
- •Типи рнк.
- •Нуклеозиди і нуклеотиди
- •Назви нуклеозидів та нуклеотидів
- •Вуглеводи
- •Біологічна роль вуглеводів:
- •Моносахариди.
- •Метилглікозид
- •Окремі представники моносахаридів:
- •Олігосахариди
- •Полісахариди.
- •Амілоза
- •Амілопектин
- •Вторинні речовини рослинного походження
- •Органічні кислоти
- •Дубильні речовини
- •Ефірні масла та смоли.
- •Терпени.
- •Циклічні ефірні масла.
- •Каучук і гумма – політерпени.
- •Ростові речовини та антибіотики.
- •Нейтральні жири
- •Стериди
- •Фосфоліпіди
- •Запитання і вправи для самоконтролю:
- •Класифікація і номенклатура вітамінів
- •Жиророзчинні вітаміни
- •Водорозчинні вітаміни
- •Ферменти
- •Прості ферменти
- •Складні ферменти
- •Активний центр ферментів
- •Механізм дії ферментів
- •Властивості ферментів
- •Кінетика ферментативних реакцій
- •Номенклатура і класифікація ферментів
- •Характеристика окремих класів ферментів
- •1. Окисдоредуктази
- •2. Трансферази
- •3. Гідролази
- •Піровиноградна кислота Оцтовий альдегід
- •Аспарагінова кислота Фумарова кислота
- •5. Ізомерази
- •6. Лігази (синтетази)
- •Локалізація ферментів у клітині
- •Використання ферментів
- •Запитання і вправи для самоконтролю:
- •Обмін речовин Анаеробний розклад вуглеводів.
- •Г o ch2oh oh oh ho oh o ho oh глюкоза глюкозо-6-фосфат адф I II ліколіз
- •Бродіння
- •Спиртове бродіння
- •Аеробне окислення вуглеводів.
- •Ацетил - КоА
- •Щавелево-оцтова кислота
- •Теорія біологічного окислювання
- •Розпад ліпідів
- •Окиснення гліцерину
- •Окиснення насичених жирних кислот
- •Енергетика -окиснення жирних кислот
- •Біосинтез ліпідів Біосинтез гліцерину
- •Біосинтез жирних кислот
- •Біосинтез тригліцеридів
- •Основні перетворення ліпідів у харчовій промисловості
- •Запитання і вправи для самоконтролю:
- •Катаболізм амінокислот.
- •Орнітиновий цикл синтезу сечовини:
- •Біосинтез білку.
Ферменти
Ферменти є органічними сполуками білкової природи, які утворюються в живих організмах, і здатні прискорювати перебіг хімічних реакцій в організмі. Від інших каталізаторів ферменти відрізняються тим, що в природі вони зустрічаються лише в живих організмах, мають високу специфічність і каталітичну дію. Всі хімічні реакції, які відбуваються за участю ферментів, проходять при нормальному тиску, температурі, близькій до кімнатної, при слабокислій, нейтральній або слабколужній (у більшості випадків) реакції середовища і т.д.
Прості ферменти
Прості (однокомпонентні) ферменти представлені одним або кількома поліпептидними ланцюгами і при гідролізі розщеплюються до амінокислот.
Складні ферменти
Складні (двокомпонентні) ферменти крім білкової частини містять групу небілкової природи – кофактор. Усі кофактори ферментів поділяються на коферменти, простетичні групи та активатори.
Коферменти зв’язані з білковою частиною ферменту слабкими електростатичними або вандерваальсівськими силами (НАД+, НАДФ+, ліпоєва кислота, кофермент А).
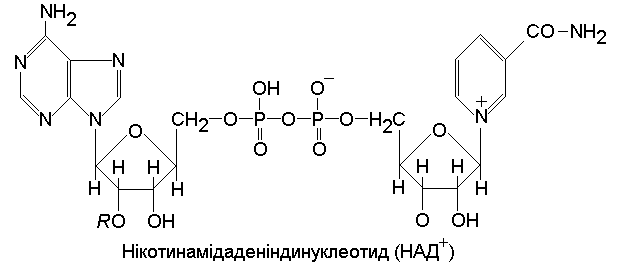
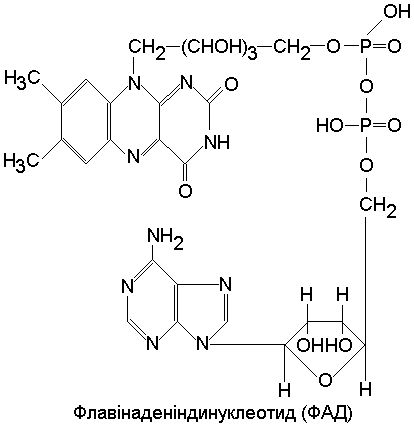
Простетичні групи зв’язані з апоферментом ковалентними зв’язками (ФМН, ФАД, ТПФ).
До активаторів ферментів належать такі кофактори, які прискорюють реакції, що каталізуються ферментами. Активаторами часто є іони металів – магнію, цинку, марганцю, кобальту та ін.
Активний центр ферментів
Субстрат зв’язується не з усією молекулою, а з окремою її ділянкою, яка називається активним центром. Активний центр визначає специфічність і каталітичну активність ферменту.
У складних ферментах (протеїдах) активний центр утворений кофактором і залишками амінокислот; у простих ферментах (протеїнах) активний центр представлений певною комбінацією залишків амінокислот, які розміщені на відповідній ділянці молекули ферменту.
Механізм дії ферментів
Більшість дослідників вважають, що механізм дії ферментів у процесах каталізу тих чи інших реакцій пов’язаний з утворенням фермент-субстратних комплексів. За цих умов фермент змінює молекулу субстрату так, що енергія, яку необхідно прикласти для переведення її в активний стан, значно зменшується.
Під час каталітичного процесу утворення фермент-субстратного комплексу відбувається поетапно. На першому етапі ферментативного каталізу субстрат з’єднується з ферментом, на другому – відбуваються активація і видозмінення субстрату з утворенням одного або кількох активованих комплексів і на останньому (третьому) етапі – відділення продуктів реакції від ферменту. Схематично ці етапи можна показати так:
Е + S ES ES* Е + Р,
де Е – фермент; S – субстрат; ЕS – первинний фермент-субстратний комплекс; ES* – активований комплекс; Р – продукт реакції.
Властивості ферментів
1. Активність ферментів. Характерною особливістю дії ферментів є їх висока каталітична активність. Вона значно вища, ніж неорганічних каталізаторів.
Активність ферментів характеризується швидкістю хімічних реакцій, які вони каталізують.
Активність ферментів виражають в одиницях, які називаються каталами (скорочено кат.). Катал – це каталітична активність, яка здійснює хімічне перетворення 1 моль субстрату за 1 с.
2. Вплив температури на активність ферментів. Ферменти – термолабільні речовини. Зміна температури зумовлює зміну їх активності. Так, підвищення температури на 10 оС прискорює швидкість хімічних реакцій приблизно в 2 рази. Однак ферменти є білками і підвищення їх каталітичної активності відбувається доти, поки не починається денатурація білка. Денатурація ферменту викликає руйнування його нативної структури, а це, в свою чергу, зумовлює втрату ферментативної активності.
Температура, при якій фермент має максимальну активність, називається оптимальною температурою ферменту. Для більшості ферментів, виділених з організму людини і тварин, оптимальна температура коливається від 37 до 45 оС.
3. Вплив рН середовища на активність ферментів. Активність ферментів досить чутлива до кислотності середовища.
Вважають, що вплив концентрації водневих іонів на активність ферментів пов’язаний насамперед з їх дією на активні центри ферментів. Залежно від рН середовища активний центр ферменту може бути в різній мірі іонізований, що впливає на формування активного фермент-субстратного комплексу.
4. Специфічність дії ферментів. Під специфічністю дії ферментів розуміють відповідну спрямованість їх впливу на певний субстрат, групу субстратів, близьких за своїми властивостями, або певний тип зв’язку. Залежно від цього розрізняють абсолютну, відносну (групову) і просторову (стереоізомерну) специфічність ферментів.
Абсолютна специфічність. Ферменти, які каталізують лише одну реакцію і діють на один точно визначений субстрат, мають абсолютну специфічність (уреаза каталізуює гідролітичне розщеплення сечовини).
Групова специфічність характерна для ферментів, які діють на різні субстрати, що мають однаковий тип зв’язку (естерази каталізують гідролітичне розщеплення зв’язку складноефірного типу).
Стереоізомерна (просторова) специфічність ферментів виявляється тоді, коли вони діють на оптично активні сполуки, або сполуки, для яких характерна цис- і транс-ізомерія (наприклад, це такі ферменти, які каталізують окислення тільки L-амінокислот або тільки D-амінокислот).
Активність ферментів часто змінюється під дією різних хімічних сполук, що знаходяться в середовищі. Речовини, які підвищують активність ферментів, називаються активаторами, а ті, що знижують їх активність, - інгібіторами.
