
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект практических занятий физическая химия
- •Применение первого начала термодинамики к процессам в идеальных газах
- •Расчет теплоемкости Вычисление средней теплоемкости
- •Расчет теплоемкости по Нейману и Коппу
- •Расчет теплоемкости твердого вещества по Эйнштейну-Дебаю
- •Расчет теплоемкости газа по квантово-статистической теории
- •Расчет количества теплоты для нагревания/охлаждения вещества
- •Вычисление теплового эффекта химической реакции Вычисление теплового эффекта химической реакции через систему термохимических уравнений
- •Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования гидратированных ионов
- •Вычисление теплового эффекта при заданной температуре
- •Вычисление теплового баланса процесса
- •Вычисление изменения энтропии химической реакции Вычисление изменения энтропии химической реакции при обычных условиях
- •Вычисление изменения энтропии химической реакции при заданной температуре
- •Вычисление энергии Гиббса химической реакции и определение направления протекания процесса Вычисление энергии Гиббса для реакций, протекающих при обычных условиях
- •Вычисление изобарно-изотермического потенциала реакций в водных растворах по стандартным энергиям Гиббса образования гидратированых ионов
- •Вычисление энергии Гиббса химической реакции при заданной температуре
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Расчет энергии Гиббса и константы равновесия при заданной температуре
- •6. Вычислить изменение энтропии реакции при 850 k:
- •8. Вычислить константу равновесия данной реакции по уравнению:
- •Метод Темкина-Шварцмана
- •Метод приведенных энергий Гиббса
- •Уравнение изобары химической реакции
- •1) Константу равновесия при данной температуре,;
- •2) Тепловой эффект реакции.
Вычисление изобарно-изотермического потенциала реакций в водных растворах по стандартным энергиям Гиббса образования гидратированых ионов
Пример 1. Вычислить изобарно-изотермический потенциал реакции K2SO4(aq) + 2AgNO3(aq) = 2KNO3(aq) + Ag2SO4(s) протекающей в водном растворе, при 298 K.
Решение. 1. Перейти от молекулярного уравнения реакции к сокращенному ионному уравнению. При составлении ионного уравнения реакции следует учитывать, что малорастворимые соединения, слабые электролиты (кислоты, основания), оксиды, газообразные вещества на ионы не диссоциируют.
А. Составить полное ионное уравнение для этой реакции, учитывая, что сульфат серебра относится к малорастворимым соединениям (осадок):
.
Б. Сократив одинаковые компоненты по обе стороны уравнения, получить сокращенное ионное уравнение:
.
2. Составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
|
Ag2SO4(s) |
, кДж/моль |
77,10 |
‒743,99 |
‒618,36 |
3. Составить уравнение для расчета изобарно-изотермического потенциала реакции и произвести необходимые вычисления:
![]()
Пример 2. Вычислить энтальпии, энтропии и энергии Гиббса растворения меди в серной кислоте при температуре 298 K. Оценить температуру начала процесса.
Решение. 1. Составить уравнение реакции растворения меди в серной кислоте:
2. Составить сокращенное ионное уравнение:
3. Составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
|
|
|
|
|
, кДж/моль |
0 |
0 |
−909,26 |
66,94 |
‒296,90 |
‒285,83 |
, Дж·моль−1·K−1 |
33,14 |
0 |
18,20 |
‒92,72 |
248,07 |
69,95 |
, кДж/моль |
0 |
0 |
‒743,99 |
65,56 |
‒300,21 |
‒237,23 |
4. Составить уравнение для расчета теплового эффекта реакции и произвести необходимые вычисления:

5. Составить уравнение для расчета изменения энтропии и произвести необходимые вычисления:

6. Составить уравнение для расчета изобарно-изотермического потенциала реакции и произвести необходимые вычисления:
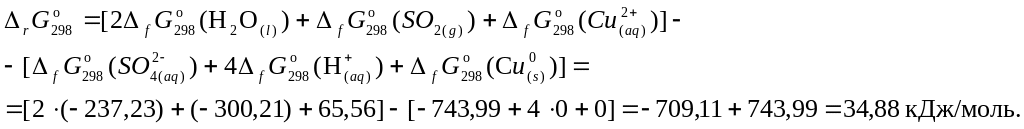
7.
Из условия равновесия в первом приближении:
![]() выразить температуру начала процесса
и произвести вычисления:
выразить температуру начала процесса
и произвести вычисления:
![]() .
.
Пример
3. Вычислить
изменение энергии Гиббса гидратации
аниона хлора:![]()
Решение. 1. Составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
|
, кДж/моль |
-239,86 |
-131,29 |
2. Составить уравнение для расчета изменения энергии Гиббса реакции и произвести необходимые вычисления:
![]()
Пример 4. Вычислить изменение энергии Гиббса гидролиза карбоната натрия по второй ступени
Решение. 1. Составить ионное уравнение гидролиза карбонат-иона по второй ступени:
![]()
2. Составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
|
|
|
, кДж/моль |
-586,56 |
-237,23 |
-623,00 |
-157,35 |
2. Составить уравнение для расчета изменения энергии Гиббса реакции и произвести необходимые вычисления:
Пример 5. Вычислить изменение энергии Гиббса диссоциации ортофосфорной кислоты по первой и второй ступеням.
Решение. 1. Составить уравнение диссоциации ортофосфорной кислоты по первой ступени
![]()
2. Составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
|
|
, кДж/моль |
-1143 |
0 |
-1130,34 |
3. Составить уравнение для расчета изменения энергии Гиббса реакции и произвести необходимые вычисления:
![]()
4. Составить уравнение диссоциации ортофосфорной кислоты по второй ступени
![]()
5. Составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
|
|
, кДж/моль |
-1130,34 |
0 |
-1089,28 |
6. Составить уравнение для расчета изменения энергии Гиббса реакции и произвести необходимые вычисления:
![]()
7. Вывод. Изменение энергии Гиббса диссоциации ортофосфорной кислоты по первой ступени меньше, чем изменение энергии Гиббса диссоциации ортофосфорной кислоты по второй ступени, следовательно, по второй ступни процесс диссоциации идет хуже, чем по первой.
Пример 6. Вычислить изменение энергии Гиббса растворения сульфата магния и сульфата бария в воде. Сопоставить растворимость этих соединений
Решение. 1. Составить уравнение растворения сульфата магния:
![]()
2. Составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
|
|
, кДж/моль |
-1173,25 |
-455,24 |
-743,99 |
3. Составить уравнение для расчета изменения энергии Гиббса реакции растворения сульфата магния и произвести необходимые вычисления:
![]()
4. Составить уравнение растворения сульфата бария:
![]()
5. Составить таблицу справочных данных, необходимых для расчета (см. таблицу 44 «Термодинамические свойства простых веществ…» краткого справочника физико-химических величин):
Компонент |
|
|
|
, кДж/моль |
-1348,43 |
-547,50 |
-743,99 |
6. Составить уравнение для расчета изменения энергии Гиббса реакции и произвести необходимые вычисления:
![]()
7. Вывод. Изменение энергии Гиббса растворения сульфата магния меньше нуля, следовательно, сульфат магния растворим. Изменение энергии Гиббса растворения сульфата бария больше нуля, следовательно, сульфат бария не растворим.
